两种不同形状碳酸钙微米颗粒对大鼠骨髓间充质干细胞增殖及成骨分化影响的研究
谷子芽 李 颖 傅 婷 张文元 杨亚冬 张科技
外伤、感染以及肿瘤都会导致骨损伤,其修复过程依赖于骨组织的再生。随着干细胞技术的发展,结合干细胞和生物材料的组织工程是骨再生医学中的一种新的治疗手段[1]。间充质干细胞是( mesenchymal stem cells,MSCs) 一类成纤维样细胞,可自我更新和多向分化,具有很强的克隆形成能力。骨髓间充质干细胞在地塞米松,骨形态蛋白( BMP) 等诱导因子的作用下,易于成骨分化,因此是一种具有良好应用前景的种子细胞[2,3]。碳酸钙( CaCO3) 是石灰石的主要无机成分,无生物毒性,组织相容性较好,自然界来源广泛,不仅在工业应用有广泛使用,近年来在药学,生物学等领域也有应用报道,可作为药物载体或组织工程支架材料[4~6]。碳酸钙颗粒其粒径大小与形状易于控制,也是骨组织工程支架材料之一。近年来,随着纳米、微米级颗粒材料的普遍应用,对这些微颗粒材料的生物相容性评价显得更为重要。
本研究通过原代培养大鼠骨髓间充质干细胞,检测两种不同形状碳酸钙微粒( 球形和方形) 对细胞行为的影响,研究碳酸钙微粒与间充质干细胞的生物相容性,为骨组织工程材料应用中碳酸钙的选择与优化提供了参考。
材料与方法
1.材料:低糖DMEM 基础培养基( Hyclone 公司) ,胎牛血清( fetal bovin serum,FBS,四季青) ,青-链霉素100 ×母液( Gibco 公司) ,地塞米松( dexamethasone,Dex,Sigma 公司) ,β-磷酸甘油钠( β-glycerophosphat,β -GP,Sigma 公司) ,维生素C( vitamin C,Sigma 公司) ,MTS 细胞增殖检测试剂盒Cell-Titer 96®AQueous one solution reagent( Promega 公司) ,碱性磷酸酶染色试剂盒( Sigma 公司) ,碱性磷酸酶活性试剂盒( 南京建成) ,BCA 蛋白浓度检测试剂盒( 碧云天公司) ,茜素红,DCFH-DA( Sigma 公司) ,抗大鼠CD29 -FITC、CD44 -FITC、CD90 -FITC、CD106 -PE 荧光标记流式抗体( 均购自Biolegend 公司) 。SD 大鼠购于浙江省医学科学院动物中心。
2.大鼠骨髓间充质干细胞原代培养: SD 大鼠( 15 天左右) 脱颈处死后75%乙醇浸泡3min。无菌条件下分离双下肢股骨胫骨,去除表面附着的肌肉。剪去骨两端,PBS 冲洗骨髓腔,收集冲洗液,1000r/min 离心5min。用含血清培养液重悬后接种入细胞培养皿。细胞培养液为添加10%胎牛血清和1%青-链霉素的低糖DMEM 培养基。流式细胞术分析P3代细胞表面间充质干细胞标记CD29、CD44、CD90、CD106 的表达。
3.碳酸钙微粒制备: 两种不同形状的碳酸钙微粒由浙江理工大学合成并提供。球形碳酸钙微粒的合成: 将100ml CaCl2溶液(0.2mol/L) 加入800ml 丝胶蛋白溶液( silk sericin,2g/L) ,25℃下持续搅拌30min。使用NaOH( 0.1mol/L) 将溶液pH 值调节至7,然后加入100ml Na2CO3溶液(0.2mol/L) ,40℃搅拌反应180min。之后将获得的碳酸钙微粒用乙醇和去离子水清洗3 遍,60℃下干燥48h。方形碳酸钙微粒合成方法相似,但不需要加入丝胶蛋白。利用扫描电子显微镜( S4800,Hitachi 公司) 观察材料微观形貌。
4.碳酸钙微粒悬液及条件培养液制备: 两种形状的碳酸钙微粒经160℃高温干烤2h 灭菌后悬浮于培养液获得10mg/ml 母液。进一步以培养液浓度梯度稀释获得50、100、200、400μg/ml 碳酸钙微粒悬液与细胞共培养。将各浓度碳酸钙微粒悬液4℃下保存24h 后,12000r/min 离心5min,吸取上清即为碳酸钙微粒的条件培养液。对照组为普通培养液培养细胞。
5.细胞增殖: 细胞以5 ×103/孔的密度接种入96 孔板。隔夜贴壁后,加入碳酸钙微粒悬液和条件培养液,每孔加入200μl,共培养7 天后,进行MTS 检测,每组设置4 个复孔。普通培养液组作为对照。按试剂盒说明书操作,最后酶标仪490nm 波长读取吸光度。以对照组吸光度均值为基准(100%) ,计算细胞增殖抑制率( %) =( A490实验组/A490对照组) ×100%。
6.颗粒黏附:细胞以2 ×105/皿的密度接种至35mm 培养皿,待90%汇合后,弃原培养液,加入两种形状的碳酸钙微粒悬液(400μg/ml,每孔2ml) 。换液后4h 及24h 进行茜素红染色观察黏附的微粒。细胞PBS 清洗3 遍后,4%多聚甲醛固定30min。去离子水清洗后,加入茜素红染液( 10mg/ml) 染色5min。去离子水清洗,照相。
7.活性氧( reactive oxygen species,ROS) 检测: 细胞按4 ×104/孔接种入24 孔板,贴壁过夜后加入两种碳酸钙微粒悬液(400μg/ml 每孔0.5ml) ,同时设立双氧水( 200μmol/L) 处理组作为阳性对照。24h 后PBS 清洗,加入用无血清培养液稀释DCFH-DA( 终浓度10μmol/L) ,培养箱孵育30min,PBS 清洗后488nm 激发波长下荧光显微镜( Olympus 公司) 观察。
8.碱性磷酸酶( alkaline phosphatase,ALP) 活性: 细胞按4 ×104/孔接种入24 孔板,贴壁过夜后加入碳酸钙微粒悬液24h,换用成骨诱导液培养( DMEM +10%FBS +10nmol/L Dex+10mmol/L β-GP+80μg/ml 维生素C +1%青-链霉素) ,每隔2 ~3 天换液。成骨诱导2 周后进行碱性磷酸酶活性的检测。每孔细胞PBS 清洗后加入400μl 0.1% Triton X-100,置4℃冰箱过夜。观察已无完整细胞结构,经震荡后,离心取裂解液上清。其余步骤按试剂盒说明书进行,520nm 波长下测定吸光度,每组设置3 个复孔,以BCA 法测定总蛋白量对磷酸酶活性标准化,562nm 波长下测定吸光度。最后获得标准化ALP 活性值( A520/A562) 。
9.碱性磷酸酶染色:实验组设置与处理同ALP 活性检测实验。成骨诱导2 周后,按碱性磷酸酶染色试剂盒要求分别固定、染色、拍照。
10.统计学方法:采用SPSS 17.0 统计软件完成统计处理,ANOVA 方差分析,Origin 7.0 做图。以P <0.05 为差异有统计学意义。
结 果
1.大鼠骨髓间充质干细胞的原代培养: 大鼠MSC 细胞呈成纤维样,细胞克隆大约在第5 ~7 天出现,生长迅速。流式细胞分析表明大部分细胞高表达间充质干细胞标志CD29、CD44、CD90( >85%) ; 但CD106 表达相对较低(5.74%) ,细胞均一性较好( 图1) 。
2.碳酸钙微粒及表征:丝胶蛋白的加入对碳酸钙微粒的形状有重要影响。SEM 结果显示: 加入丝胶蛋白组形成的碳酸钙微粒呈圆形( 图2A) ,而未加入丝胶蛋白组的碳酸钙微粒成方形( 图2B) 。两种微粒的直径都在6.5μm 左右。
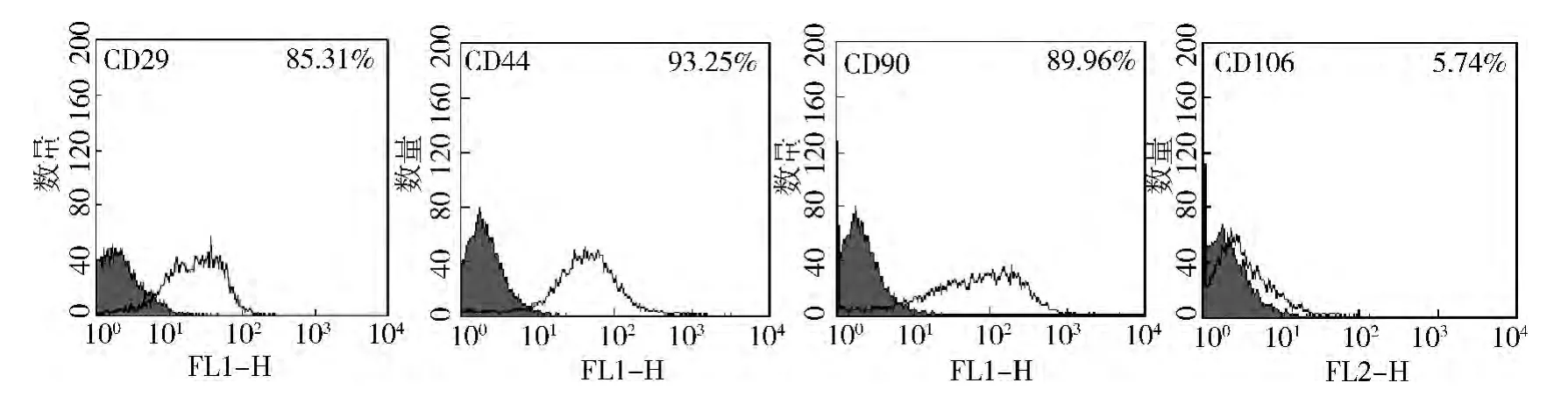
图1 大鼠间充质干细胞表面标志流式分析

图2 两种合成条件下形成碳酸钙微粒的SEM 形态
3.不同形状碳酸钙微粒对细胞增殖的影响:MTS结果显示:两种形状碳酸钙微粒直接与细胞共培养可抑制细胞增殖,且呈浓度依赖性( 图3A) 。以对照组吸光度为对象进行ANOVA分析,结果表明方形碳酸钙微粒对细胞增殖的抑制作用更明显,200μg/ml 浓度下,球形碳酸钙微粒未对细胞增殖造成明显影响,而方形微粒已出现明显抑制作用( P <0. 05) 。在400μg/ml 浓度下,两种微粒均有明显细胞增殖抑制作用( P <0.05) 。50 和100μg/ml 微粒浓度不会对细胞增殖产生抑制。所有实验浓度下,两种碳酸钙微粒的条件培养液均未对细胞增殖造成明显影响,且球形颗粒与方形颗粒的条件培养液之间不存在显著差别( 图3B) 。说明碳酸钙微粒造成的细胞抑制作用与浓度密切相关,且主要由微粒与细胞间的直接接触引起,因此微粒形状可对细胞状态产生影响。
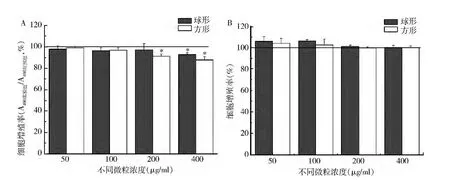
图3 MTS 检测不同浓度微粒及其条件培养液对细胞增殖的影响
4.不同形状碳酸钙微粒在细胞表面的黏附:茜素红可与钙离子结合,因此可检测黏附于细胞表面的碳酸钙颗粒。碳酸钙黏附于细胞表面的量与时间相关。两者共培养4h 时,大部分颗粒未黏附于细胞表面;24h 后,黏附颗粒量明显增加。两种共培养条件下,球形颗粒与细胞表面的黏附能力均明显高于方形颗粒( 图4) 。这可能与圆形微粒表面光滑,易于与细胞表面基质蛋白结合从而黏附于细胞表面,而方形颗粒结合相对疏松,容易被洗脱。
5.不同形状碳酸钙微粒对细胞ROS 的影响:ROS检测表明:球形颗粒与方形颗粒在高浓度(400μg/ml)下都不会对细胞ROS 造成明显影响。H2O2作用可明显增加细胞ROS,造成细胞活性氧损伤,而碳酸钙微粒与细胞共培养不会产生ROS 细胞损伤( 图5) 。
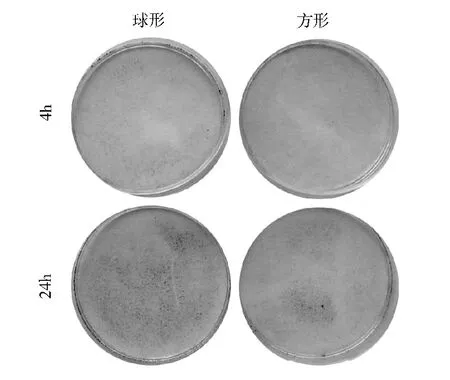
图4 茜素红染色检验两种碳酸钙颗粒与细胞共培养4h 和24h 后,在细胞表面的黏附情况

图5 ROS 活性氧检测
6.不同形状碳酸钙微粒对细胞成骨分化的影响:间充质干细胞在成骨诱导液作用下可发生成骨分化,碱性磷酸酶ALP 活性提高是成骨分化的重要标志之一。碳酸钙微粒与细胞共培养可明显抑制ALP 活性,且呈一定浓度依赖性。ALP 染色显示高浓度碳酸钙微粒(400μg/ml) 下染色强度明显低于对照组和低浓度碳酸钙微粒处理组( 图6) 。ALP 活性检测结果相似:所有浓度下碳酸钙微粒均造成ALP 活性降低,高浓度( 400μg/ml) 下,方形碳酸钙微粒显示最高ALP 活性抑制能力,明显低于相同浓度下的球形碳酸钙微粒( 图7) 。
讨 论

图6 ALP 染色法检测球形和方形碳酸钙微粒对ALP 活性影响
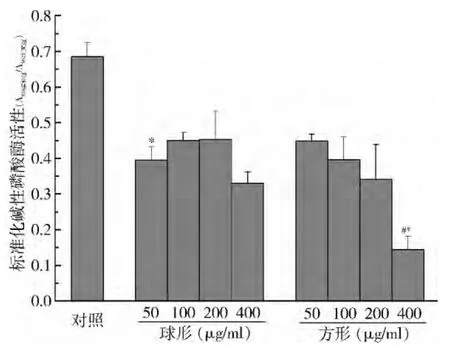
图7 ALP 活性检测
细胞和支架材料是组织工程中最重要的两个部分。骨髓间充质干细胞具有高度自我更新能力和多向分化能力,是组织工程中常用的“种子细胞”。碳酸钙微粒是常用的骨组织工程支架材料之一,同时也是模版法合成羟基磷灰石微粒的重要前体[7]。由于碳酸钙微粒的粒径、形状易于调控,对控制羟基磷灰石的性状也具有重要意义[8]。近年来研究表明: 无机材料的粒径、形状对细胞毒性有重要影响[9,10]。目前研究普遍认为大部分纳米级材料毒性高于微米级材料,但材料形状的影响研究相对较少。本研究合成了两种不同形状的碳酸钙微粒,探讨其对大鼠骨髓间充质干细胞增殖、分化等影响,为支架材料的选择与生物毒性研究打下基础。
随着微米、纳米级材料在生物医学领域应用的增加,对材料生物相容性和毒性评价的研究更为重要。本研究使用了球形和方形两种不同形状,粒径相似的碳酸钙微粒,比较了它们对间充质干细胞的生物毒性。两种颗粒在高浓度下均对细胞增殖造成抑制,相同浓度处理下方形微粒抑制能力明显高于球形颗粒。然而微粒条件培养液不会造成细胞增殖抑制,说明微粒造成的细胞增殖抑制主要是由于细胞和微粒的直接接触造成的。ROS 是生物有氧代谢过程中的一类产物,包括氧离子、过氧化物和含氧自由基等,是正常氧代谢的副产物,在正常细胞信号通路中也有重要作用。然而,一些外界刺激导致明显的细胞结构的损坏,可引起ROS 的量急剧增多,被称为氧化应激反应。本研究显示,高浓度下两种碳酸钙微粒与细胞共培养并不会造成细胞ROS 损伤,说明碳酸钙微粒造成的细胞毒性不是通过ROS 提高引起的。碳酸钙微粒对细胞成骨分化影响实验与细胞增殖实验结果相似。球形和方形碳酸钙微粒均抑制ALP 活性,高浓度微粒的抑制更明显。相同浓度下,方形碳酸钙微粒造成ALP 活性抑制更显著。这可能与方形微粒抑制细胞增殖更严重有关。
Huang 等[11]发现纳米颗粒对细胞毒性明显高于微米颗粒,可造成ROS 明显上升。Zhao 等[10]则发现纳米颗粒的形状对细胞毒性有重要影响。ROS 是纳米颗粒细胞毒性的主要原因之一,这可能与细胞吞噬纳米颗粒造成细胞内环境改变有关。纳米颗粒形状对细胞膜完整性影响也是造成纳米颗粒毒性的重要原因[12]。微米级颗粒形状对细胞影响未见相关报道,细胞对微米颗粒的吞噬低于纳米颗粒,因此微米颗粒毒性较低。MSC 本身属于非吞噬细胞,微米颗粒进入细胞量可能较少,然而微粒形状仍可对细胞生理活动产生一定影响,这可能是通过对细胞膜作用产生的。球形微粒表面光滑,对细胞膜刺激可能低于相似粒径的方形微粒。本研究后续拟对两种微粒制备2D 或3D 材料支架,进一步研究细胞在微粒表面的行为差别,观察不同形状微粒表面与细胞膜接触造成的刺激对细胞行为的影响,以期对颗粒形状造成细胞行为影响的机制进行深入探讨。
综上所述,以间充质干细胞为模型研究表明,球形碳酸钙微粒的生物相容性优于相同粒径的方形碳酸钙微粒。球形微粒在流动性上也较方形微粒更为理想,更适合应用于支架材料的制备。因此,尽管球形微粒制备工艺更为复杂,其仍是组织工程应用的理想选择。
1 Dimitriou R,Jones E,McGonagle D,et al. Bone regeneration: current concepts and future directions[J]. BMC Med,2011,9: 66
2 Pang YG,Cui PC,Chen WX,et al. Experimental research using human bone marrow mesenchymal stem cells as the seed cells for bone and cartilage tissue engineering[J]. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi,2004,20(3) : 306 -309
3 Yang M,Zhang H,Gangolli R. Advances of mesenchymal stem cells derived from bone marrow and dental tissue in craniofacial tissue engineering[J]. Curr Stem Cell Res Ther,2014,9(3) : 150 -161
4 Ohgushi H,Okumura M,Yoshikawa T,et al. Bone formation process in porous calcium carbonate and hydroxyapatite[J]. J Biomed Mater Res,1992,26(7) : 885 -895
5 Shen Y,Zhu J,Zhang H,et al. In vitro osteogenetic activity of pearl[J]. Biomaterials,2006,27(2) : 281 -287
6 Asvanund P,Chunhabundit P,Suddhasthira T. Potential induction of bone regeneration by nacre: an in vitro study[J]. Implant Dent,2011,20(1) : 32 -39
7 Zhu H,Schulz J,Schliephake H. Human bone marrow stroma stem cell distribution in calcium carbonate scaffolds using two different seeding methods[J]. Clin Oral Implants Res,2010,21(2) : 182 -188 8 Liu J,Liu Y,Kong Y,et al. Formation of vaterite regulated by silk sericin and its transformation towards hydroxyapatite microsphere[J].Materials Letters,2013,110(2013) : 221 -224
9 Yuan Y,Liu C,Qian J,et al. Size-mediated cytotoxicity and apoptosis of hydroxyapatite nanoparticles in human hepatoma HepG2 cells[J]. Biomaterials,2010,31(4) : 730 -740
10 Zhao X,Ng S,Heng BC,et al. Cytotoxicity of hydroxyapatite nanoparticles is shape and cell dependent [J]. Arch Toxicol,2013,87(6) : 1037 -1052
11 Huang Y,Zhou G,Zheng L,et al. Micro- /nano-sized hydroxyapatite directs differentiation of rat bone marrow derived mesenchymal stem cells towards an osteoblast lineage [J]. Nanoscale,2012,4(7) : 2484 -2490
12 Chen L,McCrate JM,Lee JC,et al. The role of surface charge on the uptake and biocompatibility of hydroxyapatite nanoparticles with osteoblast cells[J]. Nanotechnology,2011,22(10) : 105708

