贵州地区汉族肺癌患者单核细胞趋化蛋白-1 -2518 A/G 基因多态性的研究
金艳坤 井晓婷 罗 靖 余 红 张 雯 张湘燕 叶贤伟
支气管肺癌是严重危害人类健康的疾病,有资料显示,肺癌无论是年发病人数还是年死亡人数,均位居全球癌症首位[1]。肺癌是一种与环境因素、生活方式及遗传因素有关的恶性疾病,其发生、发展与炎性介质和某些与癌发病相关的基因多态性有关,并存在一定的遗传易感性差异和家族聚集性[2,3]。单核细胞趋化蛋白-1( monocyte chemoattractant protein -1,MCP-1) 是CC 类趋化因子,是一种重要的炎性细胞因子,参与机体多种炎性反应过程,研究表明MCP-1 -2518 基因多态性可能与恶性肿瘤的易感性相关[4,5]。目前MCP-1 基因多态性与肺癌关系的相关研究少见。笔者采用聚合酶链反应-限制性片段长度多态( PCR-RFLP) 技术进行基因多态性的检测,以期发现MCP-1 -2518 基因多态性与肺癌遗传易感性的相关性。
材料与方法
1.研究对象:选取2013 年3 ~12 月在贵州省人民医院呼吸与危重症医学科住院治疗的肺癌患者90 例作为实验组,其中男性58 例,女性32 例,患者年龄40 ~79 岁,平均年龄57.5±11.3 岁。32 例同期健康体检者作为对照组,其中男性19例,女性13 例,年龄42 ~76 岁,平均年龄55.7 ±13.1 岁。实验前所有受试者均签署知情同意书。两组受试者均排除严重心血管疾病、肝肾功能不全、自身免疫性疾病、急性或严重慢性感染性疾病等,且相互间无血缘关系。经检验,两组间年龄、性别差异无统计学意义,具有可比性。
2.实验方法:(1) 实验标本收集 所有研究对象均于清晨空腹抽取外周静脉血2ml( EDTA 抗凝) ,摇匀后置于-80℃冰箱保存,用于基因组DNA 的提取。( 2) MCP -1 基因多态性检测:1) 全血基因组DNA 的提取: 使用TIANamp Genomic DNA Kit 血液/细胞/组织基因组DNA 提取试剂盒提取DNA,提取的DNA 进行紫外分光光度检测。2) 引物合成及PCR 扩增:根据参考文献[6],合成引物。上游引物:5' -TTCTCTTCTACGGGATCTGGG -3',下游引物: 5' - GTCTCTCCTGGCTTTAGTCAT-3'。进行PCR 扩增: 第1 阶段94℃3min; 第2 阶段:94℃30s,55℃30s,72℃1min,循环30 次;第3 阶段:72℃5min。3) PCR 产物的检测、限制性酶切:PCR 产物进行琼脂糖凝胶电泳,使用紫外线凝胶成像系统判定目的条带。扩增产物用PvuⅡ限制性内切酶进行酶切。酶切产物在2%琼脂糖凝胶上进行电泳,使用紫外线凝胶成像系统观察酶切结果并成像。
3.统计学方法:对实验对象进行Hardy -Weinberg 遗传平衡检验,以了解所收集的标本是否具有良好的群体代表性( P>0.05) 。使用SPSS 19.0 统计软件对实验数据进行统计学处理。采用χ2检验对不同两组间基因型或等位基因分布频率的差异进行比较,P <0.05 为差异有统计学意义。对频率差异有统计学意义的基因型或等位基因进行比值比( odds ratio,OR) 及其95%可信区间( confidence interval,CI) 的计算,OR 表示相对风险度。
结 果
1. MCP -1 -2518A/G 基因多态性结果分析:(1) MCP-1 -2518A/G 位点PCR 扩增后琼脂糖凝胶电泳结果: 扩增目的DNA 片段为466bp。PCR 产物在2%琼脂糖凝胶电泳证实,在400 ~500bp 之间有一条清晰的电泳带,说明目的DNA 的PCR 扩增成功( 图1) 。(2) MCP-1 -2518A/G 位点PCR 产物PvuⅡ酶切后琼脂糖凝胶电泳结果: DNA 片段经限制性内切酶PvuⅡ酶切后,在2%琼脂糖凝胶上电泳观察3 种基因型:AA 基因型仅见1 条466bp 的电泳带,GG基因型有327bp 和139bp 两条电泳带,AG 基因型有466bp、327bp 和139bp 3 条电泳带( 图2) 。

图1 MCP-1 -2518G/A PCR 扩增产物电泳图
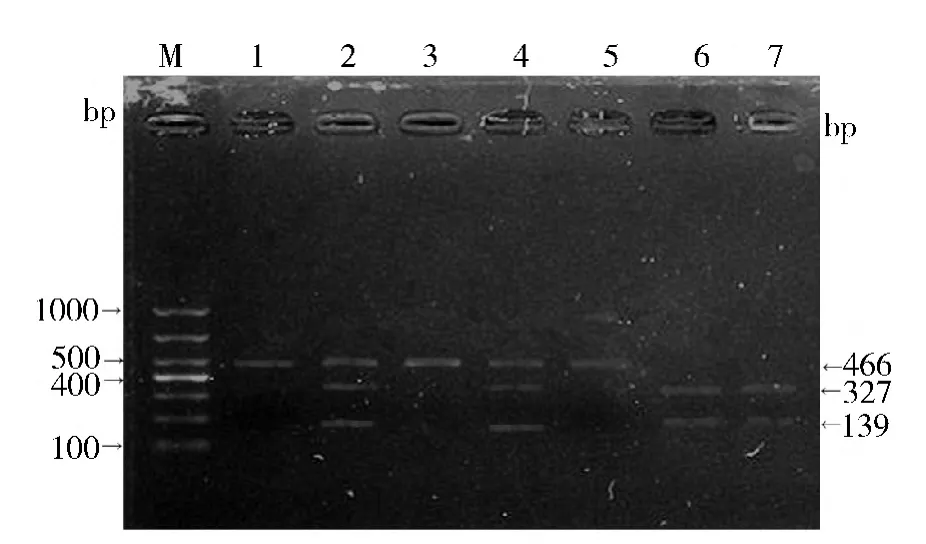
图2 MCP-1 -2518G/A PCR 产物PvuⅡ酶切后电泳图
2.MCP-1 -2518A/G 多态性基因型分布在实验组与对照组的比较: 经验证,基因型在实验组和对照组的分布频率符合Hardy -Weinberg 遗传平衡,具有群体代表性。对照组中AA、AG、GG 基因型的分布频率分别为:6.2%、46.9%、46.9%; 实验组中分别为:26.7%、46.6%、26.7%;3 种基因型在两组间分布频率差异具有统计学意义( P =0.022,表1) 。经χ2检验及风险性分析得出,AA 基因型个体患肺癌的相对风险度高,GG 基因型个体患肺癌的相对风险度较低,携带A 等位基因的个体患肺癌的相对风险是携带G 等位基因个体的2.368 倍,A 等位基因在病例组和对照组的分布频率差异具有统计学意义( 表2) 。

表1 实验组和对照组MCP-1 -2518A/G 基因型频率Hardy-Weinberg 平衡及组间比较[n( %) ]

表2 基因型和等位基因分布频率在两组中的比较[n( %) ]
讨 论
单核细胞趋化蛋白-1( monocyte chemoattractant protein-1,MCP-1) 是CC 类趋化因子,位于17 号染色体上,包含3 个外显子和两个内含子,是一种重要的炎性细胞因子,参与机体多种炎性反应过程。目前研究显示MCP-1 可通过向肺癌组织内趋化单核-吞噬细胞、促进肿瘤血管生成、肿瘤免疫逃逸等途径影响肺癌的发生、发展[7]。Rovin 等[8]研究发现在MCP-1 元的调控区-2518A/G 位点,存在A -G 碱基突变,即AA、AG、GG 3 种基因型。MCP - 1 -2518A/G 位点突变可能影响MCP -1 的表达而影响肿瘤免疫效应,最终影响肿瘤的发病。多个研究表明MCP-1 基因-2518 位点A/G 多态性在一定程度上可以影响到肿瘤的遗传易感性,并在肿瘤的发生、发展过程中起着重要的作用[4,5]。尽管MCP-1 及其多态性与肿瘤关系密切,但由于肿瘤的类型及地域、种族、环境及饮食等方面的差异均可能导致研究结果的不同,且目前MCP-1 基因多态性与肺癌关系的相关研究少见。
目前认为肺癌的发生与炎性反应关系密切。炎症部位的细胞、分子或基因的改变对肺癌的发生、进展起着重要作用。慢性或持续性炎症可诱导炎性细胞大量聚集,产生多种炎性细胞和趋化因子并引起级联反应,诱导正常细胞DNA 氧化损害,激活癌基因,导致肿瘤发生。近年来研究证实肿瘤微环境的产生对肿瘤发生有关键作用。炎性反应引起肿瘤微环境募集大量巨噬细胞,中性粒细胞清除延迟、活性氧物质增加,引起肿瘤发生,微环境中的生长因子和血管生成因子使肿瘤部位的血管生成,促进肿瘤细胞增殖和转移。肺内微环境改变可激活肺癌发生的相关信号通路、导致慢性炎症发生。慢性持续性感染可以引起支气管-肺泡干细胞增殖,致肺上皮细胞癌变,还能使基因组不稳定,引起DNA 损伤、癌基因激活或抑癌基因失活[9,10]。
基因多态性可导致人类患各种疾病的易感性不同,人类MCP-1 -2518A/G 基因多态性存在种族差异性。曾有报道,墨西哥人和亚洲人群携带G 等位基因者较高加索人和非洲人群多[11]。中国台湾地区人群MCP-1 -2518 的G 等位基因频率为52.4%,与已证实的亚洲人群(47%) 和墨西哥人群(47%) 相似,而高加索人群的G 等位基因频率为29%,而非裔美国人的G 等位基因更低,只有22%[12]。土耳其人A 和G 等位基因的频率分别为71%和29%、高加索人 为 73% 和 27%、韩 国 人 分 别 为 39.8% 和60.2%[13~15]。
本研究将90 例肺癌患者和32 例健康对照的MCP-1 -2518A/G 基因位点基因型进行检测,结果显示在贵州地区汉族人群中存在MCP-1 -2518A/G基因多态性,健康人群的AA、GG、AG 基因型的分布频率与上述亚洲人群基因分布频率相似[10,12];MCP-1 -2518A/G 3 种基因型在实验组和对照组中频率分布差异具有统计学意义:在实验组中AA 基因型的频率明显较对照组高,GG 基因型频率明显较低,AA 基因型个体患肺癌的相对风险度高,GG 基因型个体患肺癌的相对风险度较低;A 等位基因在实验组和对照组的分布频率差异有统计学意义( P <0.05) ,即携带A 等位基因的个体患肺癌的相对风险是携带G 等位基因个体的2.368 倍,提示MCP -1 -2518A/G 中A 等位基因可能是贵州地区汉族人群患肺癌的遗传易感基因。
1 葛均波,徐永健,等. 内科学[M].8 版. 北京: 人民卫生出版社,2013:75
2 郝罡,王文静,陆晔,等.TNF-α、IL-1β 和IL-10 启动子区基因多态性与肺发病易感性的关系研究[J].环境与职业医学,2009,1(26) :24 -27
3 周舫,李伟辉,任文杰,等.肿瘤坏死因子TNF-β +252 基因多态性与肺癌遗传易感性[J]. 现在预防医学,2011,38( 7) : 1328 -1335
4 Vázquez-Lavista LG,Lima G,Gabilondo F,et al.Genetic association of monocyte chemoattractant protein 1 ( MCP -1) -2518 polymorphism in Mexican patients with transitional cell carcinoma of the bladder[J].Urology,2009,74(2) :414 -418
5 Ghilardi G,Biondi ML,La TA,et al. Breast cancer progression and hostpolymorph-isms in the chemokine system:role of the macrophage chemoattractant protein - 1( MCP - 1) - 2518 G allele[J]. Clin Chem,2005,51:452
6 杨磊,时广利,宋长兴,等. 中国北方地区汉族人群MCP -1 基因多态性与肺癌相关性研究[J]. 中华微生物学和免疫学杂志,2010,30(4) :336 -339
7 王威,周未花,叶军辉,等.肺癌和结核性胸腔积液/血清MCP -1及其受体CCR2 的测定及临床意义[J]. 中国高等医学教育,2012,2:142 -143
8 Rovin BH,Saxena R,Lu L,et al. A novel polymorphism in the MCP-1 gene regulatory region that influences MCP - 1 expression[J]. Biochemical And Biophysical Research Communications,1999,259(2) :344 -348
9 Houghton AM,Mouded M,Shapiro SD.Common origins of lung cancer and COPD[J].Nat Med,2008,14(10) :1023 -1024
10 刘晶,王朝霞.慢性炎症与肺癌发病关系的研究进展[J]. 中华结核和呼吸杂志,2013,36(8) :603 -605
11 马芙蓉,倪安民,任建功,等.单核细胞趋化蛋白1 基因多态性与2型糖尿病的相关性研究[J].临床荟萃,2007,22(6) :396 -399
12 Liu SF,Wang CC,Fang WF,et al. MCP1 -2518 Polymorphism and chronic obstructive pulmonary disease in Taiwanese men[J]. Experimental Lung Research,2010,36(5) :277 -283
13 Ozyurek AR,Gurses D,Ulger Z,et al.Allelic frequency of the MCP-1 promoter - 2518 polymorphism in the Turkish population and in Turkish patients with juvenile rheumatoid arthritis[J]. Clin Rhewmatol,2007,26(4) :546 -550
14 Zietz B,Buchler C,Herfarth H,et al. Caucasian patients with type 2 diabetes mellitus have elevated levels of monocyte chemoattractant protein-1 that are influenced by the-2518A/G promoter polymorphism[J].Diabetes Obes Metab,2005,7(5) :570 -578
15 Hong SB,Jin SY,Park HJ,et al. Analysis of the monocyte chemoattractant protein 1 -2518 promoter polymorphism in Korean patients with alopecia areata[J].J Korean Med Sci,2006,21(1) :90 -94

