过氧化物酶体增殖物激活受体-γ激动剂在急性胰腺炎NF-κB活化通路中的作用
陆贝 于源泉 殷俊杰 蔡阳
杭州市第一人民医院肝胆外科,浙江杭州310006
过氧化物酶体增殖物激活受体-γ激动剂在急性胰腺炎NF-κB活化通路中的作用
陆贝 于源泉 殷俊杰 蔡阳
杭州市第一人民医院肝胆外科,浙江杭州310006
急性胰腺炎尤其是重症急性胰腺炎的发生发展与炎症细胞的过量产生有关,其中NF-κB可参与许多炎症细胞因子的调控,是SIRS和MODS环节的重要信使。过氧化物酶体增殖物激活受体-γ(PPAR-γ)激动剂也是细胞炎症反应的调节剂,可通过抑制NF-κB调节炎症反应,改善胰腺及胰外器官的损伤,是当前胰腺炎信号通路研究的热点。
急性胰腺炎;过氧化物酶体增殖物激活受体;核因子-κB
急性胰腺炎(acute pancreatitis,AP)时,炎症介质、细胞因子的过量产生与多器官功能衰竭(multiple organ dysfunction,MODF)的出现呈明显的因果关系。其中NF-κB可参与许多炎症细胞因子的调控,是SIRS和MODS环节的重要信使。2003年Hashimoto等[1]首次在AP大鼠实验中发现PPAR-γ激动剂可能治疗急性胰腺炎。研究发现过氧化物酶体增殖物激活受体-γ(peroxisome proliferators-activated receptor-γ,PPAR-γ)激动剂在胰腺炎的全身炎症反应过程中起重要调节作用,通过调控相关炎症介质的表达,改善胰腺及胰外多器官的损伤。NF-κB是AP中细胞因子级联瀑布反应的上游靶点,同时在SIRS、MODS环节中起着“信使”作用。PPAR-γ激动剂是否可能通过抑制核转录因子NF-κB的活化通路控制急性胰腺炎的进展、减轻胰外器官损害是当前胰腺炎信号通路研究的热点。PPAR-γ激动剂与AP之间关系的研究不少,但有关NF-κB及相关下游因子信号通路的文献报道不多。本文就PPAR-γ激动剂对胰腺炎NF-κB通路的调节和多器官保护作用的研究现状与前景作一概述。
1 急性胰腺炎与NF-κB通路
研究表明AP相关信号通路较多,NF-κB及其下游有关因子是其中较为重要的一条。核因子κB在炎症、免疫、再生、修复等生理病理过程中均有不同程度表达,是调控炎症因子的转录基因。通常其未活化状态下为p50/p65二聚体,在病理生理情况下被激活为活化的NF-κB。一般激活NF-κB的因素包括:肿瘤坏死因子-α、生长因子、白细胞介素、病毒蛋白、脂多糖、蛋白激酶C、氧自由基、内毒素、缺血-再灌注、放射线等。一般认为内外刺激通过细胞膜受体传递信号至细胞内,κB抑制蛋白与NF-κB解离后NF-κB进入细胞核,与基因启动子或增强子的特异性序列结合,NF-κB活化,启动基因转录。靶细胞基因研究方法表明活化NF-κB的必需亚基是IKKβ介导的促炎细胞因子。NF-κB状态的激活同时受正负反馈调节,其中负反馈为主[2]。
Dunn等[3]早在1997年发现NF-κB的活化是重要的AP早期事件,在AP的发生、发展中作用显著。Altavilla等[4]发现用雨蛙素诱导的急性胰腺炎大鼠,胰腺组织中NF-κB含量升高较早。之后大量实验(动物实验)发现AP和SAP的整个发病过程几乎都有NF-κB活化的参与。在正常组织脏器内NF-κB的检测水平几乎为零。但在胰腺炎SD大鼠模型中胰腺组织细胞及胰外器官组织细胞内NF-κB活性度明显增强,同时外周血及组织内炎症细胞因子水平明显上升。AP时胰腺细胞内首先产生大量细胞因子,导致胰腺腺泡细胞直接损伤,随之通过循环系统进入肺、肝、内皮细胞和单核巨噬细胞等组织细胞内,最终呈现全身活化,相继引起多脏器损伤[5]。
AP时由于胰酶大量释放,相关信号通路被激活,非活化NF-κB转化为活化NF-κB,刺激促炎细胞因子释放,最终诱导经典的SIRS、MODS过程。
迄今为止,关于NF-κB状态激活的相关信号通路有几种经典理论:①磷脂肌醇信号途径理论。PKC(protein kinase C)磷酸化IκB,NF-κB与IκB解离,NF-κB被激活。此途径中C与胰腺炎的发生发展有关。②钙依赖/非依赖性信号途径理论。AP时胞浆内异常钙离子信号可由胆汁酸等代谢产物引发。钙离子螯合剂(BAPTA)能减少NF-κB的活化[6]。③PKB/Akt信号通路。活化的丝氨酸/苏氨酸激酶能够作用于NF-κB及凋亡蛋白,选择性PI3K/Akt抑制剂可减少AP中NF-κB活化,减轻AP时胰腺组织细胞及胰外器官组织细胞的损伤程度[7]。丝氨酸/苏氨酸蛋白激酶信号途径在AP局部及全身炎症反应中活化,结果与NF-κB活化相关。④诱导型一氧化氮合酶(iNOS)和环氧合酶2(COX-2)信号途径。iNOS、COX-2均为信号蛋白分子,iNOS与COX-2协同作用直接导致胰腺细胞的蛋白质和DNA损伤,同时也导致NF-κB活化[8]。⑤p38相关信号通路。多种细胞因子可激活p38MAPK,促使细胞增殖分化,并使NF-κB活化[9],分裂原激活的蛋白激酶信号途径是细胞信号传导的中转站。⑥TNF-α信号通路。TNF-α是AP启动因子,激活TNF-α可诱发白细胞介素等多种细胞因子释放,然后与NF-κB相关位点结合,可通过TNF-α信号途径激活NF-κB[10]。但关于NF-κB活化在AP患者中表达的研究报道却很少提及,Satoh等[11]检测45例AP患者入院和AP发病后14 d外周血单核细胞NF-κB活性,入院患者NF-κB和P50/P65二聚体水平普遍较高,轻症AP患者外周血单核细胞在内毒素刺激下NF-κB活性进一步增高,而SAP患者外周血单核细胞则不敏感。O’Reilly等[12]研究也有类似情况发现,AP患者发病24 h后外周血单核细胞的NF-κB活性较高,认为重症和轻症AP患者间NF-κB表达程度并无差异,但NF-κB DNA结合力持续高、NF-κB活性变化小、P50/P65比值低的患者2周后全身并发症发生率高且严重。
NF-κB蛋白因子因具有转录调节作用,参与包括TNF-α、IL-l、IL-6、IL-8、黏附分子等重要细胞因子的调控,因此NF-κB被认为是AP炎症级联瀑布反应的上游靶点。NF-κB可能调控SAP的启动,同时在SIRS、MODS环节中发挥作用。NF-κB活化抑制后可明显减少外周血炎症细胞因子的释放,减轻胰外器官的损害。更多研究发现NF-κB抑制剂可有效减轻AP的严重程度,降低SAP死亡率。因此AP治疗的新靶点与NF-κB活化抑制相关[13]。
国内外有较多动物实验证明,早期阻止NF-κB活化能有效减少SAP的致死率。一些抗肿瘤药物如姜黄素、5-FU以及某些抗生素如胶霉素、格尔德霉素及渥曼青霉素等可降低胰腺组织细胞内IκB的表达,抑制NF-κB活化[14]。钙蛋白酶抑制蛋白通过泛素-蛋白酶体等途径能显著抑制急性胰腺炎中NF-κB的活化,其机制或与IκB退化有关[15]。在缩胆素、牛磺胆酸钠盐等实验研究中,N-乙酰半胱氨酸、雷索司特、吡咯烷二硫基甲酸盐等是常见的NF-κB高效抑制剂,均可抑制NF-κB活化及降低炎性细胞因子释放[16]。另外环氧化酶-Ⅱ抑制剂、丙酮酸乙酯等也被证明能有效抑制NF-κB的活化[17]。Letoba等[18]研究人员通过向大鼠注入大剂量缩胆素,发现抑制肽PN50能有效降低AP的胰腺及胰外损伤。预防性注射甘氨酸可在早期阻断NF-κB的激活,减轻AP的全身炎症反应是由Ceyhan等[19]报道。
值得注意的是,尽管大多数实验研究表明NF-κB活化的抑制对AP起保护作用,但也有研究发现在抑制NF-κB的同时也可能加重胰腺的全身炎症反应,加重胰腺组织细胞的坏死程度。Rakonczay等[20]的实验研究认为胰腺炎症反应加重的现象可能与抑制剂的剂量有关,大剂量使用NF-κB抑制剂在阻断炎症反应的同时抑制了细胞凋亡这一可能的保护作用,可能加重组织损伤。此外非特异性药物抑制剂(抗炎、抗氧化物等)应用于实验,但由于其潜在的毒性而只能限制应用于动物实验。此外目前关于NF-κB抑制剂对AP保护的实验研究基本使用NF-κB抑制剂预处理,但临床上更需要在AP发生后阻断NF-κB活化,有关调控NF-κB活化的蛋白通路也有待进一步证实。
2 PPAR-γ激动剂与NF-κB
Jiang等[21]学者在20世纪末对人外周血单核细胞使用PPAR-γ激动剂,发现单核细胞的P50/P65表达下降,首次证实PPAR-γ激动剂可调节人体炎症反应,其机制可能与抑制NF-κB基因表达、抑制TNF-α、IL-1、IL-6、IL-8等细胞因子的产生有关。PPAR-γ是依赖配体激活的核受体转录因子之一,配体激活PPAR-γ后可与特殊DNA结合位点结合,调节炎症相关基因表达。PPAR-γ激动剂既可直接抑制IL-1β、IL-6、TNF-α、ICAM-1的分泌,又可通过调节NF-κB等炎症相关基因的表达,间接抑制炎症因子分泌,改善全身炎症反应和减轻多器官的损害,其抑炎作用显著而广泛。其中PPAR-γ对NF-κB的调节是通过抑制IκB的降解,促使NF-κB活性下调而实现[22]。
摄食和人体代谢产物是PPAR-γ的天然配体,其中来源于食物的多不饱和脂肪酸能在较低浓度范围内与PPAR-γ结合,如亚油酸、亚麻酸等。而代谢产物环氧化酶产物1,5脱氧-前列腺素J2在极低浓度即可与PPAR-γ结合,是使用最广泛的天然配体和强效活化剂,是较早发现的PPAR-γ的合成配体(如吡格列酮、罗格列酮、曲格列酮、环格列酮等)。临床上广泛用于2型糖尿病的治疗,毫微克水平即可激活PPAR-γ,并对其具有高选择性[23]。之后有研究发现噻唑烷二酮类药物通过激活PPAR-γ后可用于炎症反应调节,从此开启了此类药物治疗炎症性疾病的新思路,并且在缺乏有效治疗手段的AP中展开相关信号通路研究,以寻求治疗进展。
3 PPAR-γ激动剂对急性胰腺炎的保护作用
2003年Hashimoto等[1]在Pancreas杂志发表论文,发现对AP实验大鼠使用15 d-PGJ2后,胰腺组织损伤明显缓解,大鼠血液和胰腺组织中环氧合酶-2、白介素、粘附因子等表达下降,NF-κB因子活性减低,推测PPAR-γ激动剂通过抑制NF-κB基因表达发挥胰腺保护作用,首次在动物实验中证明PPAR-γ激动剂可能用于治疗AP。参阅国内外文献,PPAR-γ激动剂与AP之间关系的研究最多的是天然配体15d-PGJ2和合成配体罗格列酮。
裴红红等[24]分别用PPAR-γ激动剂罗格列酮和PPAR-γ抑制剂Gw9662处理AP大鼠,发现罗格列酮通过抑制NF-κB活化减轻AP大鼠胰腺组织损伤,Gw9662可使罗格列酮失去抑制NF-κB活化的作用,从而使NF-κB表达升高,加重胰腺损伤。Ivashchenko等[25]对敲除胰腺上皮PPAR-γ表达的特殊AP大鼠使用罗格列酮,发现其对胰腺组织保护作用减弱,表明胰腺上皮组织PPAR-γ在AP的发生、发展过程中起重要作用,提示PPAR-γ活化可能是胰腺炎新的治疗途径,但未能阐明对NF-κB的作用。不少国内外学者的实验研究证实了PPAR-γ激动剂对胰腺炎确实存在有效的抗炎作用,尤其对预防并发性AP和治疗早期AP有明显效果。但有关PPAR-γ对胰腺炎NF-κB活化通路的研究不多。
综上所述,PPAR-γ激动剂对急性胰腺炎的治疗作用已被证实有效,但其机制尚未阐明,可能通过抑制NF-κB的活性,下调炎症细胞因子含量从而缓解炎症反应。如能尽早采取措施早期干预AP,有望阻断炎症细胞因子的瀑布效应,减轻AP胰外多脏器损害的发生,为急性胰腺炎的治疗开辟新的方向。罗格列酮等噻唑烷二酮类药物已广泛投入临床用以治疗糖尿病,其抗炎作用如能应用于急性胰腺炎治疗,市场价值和社会价值不可估量。
[1]Hashimoto K,Ethridge RT,Saito H,et al.The PPAR gamma 1igand,15d-PGJ2,attenuates the severity of ceruleaninduced acute pancreatitis[J].Pancreas,2003,27(1):58-66.
[2]金燕,陈卫昌.NF-κB活化在急性胰腺炎发病机制中的作用[J].江苏医药,2013,39(7):832-835.
[3]Dunn JA,Li C,Ha T,et al.Therapeutic modification of nuclear factor kappa B binding activity and tumor necrosis factor-alpha gene expression during acute biliary pancreatitis[J].Am Surg,1997,63(12):1036-1043.
[4]Altavilla D,Famulari C,Passaniti M,et al.Lipid peroxidation inhibition reduces NF-kappa B activation and attenu ates cerulein-induced pancreatitis[J].Free Radic Res,2003,37(4):425-435.
[5]Sawah,Ueda T,Takeyama Y,et al.Role of toll-like receptor 4 in the pathophysiology of severe acute pancreatitis in mice[J].Surg Today,2007,37(10):867-873.
[6]Satoh A,Gukovskaya AS,Reeve JR,et al.Ethanol sensitizes NF-kappa B activation in pancreatic acinar cells through effects on protein kinase C-epsilon[J].Am J Physiol Gastrointest Liver Physiol,2006,291(3):432-438.
[7]Chos S,Kim JH,Roh EJ,et al.Nuclear faotor-kappa B activated by capacitative caentry enhances muscarinic receptor-mediated soluble amyloid precursor protein(sAPPalpha)release in SH-SY5Y cell[J].J Biol Chem,2006,281(18):12722-12728.
[8]Mendez-Samperio P,Perez A,Rivera L,Myclbacterium bovis Bacillus Calmette-Guerin(BCG)-induced activation of PI3K/Akt and NF-kB signaling pathways regulates ex pression of CXCL10 in epithelial cells[J].Cellular Immunology,2009,256(12):12-18.
[9]Ang AD,Adhikari S,Nq SW,et al.Expression of nitric oxide synthasc isoforms and nitric oxide production in a-cute pancreatitis and associated lung injury[J].Pancreatology,2009,9(12):150-159.
[10]Shi C,Zhao X,Wang X,et al.Role of nuclear factorkappa B,reactive oxygen species and cellular signalin in the early phase of acute pancreatitis[J].Scand J Gastroenterol,2005,40(1):103-108.
[11]Satoh A,Masamune A,Kimura K,et al.Nuclear factor kappa B expression in peropheral blood mononuclear cells of patients with acute pancreatiIis[J].Pancresa,2003,26(4):350-356.
[12]O'Reilly DA,Roberts JR,Cartmell MT,et al.Heat shock factor-1 and nuclear factor-kappa B are systemically activated in human acute pancreatitis[J].JOP,2006,7(2):174-184.
[13]Williard DE,Twait E,Samuel I,et al.NF-kB dependent gene transcription in cck and TNF alpha stimulated isolated acinar cells is regulated by p38 map kinase[J].Am J Surg,2010,200(2):283-290.
[14]Yang R,Uchiyama T,Alber SM,et al.Ethyl pyruvate ameliorates distant organ injury in a urine model of acute necrotizing pancreatitis[J].Crit Care Med,2004,32(7):1453-1459.
[15]Letoha T,Somlai C,Takacs T,et al.A nuclear import inhibitory peptide amcliorates the severity of cholecys tokinin indeced acute pancreatitis[J].World J Gastroenterol,2005,11(7):990-999.
[16]Masamune A,Shimosegawa T,Satoh A,et al.Nitric oxide decreases endothelial activation by rat experimental severe pancreatiti associated ascitic fluids[J].Pancreas,2000,20(3):297-304.
[17]Mia ZH,Mia QY,Wang LC,et al.Effect of resveratrol on peritoneal macrophages in rats with severe acute pancreatitis[J].Inflamm Res,2005,54(12):522-527.
[18]Letoba T,Kusz E,Papai G,et al.In vitro and in vivo nuclear factor-kappa B inhibitory effects of the cell-penetrating penetratin peptide[J].Mol Pharmacol,2006,69(6):2027-2036.
[19]Ceyhan GO,Timm AK,Bergmann F,et al.Prophymlamctic glycine administration attenuates pancreatic damage and inflammation in experimental acute pancreatitis[J].Pancreatology,2011,11(1):57-67.
[20]Rakonczay Z,Jdrmay K,Kaszaki J,et al.NF-kappa B activation is detrim ental in arginine-induced acute pancreatitis[J].Free Radic Biol Med,2003,34(6):696-709.
[21]Jiang C,Ting AT,Seed B.PPAR gamma agonists inhibit production of monocyte inflammatory cytokines[J].Nature,1998,391(6662):82-86.
[22]Wada K,Nakajima A,Blumberg RS.PPAR gamma and inflammatory bowel disease:A new therapeutic target for ulcerative colitis and Crohn’s disease[J].Trends Mol Med,2001,7(8):329-331.
[23]徐萍,李清华,等.吡格列酮对重症急性胰腺炎大鼠核因子-κB活化的影响及意义[J].中国综合临床,2007,23(9):774-776.
[24]裴红红,乔万海,柏玲.过氧化物酶体增殖剂激活受体-γ对实验性胰腺炎大鼠核转录因子-κB表达的影响[J].中国危重病急救医学,2008,20(5):297-298.
[25]Ivashchenko CY,Duan SZ,Usher MG,et al.PPAR-γ knockout in pancreatic epithelial cells abolishes the inhibitory effect of rosiglitazone on caerulein-induced acute pancreatitis[J].Am J Physiol Gastrointest Liver Physiol,2007,293(4):G319-G326.
Effects of PPAR-γ agonists correlate with NF-kappa B during acute pancreatitis
LU BeiYU YuanquanYIN JunjieCAI Yang
Department of HPB Surgery,First People's Hospital of Hangzhou City,Hangzhou310006,China
Acute pancreatitis,especially severe acute pancreatitis is related to excessive inflammatory cells.The NF kappa B can be involved in the regulation of many inflammatory cytokines,it is an important messenger in SIRS and MODS link the occurrence of severe acute pancreatitis(SAP).The activated receptor-γ(PPAR-γ)agonist is also a regulator of cellular inflammation,and can modulate the inflammatory reaction by inhibiting NF-kappa B to reduce the damage of pancreatic and external pancreatic organs.It is the hotspot of the research on the current pancreatitis signaling pathway.
Acute pancreatitis;Peroxisome proliferator activating receptor;Nuclear factor-kappa B
图1 右腰隐痛两周并血尿1 d(10×10)(见内文第54页)
图2 膜性肾小球肾炎(512×512)(见内文第54页)
图3 肾小管水肿显微切片(10×10)(见内文第54页)
图4 粘连束带,小肠扩张积液积气,局部可见突然中断的过渡区(见内文第96页)
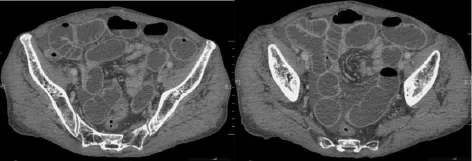
图5 肠套叠伴Meckel's憩室盆腔内所见小肠明显扩张积液,并可见“漩涡征”(见内文第96页)
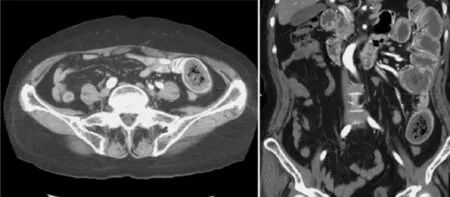
图6 粪石性肠梗阻,粪便纤维素性肠梗阻左上腹空肠肠腔内可见类圆形不均匀偏高密度灶,夹杂斑点状更高密度影及散在小气泡影,即“小肠粪球”(见内文第96页)
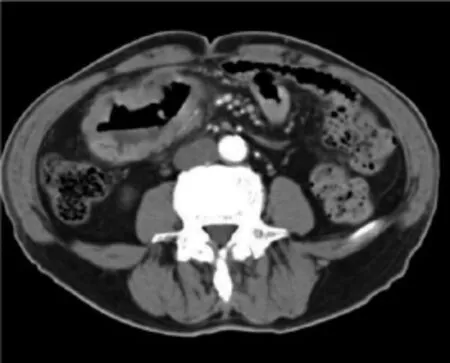
图7 回盲部癌所致小肠梗阻,右下腹回盲部可见不规则软组织肿块影,局部肠壁不均匀增厚,小肠明显扩张积液积气(见内文第96页)
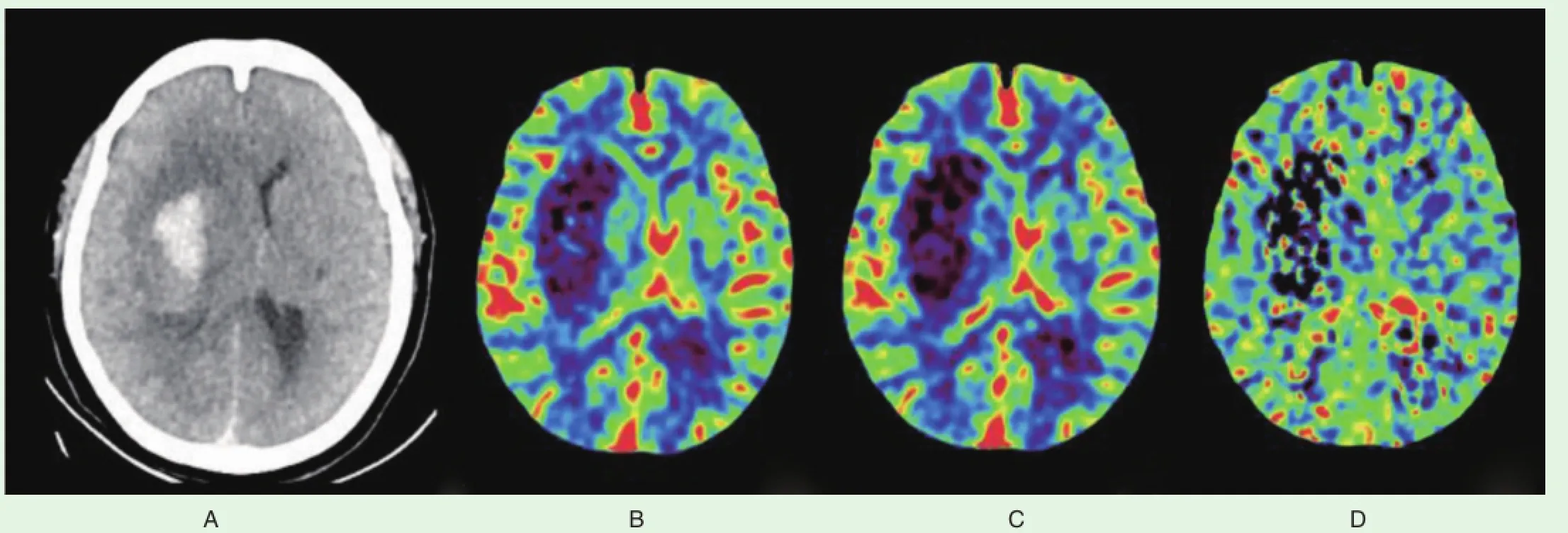
图8 亚急性右侧基底节区血肿灌注参数图(见内文第102页)A.CT平扫示右侧基底节区血肿;B、C.分别示血肿区CBF、CBV较对侧减低;D.血肿区MTT较对侧缩短
R576
A
1673-9701(2015)27-0157-04
2015-05-28)
浙江省医药卫生科技计划项目(2014KYA172)

