褪黑素对阿尔茨海默病小鼠脑内炎症反应的影响
余彩霞 杨梦华 徐婷 谭军 汪才侠
1.河南省商城县人民医院内三科,河南商城465350;2.新乡医学院第三附属医院神经内科,河南新乡453003
褪黑素对阿尔茨海默病小鼠脑内炎症反应的影响
余彩霞1杨梦华1徐婷1谭军2汪才侠1
1.河南省商城县人民医院内三科,河南商城465350;2.新乡医学院第三附属医院神经内科,河南新乡453003
目的观察褪黑素对阿尔茨海默病(Alzheimer’s Disease,AD)小鼠脑内炎症反应的影响。方法采用侧脑室注射β-淀粉样多肽(Aβ1-42)诱导AD小鼠模型,随机分为两组:生理盐水对照组和褪黑素(melatonin,MT)治疗组(MT处理组)。治疗组予50 mg/(kg·d)褪黑素腹腔注射治疗,每日1次,连续14 d;生理盐水对照组分别予等体积的生理盐水,每日1次,连续注射14 d。14 d后检测各组小鼠学习记忆能力,观察海马组织小胶质细胞和星形胶质细胞的变化,同时进行细胞因子IL-1β和炎症信号通路NF-κB-p65的检测。结果褪黑素治疗组与对照组比较,褪黑素组小鼠的学习记忆能力提高,小胶质细胞活化受到抑制,炎症细胞因子IL-1β分泌减少。结论褪黑素对Aβ1-42诱导的炎症反应表达有抑制作用,可能与其抑制NF-κB-p65有关。
阿尔茨海默病;β-淀粉样多肽;褪黑素;炎症反应;炎症信号通路
阿尔茨海默病(Alzheimer’s dementia,AD)是常见的神经系统退行性疾病,临床表现为进行性的记忆障碍,逐渐失去语言和思考能力,直至记忆能力完全丧失。病理特征表现为老年斑的沉积、神经元纤维缠结、神经元丢失和神经炎症反应[1-4],且日趋增多,给社会带来越来越沉重的负担[5]。本研究自2010年12月~2013年12月采用单侧侧脑室注射Aβ1-42造成AD的小鼠模型,同时予褪黑素(melatonin,MT)处理,从炎症细胞、炎症因子和NF-κB炎症信号通路等方面观察MT对AD小鼠脑内炎症反应的影响,探讨MT抗AD脑内炎症反应的机制,为MT的临床应用提供一定的理论和实验依据。
1 材料与方法
1.1 药物与试剂
β-淀粉样多肽(beta-amyloid,Aβ)购自美国Sigma公司,将Aβ溶于无菌生理盐水,置37℃恒温箱内孵育7 d即为聚集态的Aβ。褪黑素(melatonin,MT)购自Sigma公司。MT注射液的配置:将MT以少量无水乙醇助溶,加生理盐水致MT浓度为5 mg/mL,避光,4℃保存备用。
1.2 实验动物
健康雄性SAM-P8小鼠,5月龄,体重35~40 g,均由北京维通利华实验动物中心提供,许可证编号:SCXK(京)2002-0001。动物自由摄食饮水,环境温度18℃~22℃,湿度40%,安静,人工昼夜(12/12 h,从7:00~19:00给足光线)。所有实验参照美国国家卫生研究院关于保护和使用实验动物的指导原则以及动物保护和使用委员会的指导方针执行。
1.3 动物分组
先用侧脑室注射Aβ的方法制备AD动物模型小鼠,选用造模后的AD模型小鼠48只,随机分为两组:生理盐水对照组(24只)和MT处理组(24只)。造模后第1天腹腔注射给药,MT处理组予50 mg/(kg·d)褪黑素腹腔注射治疗,连续14 d;生理盐水对照组予等体积的生理盐水,每日1次,连续注射14 d。
1.4 Morris水迷宫实验
Morris水迷宫由中国医学科学院研制,实验开始,由将两组AD模型小鼠头朝池壁放入水中,观察并记录动物在60 s内自入水到找到平台所需要的时间为逃避潜伏期(escape latency),并记录下动物在水中的游泳轨迹。若动物在60 s内没有找到平台,人为将动物引上平台,潜伏期记为60 s,让小鼠在平台上休息10 s。空间探索实验(spatial probe test):定位航行实验后,撤去平台,助手将小鼠面向池壁从第一象限放入水中,记录小鼠60 s内穿越平台的次数。
1.5 观察指标
两组AD模型小鼠水迷宫实验结束后,应用多聚甲醛灌注、固定、取脑,制作脑组织切片。通过免疫组化检测测量两组海马组织阳性染色细胞数、小胶质细胞的面积百分比,应用ELISA法观察两组海马炎性因子IL-1水平,应用Westem blot方法检测两组细胞核内NF-κB-p65蛋白的表达。
1.6 统计学处理
实验数据中计量资料采用均数±标准差(x±s)表示,应用SPSS统计学软件进行分析,组间比较采用t检验。水迷宫实验中的逃避潜伏期用重复测量的多因素方差分析;水迷宫实验中的空间探索试验的穿越平台次数用完全随机设计的方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 褪黑素对学习记忆的影响
连续治疗14 d后,行Morris水迷宫检测,MT处理组小鼠的逃避潜伏期较对照组明显减少,差异有统计学意义[(23.1±1.4)s vs(40.1±1.4)s,t=4.327,P<0.01]。见图1 A。穿越平台次数较对照组明显增加,差异有统计学意义[(4.1±1.1)次vs(2.1±1.2)次,t=10.216,P<0.01]。见图1B。
2.2 褪黑素对星形胶质细胞和小胶质细胞的影响
48只AD模型小鼠经免疫组化后,对照组海马组织阳性染色细胞密集,胞体较大。而MT处理组阳性细胞数少,阳性细胞面积较对照组减少30.1%,差异有统计学意义[(4.5±0.1)%vs(6.3±0.1)%,t=2.705,P<0.05]。见图2 A、B、E。采用免疫细胞化学法观察褪黑素对Aβ诱导小胶质细胞的影响,结果显示,MT处理组小鼠脑内小胶质细胞的面积百分比较对照组减少23.2%,差异有统计学意义[(4.1±0.2)%vs(5.7±0.2)%, t=2.463,P<0.05]。见图2 C、D、F。
2.3 褪黑素对IL-1β的影响
应用ELISA法观察褪黑素对Aβ诱导小鼠海马炎性因子IL-1β的影响,结果表明,与对照组比较,MT处理组小鼠海马炎症细胞因子IL-1β水平明显减少,差异有统计学意义[(62.2±1.2)%vs(101.1±1.3)%,t= 8.013,P<0.01],见图3,说明褪黑素能够降低Aβ诱导小鼠海马炎性因子IL-1β的表达。
2.4 褪黑素对AD模型小鼠脑内NF-κB炎症信号通路的影响
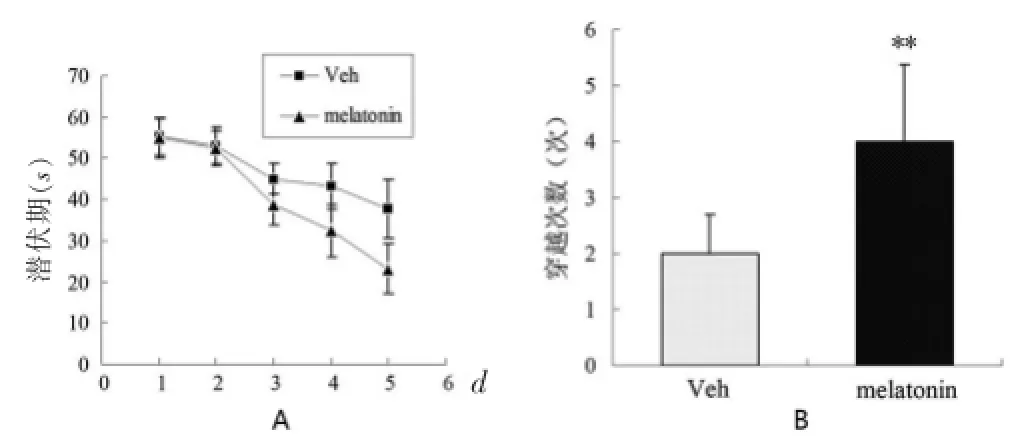
图1 MT处理组与对照组小鼠Morris水迷宫学习与记忆检测结果比较
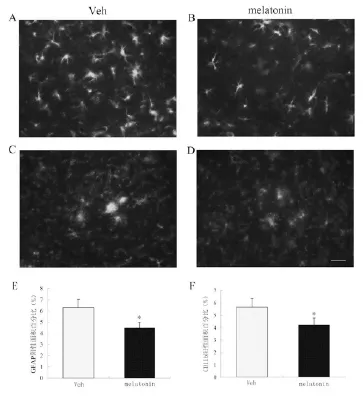
图2 MT处理组与对照组小鼠星形胶质细胞和小胶质细胞比较
NF-κB炎症信号通路与炎症细胞和炎症因子IL-1β的分泌密切相关,应用Western blot方法检测细胞核内NF-κB-p65的表达变化,结果显示,MT处理组与对照组相比,细胞核内NF-κB-p65显著减少,差异有统计学意义[(0.60±0.02)U vs(1.00±0.03)U,t=4.729,P<0.01]。见图4。
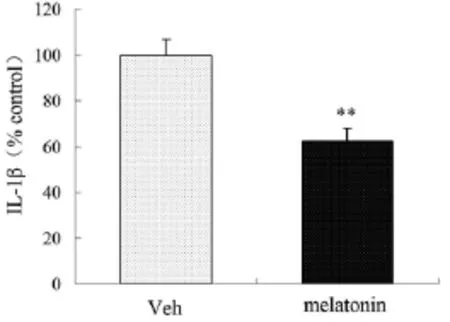
图3 MT处理组与对照组IL-1β表达的比较
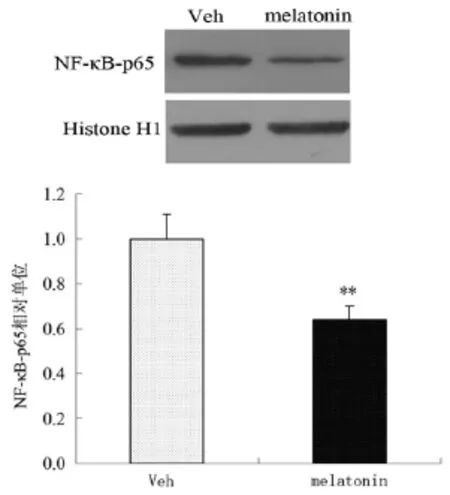
图4 MT处理组与对照组NF-κB-p65表达的比较
3 讨论
AD的病因及发病机制复杂,Aβ的蓄积是AD病理发生过程中一个病理特征之一。实验证明聚集态的Aβ有神经毒性作用。动物侧脑室Aβ注射是目前一种较好的诱导AD动物模型的方法。1991年Flood等[6]向小鼠脑室内注射Aβ,首次观察到这些Aβ片段可以引起小鼠的学习记忆能力障碍。相继有许多实验室采用中枢注射Aβ的方法观测到Aβ在脑内的沉积,并伴有小鼠和小鼠的空间学习记忆障碍[7]。提出Aβ脑内注射可被用于AD的动物模型,之后Aβ脑内注射建立AD动物模型的方法得到广泛的应用。
AD是进行性的脑功能障碍,近年来,炎症反应在AD发生中的作用受到普遍关注,AD患者的尸检报告显示,患者的SP及其附近发现有大量激活的小胶质细胞、星形胶质细胞及炎症反应产物:如炎性细胞因子IL-1β等的高表达[8]。AD患者的血液和脑脊液中也发现有TNF-α和IL-1β水平升高。流行病学研究发现,在长期服用非甾体类抗炎药(NSAIDS)的人群中,AD的发病率明显降低[9],以上研究均表明,炎症反应在AD的发病过程中起着至关重要的作用。
小胶质细胞的活化状态与AD脑内的炎症反应关系密切。小胶质细胞与神经元共培养发现,有小胶质细胞存在时,Aβ对培养的神经元毒性作用更加明显。抑制小胶质细胞活性则有明显的神经保护作用。抗炎类药物在AD治疗中得到普遍关注,抗炎药物可以延缓AD的病理进程,推迟AD的发生[10]。因此,抗炎药物的开发和利用对AD的预防和治疗非常重要。小胶质细胞膜上的受体可以与Aβ形成复合物而相互作用,其结果是引起胶质细胞活化并分泌更多的炎性因子,导致炎症损伤。
老年斑的沉积引起小胶质细胞的活化,导致小胶质细胞内炎症信号传导通路的激活,引起炎性细胞因子COX-2等基因表达,其中有NF-κB炎症信号通路参与。NF-κB是活化细胞早期转录因子。NF-κB主要是由P65和P50蛋白亚基组成的同源或异源二聚体组成。细胞在静息状态下,NF-κB与IκB结合,以非活性状态形式存在于细胞浆中。外界致炎物质刺激小胶质细胞后,在蛋白激酶作用下,IκB与NF-κB解离,IκB磷酸化,被蛋白酶小体降解,将NF-κB释放出来变为活化状态,从细胞浆转移进入细胞核,调节下游基因的表达,NF-κB炎症信号通路在小胶质细胞的激活和分泌炎性细胞因子过程中发挥重要作用[11]。
有研究显示,AD与海马结构的功能退化密切相关,海马结构是大脑边缘系统的重要组成部分,位于侧脑室下角底及内侧壁,与情绪、学习、记忆、行为及免疫调节有关[12]。边缘系统包括海马结构、海马旁回、齿状回、扣带回、乳头体及杏仁核,这些结构通过帕帕兹环相互联系,使中脑、间脑和新皮质结构之间发生信息交换,其中海马结构是AD首要损伤的区域。1987年Maurizi[13]首先提出褪黑素(molatonin,MT)的缺失可能与AD发病有关。1997年Maurizi[14]又指出MT的减少可以解释AD病理变化的区域性和神经系统特异性分布等特征。实验和临床研究都显示,患者存在MT合成和分泌下降、节律紊乱等多方面的异常,AD患者缺乏MT正常的昼夜节律[15]。Liu等[16]研究发现老年人尤其是AD患者脑脊液中MT水平明显减少。MT作为松果体分泌的一种激素,其抗炎作用是近几年的研究热点。本实验免疫组化检测示,AD模型组海马小胶质细胞和星形胶质细胞增生,阳性细胞面积百分比增加。褪黑素治疗组海马阳性细胞面积百分比减少,结果表明侧脑室注射Aβ1-42可激活脑内小胶质细胞和星形胶质细胞,引起胶质细胞增生和活化,炎症细胞因子分泌增加。IL-1β在AD患者脑内表达增高,并与AD的主要神经病理改变的发生、发展直接相关。已有众多研究提示抗炎药物可延缓AD的发展和推迟AD的发生[10]。越来越多的研究表明,AD是一个慢性炎症过程,在AD患者脑内存在严重的免疫和炎症反应[17-19],而褪黑素可以抑制炎症细胞因子的分泌,减缓海马结构的退变[20],提示褪黑素有抑制AD小鼠模型脑内小胶质细胞增生和活化,从而抑制AD脑内炎症反应。本研究还发现,褪黑素能够降低Aβ诱导的小胶质细胞NF-κB的表达并拮抗炎症细胞因子IL-1β的释放,因此,推测褪黑素拮抗Aβ诱导的小胶质细胞活化和炎性细胞因子分泌增加的分子机制可能与抑制NF-κB炎症信号通路表达有关,但是其确切的抗炎机制仍需进一步探讨。
[1]Srikanth V,Maczurek A,Phan T,et al.Advanced glycation endproducts and their receptor RAGE in Alzheimer's disease[J].Neurobiol Aging,2011,32(5):763-777.
[2]Marchesi VT.Alzheimer's dementia begins as a disease of small blood vessels,damaged by oxidative-induced inflammation and dysregulated amyloid metabolism:implications for early detection and therapy[J].FASEB J,2011,25(1):5-13.
[3]Gong CX,Lidsky T,Wegiel J,et al.Phosphorylation of microtubule-associated protein tau is regulated by protein phosphatase 2A in mammalian brain.Implications for neurofibrillary degeneration in Alzhe-imer's disease[J].J Biol Chem,2000,275(8):5535-5544.
[4]叶伟,胡祥友,周江宁,等.老年性痴呆症患者及转基因小鼠模型海马部位老年斑的特征[J].中国临床康复,2006,(46):170-171+233.
[5]Alzheimer's Disease Association.2013 Alzheimer's disease facts and figures[J].Alzheimers Demennt,2013,9(2):208-245.
[6]Flood JF,Morley JE,Roberts E.Amnestic effects in mice of four synthetic peptides homologous to amyloid beta protein from patients with Alzheimer disease[J].Proc Natl A-cad Sci USA,1991,88(8):3363-3366.
[7]Nitta A,Itoh A,Hasegawa T,et al.beta-Amyloid proteininduced Alzheimer's disease animal model[J].Neurosci Lett,1994,170(1):63-66.
[8]Passos GF,Figueiredo CP,Prediger RD,et al.Involvement of phosphoinositide 3-kinase gamma in the neuro-inflammatory response and cognitive impairments induced by beta-amyloid 1-40 peptide in mice[J].Brain Behav Immun,2010,24(3):493-501.
[9]Breitner J C.NSAIDs and Alzheimer's disease:how far to generalise from trials[J].Lancet Neurol,2003,2(9):527.
[10]Galimberti D,Scarpini E.Inflammation and oxidative damage in Alzheimer's disease:friend or foe[J].Front Biosci(Schol Ed),2011,3:252-266.
[11]Filipov NM,Seegal RF,Lawrence DA.Manganese potentiates in vitro production of proinflammatory cytokines and nitric oxide by microglia through a nuclear factor kappa B-dependent mechanism[J].Toxicol Sci,2005,84(1):139-148.
[12]Cheng XIR,Zhou WX,Zhang YX.The behavioral,patholgical and therapeutic featuers of the senescence-accelerated mouse prone 8 strain as an Alzheimer's disease animal model[J].Ageing Res Rev,2014,13(1):13-37.
[13]Maurizi CP.Dementia-the failure of hippocampal plasticity and dreams.Is there a preventative role for melatonin[J].Med Hypotheses,1987,24(1):59-68.
[14]Maurizi CP.Loss of intraventricular fluid melatonin can explain the neuropathology of Alzheimer's disease[J].Med Hypotheses,1997,49(2):153-158.
[15]Uchida K,Okamoto N,Ohara K,et al.Daily rhythm of serum melatonin in patients with dementia of the degenerate type[J].Brain Res,1996,717(1-2):154-159.
[16]Liu RY,Zhou JN,van HJ,et al.Decreased melatonin levels in postmortem cerebrospinal fluid in relation to aging,Alzheimer's disease,and apolipoprotein E-epsilon4/4 genotype[J].J Clin Endocrinol Metab,1999,84(1):323-327.
[17]Golde TE.Inflammation takes on Alzheimer disease[J].Nat Med,2002,8(9):936-938.
[18]王运良,尹红蕾,娄季宇,等.姜黄素对β淀粉样蛋白诱导的老年性痴呆大鼠小胶质细胞活化的影响[J].中华临床医师杂志(电子版),2011,(19):5578-5582.
[19]张亮,李金莲,庞有旺.小胶质细胞和炎症作用参与老年痴呆症的研究进展[J].神经解剖学杂志,2006,(5):583-585.
[20]Ramirez RG,Vega RNM,Oikawa SJ,et al.Welatonin synergizes with citalopram to induce antidepressant-like behavior and to promote hippocampal neurogenesis in adult mice[J].J Pineal Res,2014,56(4):450-461.
The effect of melatonin on inflammation reaction in mice with alzheimer’s disease
YU Caixia1YANG Menghua1XU Ting1TAN Jun2WANG Caixia1
1.The Third Department of Internal Medicine,Shangcheng County People's Hospital in He'nan Province,Shangcheng 465350,China;2.Department of Neurology,the Third Hospital Affiliated Xinxiang Medical University,Xinxiang453003, China
Objectives To investigates the effect of melatonin(MT)on inflammation reaction in mice with alzheimer’s disease(AD).Methods The mice of AD model induced by injection of beta-amyloid(Aβ1-42)were divided randomly into two groups:MT-treated group and vehicle-treated group.MT-treated group were treated with MT(50 mg/kg·day), and vehicle-treated groupwere were treated with vehicle for 14 days.The learning and memory capacity were tested, and the changes of microglia,astrocytes,and the expression of IL-1β and NF-κB-p65 were observed in two groups. Results Compared with the control group,the learning and memory ability of melatonin treatment group mice increased, the activation of microglia was inhibited,and the secretion of inflammatory cytokines IL-1 beta decreased.Conclusion MT may inhibit Aβ-induced increase in inflammation reaction through a pathway associated with NF-κB-p65 inflammatory signaling pathway.
Alzheimer’s Disease;Beta-amyloid;Melatonin;Inflammation reaction;Inflammatory signaling pathway
R749.16
A
1673-9701(2015)27-0020-04
2015-06-23)

