生长抑制因子5抑制肺癌细胞增殖作用的研究
张旭涛 孟瑾 张峰
1.第四军医大学药学院药理学教研室,陕西西安710032;2.解放军309医院药剂科,北京100091
生长抑制因子5抑制肺癌细胞增殖作用的研究
张旭涛1孟瑾2张峰1
1.第四军医大学药学院药理学教研室,陕西西安710032;2.解放军309医院药剂科,北京100091
目的探讨生长抑制因子5(ING5)抑制肺癌细胞增殖的作用。方法采用慢病毒介导的基因转染方法建立A549细胞ING5高表达细胞系A549-ING5-OE和A549细胞空质粒对照细胞系A549-control。采用细胞增殖实验和克隆形成实验观察ING5过表达对肺癌A549细胞增殖能力的影响;采用皮下接种方法建立裸鼠皮下移植瘤模型,观察ING5对裸鼠皮下成瘤能力及肿瘤体积大小的影响。结果本实验成功构建了肺癌A549-ING5过表达细胞系,与A549-control比较,细胞系A549-ING5-OE中ING5表达显著增高;增殖实验结果显示ING5高表达显著抑制了肺癌细胞的增殖能力;克隆形成实验结果显示细胞系A549-ING5-OE中ING5高表达的肺癌细胞克隆形成能力明显低于A549-control肺癌细胞(P<0.01);裸鼠在体水平研究结果显示ING5高表达可以抑制裸鼠皮下成瘤及移植瘤的生长。结论ING5可以抑制肺癌细胞的增殖,为临床治疗肺癌提供新的治疗靶点。
肺癌细胞;生长抑制因子5;增殖;克隆形成;裸鼠成瘤
肺癌的发生是个涉及多基因改变的复杂过程,其中癌基因的激活和抑癌基因的失活是两大关键要素。生长抑制因子(inhibitor of growth,ING)作为候选抑癌基因家族在肿瘤发生、发展中起重要抑制作用[1],目前已发现5个成员,包括ING1、ING2、ING3、ING4、ING5[2]。ING编码的蛋白在结构上具有相似性,功能上存在共同的作用,ING蛋白参与磷脂酰肌醇介导的脂类信号通路及激素介导的通路,抑制细胞生长,诱导细胞凋亡和DNA损伤修复[3-7],同时ING蛋白也具有各自的特点[8-13]。在多种肿瘤中ING家族基因的表达均下调[7],已有的研究表明,在肝癌的发生、发展中ING1、ING2、ING4均起到重要作用[14-15]。ING5作为家族的最新成员于2003年被首次报道。2006年Cote课题组[16]研究揭示ING5参与构成两种组蛋白乙酰基转移酶(HAT)复合体,并且能与组蛋白结合而作为连接HAT与组蛋白的桥梁分子参与组蛋白修饰和染色质重构,表明ING5可通过辅助HAT表观调控基因表达而发挥抑癌作用。ING5与临床肿瘤发生的关系研究表明,61%的原发口腔肿瘤组织中ING5 mRNA水平降低,31例中有3例检测到ING5基因发生突变;在肝癌组织中ING5 mRNA表达量下降,起到抑癌基因的作用[17];在食管鳞癌组织中ING5 mRNA的表达量同样下降[18]。进一步研究表明ING5可与P53相互作用,并促进P53转录活化,而引起结肠癌细胞周期阻滞和凋亡[19]。但ING5在肺癌中的作用尚未见报道,本实验拟建立ING5高表达肺癌细胞株,采用细胞增殖、克隆形成及裸鼠皮下荷瘤模型探讨ING5对肺癌细胞的抑制作用。
1 材料与方法
1.1 材料
A549细胞(中科院上海细胞库),GV218载体购自上海吉凯基因化学技术有限公司,蛋白定量试剂盒、SDSPAGE凝胶配制试剂盒、细胞裂解液均购自西安碧云天科技生物有限公司,蛋白酶抑制剂购自瑞士Roche,G418购自美国Gibco,细胞培养液DMEM高糖、胎牛血清、胰蛋白酶消化液均购自美国HyClone,青链霉素混合液购自北京Solarbio,ING5抗体购自美国Proteintech,ECL化学发光试剂盒购自美国Advansta,兔二抗购自英国Abcam,电子游标卡尺购自哈尔滨量具刃具有限责任公司,4%多聚甲醛购自西安科昊生物技术有限公司,裸鼠由第四军医大学(以下简称“我校”)实验动物中心提供。
1.2 GV218慢病毒载体转染构建A549-ING5-OE和A549-control细胞系
含ING5 cDNA的慢病毒载体和对照载体为吉凯公司构建。用胰蛋白酶消化液消化293T细胞,计数,调整细胞密度为6×105个/mL,接种于细胞培养皿,待细胞密度达80%时进行转染。转染前2 h将培养液换成无血清培养液,将转染复合物加入293T细胞培养液中,培养8 h后弃掉含有转染复合物的培养液,用PBS清洗细胞,加入10%胎牛血清的DMEM高糖培养液培养。48 h后收集293T细胞上清液,1000 r/min离心除去细胞碎片,收集上清即为病毒颗粒浓缩液。对数生长期A549细胞,培养液中加入病毒颗粒浓缩液进行感染,12 h后观察细胞状态,没有明显的细胞毒副作用,继续培养24 h后更换新的培养液,感染3 d后观察GFP基因的的表达。感染后A549细胞计数,调整密度为300个/孔,接种至6孔板,用G418筛选,药物浓度为5 μg/mL,每隔24 h更换新的培养液,筛选3 d后,用荧光显微镜观察细胞克隆,挑取阳性克隆扩大培养,直至获得需要的细胞量。
1.3 Western blot检测ING5在A549-control和A549-ING5-OE细胞中的表达
收集对数生长期A549-control和A549-ING5-OE细胞在冰上裂解30 min,细胞裂解液为150 mmol/L NaCl、1%NP-40、0.5%去氧胆酸、0.1%SDS、50 mmol/L Tris(pH 8.0),蛋白酶抑制剂(1∶25),裂解后高速离心20 min,收集上清即为细胞总蛋白,蛋白定量试剂盒定量。SDS-PAGE凝胶配制试剂盒配制10%的凝胶。电泳,样品在浓缩胶电压100 V,20 min,在分离胶电压120 V继续电泳。转膜,电压55 V,210 min,转膜结束后用丽春红染液染色,PBST脱色。牛奶封闭1 h,一抗ING5(1∶1000)封闭4℃过夜。PBST洗3次,每次5 min,二抗封闭1 h,PBST洗3次,每次5 min。用增强化学发光(enhanced chemiluminescence,ECL)试剂盒(Amersham Bioscience)检测蛋白的表达。
1.4 检测ING5对肺癌细胞增殖的抑制
将对数生长期A549-control和A549-ING5-OE细胞用胰蛋白酶消化液消化,计数,调整细胞密度为1×104个/孔,接种至24孔板,两种细胞各种4个复孔,每孔加1 mL 10%胎牛血清DMEM培养液。从细胞贴壁开始计时24、48、72、96 h后各计数1次。
1.5 检测ING5对肺癌细胞克隆形成能力的抑制
将对数生长期A549-control和A549-ING5-OE细胞用胰蛋白酶消化液消化,计数,调整细胞密度为300个/孔,接种至6孔板,每孔加2 mL 10%胎牛血清DMEM培养液。细胞接种5 d后每孔各加500 μL胎牛血清继续培养。贴壁生长15 d后,PBS洗3次,4%多聚甲醛固定15 min。固定后用0.1%结晶紫溶液染色15 min,PBS轻轻冲洗细胞,室温风干后计数多于50个细胞的克隆。根据公式计算克隆形成率:克隆形成率(%)=克隆数/300×100%。
1.6 ING5抑制裸鼠皮下成瘤实验
出生4周雄性裸鼠,对照组和实验组各7只随机分组,由第四军医大学(以下简称“我校”)实验动物中心代养。裸鼠适应7 d后,将对数生长期A549-control和A549-ING5-OE细胞用胰蛋白酶消化液消化,计数,调整密度为每只裸鼠5×106个/200 μL,混匀在无血清DMEM培养液,分别接种至对照组和实验组裸鼠皮下。7 d后裸鼠皮下成瘤,每隔3 d用电子游标卡尺测1次移植瘤长径(a)和短径(b),并计算肿瘤体积(V):ab2/2,绘制肿瘤生长曲线。裸鼠实验遵循我校关于动物保护和做好动物福利规定,并经我校实验动物伦理委员会批准。
1.7 统计学方法
采用SPSS 18.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,两组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 Western blot检测ING5蛋白表达
为了检测ING5是否在所转染细胞中高表达,将A549-control和ING5高表达细胞对数生长期时用细胞裂解液提取总蛋白,Western blot结果显示与A549-control相比,ING5在A549-ING5-OE细胞中表达量显著增高。见图1。

图1 ING5在A549-ING5-OE细胞中的表达情况
2.2 ING5抑制肺癌细胞增殖
显微镜下观察可见A549-control和A549-ING5-OE细胞生长良好,紧密排列,形态为梭形,细胞之间形成连接。A549-ING5-OE细胞的增殖速度明显低于A549-control细胞,增殖速度为A549-control的一半,差异有高度统计学意义(P<0.01)。见图2。
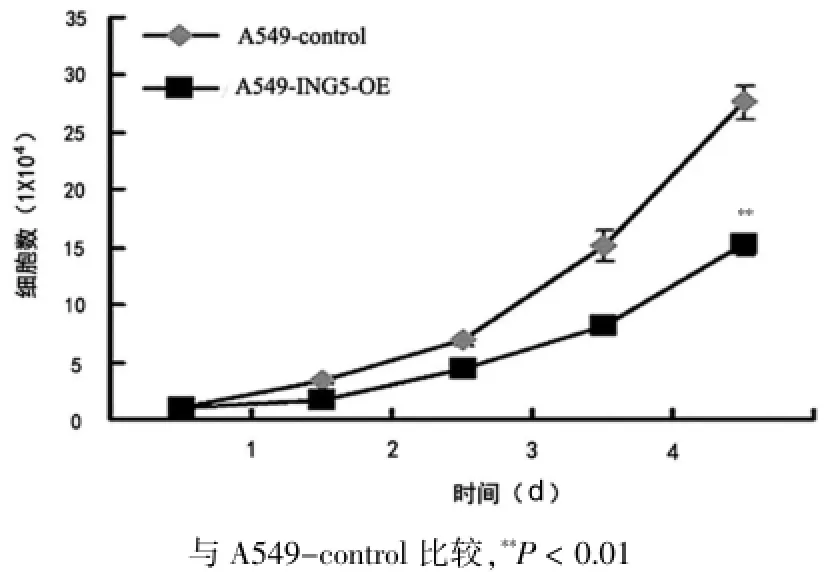
图2 A549-control与A549-ING5-OE细胞增殖曲线
2.3 ING5抑制肺癌细胞克隆形成能力
A549-control和A549-ING5-OE细胞接种在6孔板15 d后,计数细胞数多于50个的克隆,结果表明与A549-control相比ING5高表达肺癌细胞的克隆形成能力明显降低,A549-ING5-OE细胞的克隆形成率为A549-control细胞的50%,差异有高度统计学意义(P<0.01)。见图3。
2.4 ING5抑制裸鼠皮下成瘤及移植瘤的生长
裸鼠皮下接种A549-control和A549-ING5-OE细胞,7 d后成瘤,随着时间的增加,接种A549-control裸鼠肿瘤生长较快,接种A549-ING5-OE的裸鼠肿瘤生长明显较慢,结果表明ING5高表达后显著抑制裸鼠皮下成瘤及移植瘤的生长。见图4。
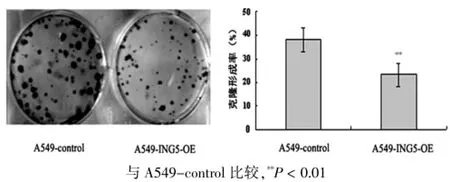
图3 A549-control与A549-ING5-OE克隆形成
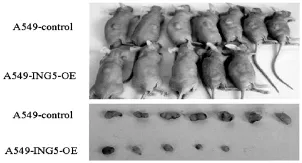
图4 生长抑制因子5抑制裸鼠皮下种植瘤的生长
2.5 接种A549-ING5-OE及A549-control细胞后大鼠体积变化情况
接种A549-ING5-OE细胞成瘤,肿瘤体积大小基本无增加。A549-control细胞接种成瘤,肿瘤体积明显增大。从肿瘤生长曲线可以看出ING5高表达的肺癌细胞肿瘤生长明显被抑制,肿瘤体积较对裸鼠A549-control细胞接种显著减小。见图5。
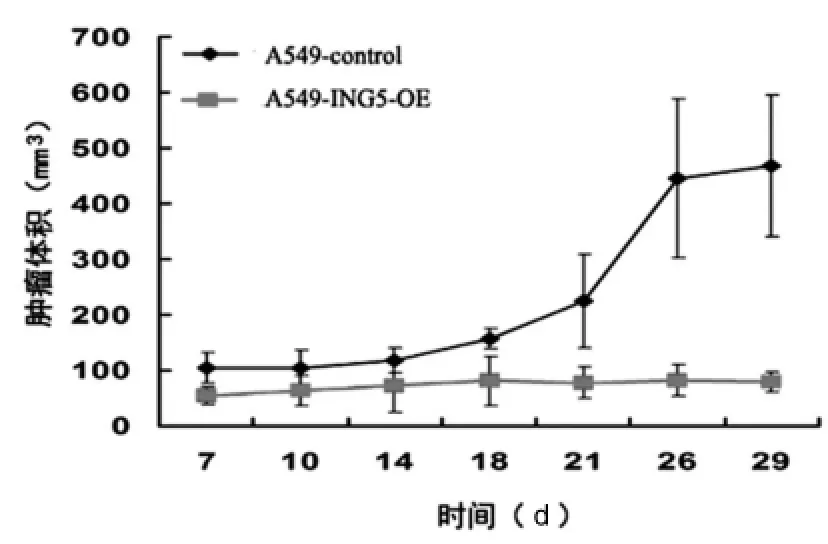
图5 肿瘤生长曲线
3 讨论
作为候选抑癌基因家族成员,近年来ING家族在肿瘤发生、发展过程中的作用和机制受到越来越多的关注。路美玲等[17]研究结果表明,与正常肝组织相比,肝癌细胞株ING5 mRNA表达明显降低,在肿瘤转化过程中与正常组织相比ING5表达明显被抑制。赵春阳等[18]研究结果表明,在肿瘤细胞中ING5表达水平越低,肿瘤的恶性程度就越高。
研究表明,肺癌的发生、发展以及侵袭、转移是多基因参与、多步骤发生的过程[19-20]。随着近年来外科技术发展的日趋完善,新的化学治疗药物和局部治疗方法不断出现,但对肺癌的总体治疗效果却不甚理想,因此从分子水平研究肺癌发生、发展中的分子机制,针对肺癌中异常分子的治疗药物和治疗方法就成了新的研究热点,并促进了肺癌分子靶向治疗的出现。本研究中,通过慢病毒介导的基因转染方法使ING5在A549细胞中高表达,发现ING5高表达后与对照肺癌细胞相比,其增殖能力和克隆形成能力均降低,说明在细胞水平ING5抑制了肺癌细胞的增殖和克隆形成能力。通过裸鼠在体水平的研究同样发现,ING5抑制了裸鼠皮下成瘤及移植瘤的生长,动物实验研究结果同样说明ING5抑制了肺癌细胞的增殖,与上述细胞实验结果相符。
综上所述,ING5在肺癌细胞高表达后抑制了肺癌细胞的增殖,提示ING5在肺癌的发生和发展中起到了抑癌基因的作用,为肺癌的基因治疗提供了新的靶点。
[1]Unoki M,Kaumamoto K,Takenoshita S,et al.Reviewing the current classification of inhibitor of growth family proteins[J].Cancer Sci,2009,100(7):1173-1179.
[2]Shah S,Smith H,Feng X,et al.ING function in diverse model systems[J].Biochem Cell Biol,2009,87(1):117-125.
[3]Zhang F,Rode M,Ji P,et al.The inhibitor of growth protein 5(ING5)depends on INCA1 as a co-factor for its antiproliferative effects[J].PLos One,2011,6(7):207-215.
[4]Campos EI,Chin MY,Kuo WH,et al.Biological function of the ING family tumor suppressors[J].Cell Mol Life Sci,2004,61(19-20):2597-2613.
[5]Garkavtsev I,Grigorian IA,Ossovskaya VS,et al.The candidate tumor suppressor p33ING1 cooperate with p53 in cell growth control[J].Nature,1998,391(6664):295-298.
[6]He GH,Helbing CC,Wagner MJ,et al.Phylogenetic analysis of the ING family of PHD finger proteins[J].Mol Biol Evol,2005,22(1):104-116.
[7]Coles AH,Jones SN.Inhibitor of growth-4 promotes I-kappa B promoter activation to suppress NF-kappa B signaling and innate immunity[J].Proc Natl Acad Sci USA,2010,107(25):11423-11428.
[8]Tallen G,Riabowol K.Keep-ING balance:tumor suppression by epigenetic regulation[J].FEBS Lett,2014,588(16):2728-2742.
[9]Soliman MA,Riabowol K.After a decade of study-ING,a PHD for a versatile family of proteins[J].Trends Biochem Sci,2007,32(11):509-519.
[10]Gong W,Suzuki K,Russell M,et al.Function of the ING family of PHD proteins in cancer[J].Biochem Cell Biol,2005,37(5):1054-1065.
[11]Shiseki M,Nagashima M,Pedeux RM,et al.P29ING4 and p28ING5 bind to p53 and p300,and enhance p53 activity[J].Cancer Res,2003,63(10):2373-2378.
[12]Ohgi T,Masaki T,Nakai S,et al.Expression of p33(ING1)in hepatocellular carinoma:relationships to tumor differentiation and cyclin E kinase activity[J].Scand J Gastroenterol,2002,37(12):1440-1448.
[13]Zhu Z,Luo Z,Li Y,et al.Human inhibitor of grow 1 inhibits hepatoma cell growth and influences p53 stability in a variant-dependent manner[J].Hepatology,2009,49(2):504-512.
[14]Zhang HK,Pan K,Wang H,et al.Decreased expression of ING2 gene and its clinicopathological significance in hepatocellular carcinoma[J].Cancer Lett,2008,261(2):183-192.
[15]Fang F,Luo LB,Tao YM,et al.Decreased expression of inhibitor of growth 4 correlated with poor prognosis of hepatocellular carcinoma[J].Cancer Epidemiol Biomarkers Prev,2009,18(2):409-416.
[16]Doyon Y,Cayrou C,Ullah M,et al.ING tumor suppressor proteins are critical regulators of chromatin acetylation required for genome expression and perpetuation[J].Mol Cell,2006,21(1):51-64.
[17]路美玲,陈斐,王勤婉.ING5在肝癌中表达的研究[J].胃肠病学,2010,15(2):86-89.
[18]赵春阳,徐广全.ING5在食管鳞癌中的表达及意义[J].高师理科学刊,2013,33(3):71-72.
[19]Shiseki M,Nagashima M,Pedeux RM,et al.P29ING4 and p28ING5 bind to p53 an p300,and enhance p53 activity[J].Cancer Res,2003,63(10):2373-2378.
[20]常莎,王瑞平.基于CT三维图像的肺结节良恶性鉴别研究[J].北京生物医学工程,2013,32(1):12-16.
Study of the antiproliferative effects of inhibitor of growth 5 on lung cancer cells
ZHANG Xutao1MENG Jin2ZHANG Feng1
1.Department of Pharmacology,School of Pharmacy,the Fourth Military Medical University,Shaanxi Province,Xi'an 710032,China;2.Department of Pharmacy,the 309th Hospital of PLA,Beijing100091,China
ObjectiveTo study the antiproliferative effects of inhibitior of growth 5(ING5)on lung cancer A549 cells.MethodsING5 gene transfer was mediated by lentiviruses to establish ING5 over expression cell line A549-ING5-OE and the corresponding control cell line A549-control.Proliferation assay and colony formation assay were used to observe the effects of ING5 over-expression on the proliferation capacity of lung cancer cells.Mouse xenograft models were established with A549 ING5 over-expression cells and A549-control cells by subcutaneous injection.ResultsThe ING5 over-expression cell line A549-ING5-OE and A549-control cell line were established.ING5 over-expression inhibited proliferation and colony formation ability of A549 cells(P<0.01).In vivo results showed ING5 over expression could suppress the ability of the tumorigenesis and tumor growth.ConclusionING5 over-expression can inhibit proliferation of lung cancer A549 cells,and provide a new therapeutic target for the clinical treatment of lung cancer.
Lung cancer cells;Inhibitor of growth 5;Proliferation;Colony formation;Nude mice xenografts
R734
A
1673-7210(2015)02(a)-0004-04
2014-11-14本文编辑:任念)
国家自然科学基金面上项目(编号31071189)。
张旭涛(1989.5-),男,陕西渭南人,第四军医大学药学院2012级药理学专业在读硕士研究生;研究方向:分子药理学。
张峰(1970.12-),女,博士,副教授;研究方向:分子药理学。

