食管鳞状细胞癌组织中ADAMTS18基因的表达及临床意义
郭丽丽 郭胜利 郭炜 董稚明 郭艳丽
[摘要] 目的 通过对食管鳞状细胞癌(ESCC)组织中含凝血酶敏感素基序的去整合素金属蛋白酶18(ADAMTS18)mRNA及蛋白表达情况的检测,探讨ADAMTS18在ESCC发生、发展中所起的作用及临床意义,为ESCC的临床早期诊断及预后评估提供新的客观参考指标。 方法 采用半定量-逆转录聚合酶链反应(RT-PCR)的方法及免疫组化S-P的方法(生物素-链霉卵白素过氧化酶系统)对72例ESCC组织及癌旁正常组织中ADAMTS18 mRNA及蛋白的表达进行检测。 结果 ①ADAMTS18 mRNA在ESCC组织中的相对表达量为(0.361±0.115),在癌旁正常组织中表达量为(0.879±0.265),ESCC组织中ADAMTS18 mRNA表达量显著低于癌旁正常组织(P < 0.01);ADAMTS18 mRNA在高/中分化鳞癌组中的相对表达量为(0.496±0.153),在低分化鳞癌组中为(0.232±0.088),低分化鳞癌组ADAMTS18 mRNA表达量显著低于高/中分化鳞癌组(P < 0.05)。②ADAMTS18蛋白在ESCC组织中的阳性表达率为34.7%(25/72),在癌旁组织中的阳性表达率为93.1%(67/72),ADAMTS18蛋白在ESCC组织中阳性表达率显著低于癌旁组织(P < 0.01);ADAMTS18蛋白在高/中分化鳞癌组中的阳性表达率为45.4%(20/44),在低分化鳞癌组中为17.8% (5/28),低分化鳞癌组ADAMTS18蛋白阳性表达率显著低于高/中分化鳞癌组(P < 0.05)。 结论 ADAMTS18基因在ESCC中的异常表达与ESCC的发生、发展及组织分化程度关系密切,检测ESCC组织中ADAMTS18基因的表达情况,有助于ESCC早期诊断及预后评估。
[关键词] 食管鳞状细胞癌;ADAMTS18;表达
[中图分类号] R735.102 [文献标识码] A [文章编号] 1673-7210(2015)02(a)-0076-04
食管癌(esophageal carcinoma,EC)属于上消化道常见的恶性肿瘤,全球每年新发食管癌人数约40万例,死亡约30万例,其中我国食管癌发病率和病死率在全球位居首位[1]。目前迫切需要对食管癌发病原因及机制进行深入研究,从而寻求敏感、特异的早期诊断指标和治疗方法。含凝血酶敏感素基序的去整合素金属蛋白酶(a disintegrin and metalloprotease with thrombospondin motifs,ADAMTS)家族的蛋白水解功能可能与肿瘤发生、发展、侵袭有关。该家族不同成员在不同来源肿瘤的发生中所起的作用也不尽相同。国内外对ADAMTS18基因的表达与食管癌的关系罕见报道。本实验通过对食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)组织及癌旁正常组织中ADAMTS18 mRNA及蛋白的表达进行检测,探讨ADAMTS18与ESCC发生、发展的相关性及其生物学意义。
1 材料与方法
1.1 材料
1.1.1 标本来源 组织标本均来自河北医科大学第四医院2008~2011年的ESCC手术患者,共72例,其中,男53例,女19例,年龄43~76岁,平均(61.2±2.5)岁。本研究经医院伦理委员会通过,入选患者均签署了知情同意书。按照1997年国际抗癌联盟(UICC)标准进行TNM分期(Ⅰ期2例,Ⅱ期38例,Ⅲ期29例,Ⅳ期3例);根据有无淋巴结转移分为有淋巴结转移组(45例)和无淋巴结转移组(27例);按肿瘤组织分化程度分为高分化组(17例)、中分化组(27例)、低分化组(28例)。所有患者术前均未经化疗和放疗,术中取癌旁正常黏膜组织以及ESCC原发灶组织。所有入选患者均通过胃镜检查诊断为食管癌,且术后病理检查确诊为ESCC,保存完整临床病理资料及手术记录。术中切取标本时,遵循先取癌旁组织、后取肿瘤组织的原则,切除标本一部分用于提取RNA,一部分用于制作蜡块(HE染色及免疫组化染色)。
1.1.2 主要试剂 TRIzol(美国SBS公司)、总RNA提取试剂(美国Promega公司)、逆转录PCR试剂盒(美国Foments 公司)、绿色体系(美国Promega 公司)、DNA Marker(北京Solarbio科学技术有限公司)、氯仿、异丙醇(上海化学试剂总厂)、琼脂糖(西班牙进口分装)、DEPC(美国Invitrogen公司)、EB(北京鼎国昌盛生物技术有限责任公司)、兔抗人ADAMTS18多克隆抗体(生工生物工程有限公司)、免疫组化试剂盒(北京中杉金桥生物技术开发公司)、EDTA修复液(Gene Tech公司)、DAB显色液(北京中杉金桥生物技术开发公司)。
1.2 方法
1.2.1 RT-PCR法检测ADAMTS18 mRNA在ESCC组织中的表达 按照TRIzol试剂说明书低温提取ESCC组织及癌旁组织中RNA,并参照逆转录试剂盒说明书将RNA逆转录成cDNA。ADAMTS18上游引物为5'- TGCACAACGGCAGGAAAAAG-3',下游引物为5'-TCAAAATCGCCGAGGGCTTA-3';GAPDH作为内参,上游引物为5'-GGGAAACTGTGGCGTGAT-3',下游引物为5'-GTGGTCGTTGAGGGCAAT-3'。RT-PCR反应条件:94℃预变性10 min,94℃变性45 s,退火45 s,72℃延伸45 s,35个循环扩增后,72℃ 7 min。PCR产物进行2%琼脂糖凝胶电泳,ADAMTS18的PCR产物片段大小为114 bp,GAPDH为342 bp。采用Gel Pro Analysizer 3.1软件测定ADAMTS18基因灰度值,每个细胞及组织标本均重复做3次取平均值,以内参照GAPDH的OD值标化ADAMTS18基因的OD值,从而得到相对表达强度。
1.2.2 免疫组织化学S-P法(生物素-链霉卵白素过氧化酶系统)检测ADAMTS18蛋白在ESCC组织中的表达 石蜡标本常规4 μm连续切片,进行免疫组织化学染色的切片经脱蜡、水化后,采用3%甲醇过氧化氢灭活内源性过氧化物酶,EDTA缓冲液高压锅抗原热修复。一抗为兔抗人ADAMTS18多克隆抗体,加SP试剂后DAB显色,苏木精复染细胞核,常规脱水、透明、中性树胶封片。PBS代替一抗作为阴性对照,用已知平滑肌纤维组织阳性切片作为阳性对照。根据半定量标准:物镜下阳性细胞≤10%判为1分;>10%~50%判为2分;>50%~75%判为3分;>75%判为4分。染色强度分数判断标准:无色判为0分;淡黄色判为1分;棕黄色判为2分;棕褐色判为3分。将上述两项得分相加:0分表示为“-”,1~2分表示为“+”,3~4分表示为“++”,5~6分表示为“+++”。以“++”或“+++”时定义为阳性表达,以“-”或“+”时定义为阴性表达。免疫组化染色结果经两名有经验的病理学医师采用双盲法诊断,一张切片需观察至少5个高倍视野。
1.3 统计学方法
采用SPSS 13.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,两组间比较采用t检验;计数资料用率表示,组间比较采用χ2检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 ESCC组织中ADAMTS18 mRNA的表达
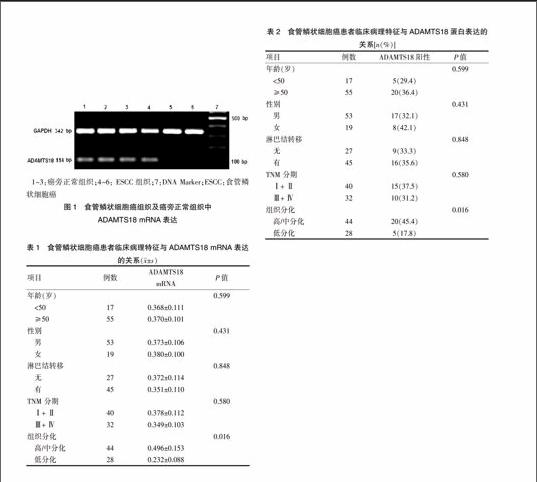
ADAMTS18 mRNA在ESCC组织中的相对表达量为(0.361±0.115),在癌旁正常组织中为(0.879±0.265),ESCC组织中ADAMTS18 mRNA的表达量显著低于相应癌旁正常组织,经统计学分析两者差异有高度统计学意义(P < 0.01),见图1。分组分析发现,低分化鳞癌组ADAMTS18 mRNA表达量显著低于高/中分化鳞癌组,经统计学分析两组差异有统计学意义(P < 0.05);ADAMTS18 mRNA的表达与ESCC患者的年龄、性别、有无淋巴结转移及TNM分期均无关(P > 0.05)。见表1。
1~3:癌旁正常组织;4~6: ESCC组织;7:DNA Marker;ESCC:食管鳞状细胞癌
图1 食管鳞状细胞癌组织及癌旁正常组织中
ADAMTS18 mRNA表达
表1 食管鳞状细胞癌患者临床病理特征与ADAMTS18 mRNA表达的关系(x±s)
2.2 ESCC组织中ADAMTS18蛋白的表达
ADAMTS18蛋白的阳性产物主要位于细胞质,染色均匀呈棕黄色(图2,见封四)。72例癌旁组织中ADA MTS18蛋白阳性表达67例,阳性表达率为93.1%(67/72),72例ESCC组织中ADAMTS18蛋白阳性表达25例,阳性表达率为34.7%(25/72),ADAMTS18蛋白在ESCC组织中的表达阳性率显著低于癌旁组织,经统计学分析两者差异有高度统计学意义(P < 0.01)。分组分析发现,低分化鳞癌组ADAMTS18蛋白表达阳性率显著低于高/中分化鳞癌组,差异有统计学意义(P < 0.05);ADAMTS18蛋白表达与ESCC患者的年龄、性别、有无淋巴结转移、TNM分期均无关(P > 0.05)。见表2。
表2 食管鳞状细胞癌患者临床病理特征与ADAMTS18蛋白表达的关系[n(%)]
3 讨论
食管癌是常见的上消化道恶性肿瘤,全球统计其发病率位居恶性肿瘤发病率的第8位,病死率在恶性肿瘤病死率排名中位居第4位[1]。在世界范围内中国是食管癌发病率及病死率最高的国家。中国人群食管癌以ESCC为高发类型,占90%以上,以40岁以上男性较多见。自20世纪中叶至今,我国在ESCC手术切除率和患者5年生存率等诸多方面取得了瞩目的成就,但ESCC患者中50%已经发生了局部浸润或者淋巴结转移,术后2年约半数患者仍然死于转移或复发,其预后差,远期生存率极低,晚期ESCC的5年生存率约为15%[2],早期ESCC的5年生存率高于90%[3]。因此,ESCC患者重在疾病的早期诊断,对参与ESCC发生发展、侵袭转移过程中较特异的肿瘤标志物进行研究,能够为ESCC的早期诊断提供坚实的理论基础,有效降低ESCC的病死率。
肿瘤相关基因发生突变或表达异常,致使机体发生恶性肿瘤,且能够从原发肿瘤部位脱离并穿透基底膜,进一步侵袭结缔组织,使恶性肿瘤转移至邻近组织或者远处器官,这一系列复杂过程需要借助细胞-细胞/细胞-细胞间质间的相互作用才能完成。肿瘤细胞的侵袭转移能力取决于其诱导产生的蛋白酶降解细胞外基质(ECM)和基底膜能力的大小,ECM和基底膜表面存在多种受体,与肿瘤细胞结合后,肿瘤细胞通过诱导宿主基质细胞大量分泌金属蛋白酶类,并协同为肿瘤细胞浸润、转移创造有利的肿瘤微环境。其中,ADAMTS家族在肿瘤发生、浸润、转移过程中起着至关重要的作用。ADAMTS也称Ⅰ型血小板结合蛋白基序的去整合素金属蛋白酶,属于Zn2+依赖-分泌型金属蛋白酶超家族,包含19个基因家族成员,由平滑肌细胞、成纤维细胞以及巨噬细胞等多种细胞分泌,属于可溶性分泌蛋白酶,其中金属蛋白酶域以及Ⅰ型凝血酶敏感蛋白(thrombospondin type Ⅰ,TSP1)基序为其标志性结构,TSP1基序能够介导ADAMTS结合ECM蛋白并与之发生作用[4]。据报道,ADAMTS家族成员在正常的胚胎生长发育、性腺发育、卵巢正常生理过程、炎症发生以及结缔组织病、血栓性血小板减少性紫癜、血栓形成、恶性肿瘤等人体正常或异常的生理活动中都扮演着重要的角色[5-10]。
ADAMTS18属于全基因组关联基因,位于人类染色体16q23,含有13个外显子,可以编码一个含有1222个氨基酸的蛋白质[11]。关于ADAMTS18与ESCC的关系国内外尚未见报道。本实验采用RT-PCR及免疫组化技术检测了72例ESCC黏膜组织及其相应癌旁正常黏膜组织中的ADAMTS18 mRNA及蛋白的表达,发现ESCC组织中ADAMTS18 mRNA的表达量及ADAMTS18蛋白的阳性表达率均显著低于癌旁正常黏膜组织。推测ADAMTS18在ESCC组织中属于抑癌基因,它的异常表达导致ESCC的发生,目前国外文献[11-12]也有结果一致的报道,但对于ADAMTS18是如何发挥抑制肿瘤细胞生长作用的机制还不甚明确。ADAMTS18可能直接作用于其他抑制因子,从而起到间接抑制肿瘤细胞生长的作用;也可能通过裂解血小板聚合物实现,血小板裂解产物能够促进血管内皮细胞的生血管反应,逐渐使癌变组织细胞修复至正常组织细胞状态。本实验根据患者的临床病理特征进行分组分析,ADAMTS18 mRNA及蛋白的表达可能与组织分化程度关系紧密,高/中分化ESCC组ADAMTS18 mRNA相对表达量以及ADAMTS18蛋白阳性表达率均明显高于低分化ESCC组,随着ESCC组织分化程度逐渐下降,ADAMTS18基因的表达也随之下调。有文献证实,人类黑素瘤中存在着ADAMTS18基因的大规模突变及异常表达,体外实验中ADAMTS18的基因突变能够降低层粘连蛋白的黏附作用,从而促进黑素瘤细胞的转移[13]。本研究证实,ADAMTS18基因的低水平表达可能会促进ESCC的发生发展,其高水平表达可能会抑制ESCC的发生发展,属于抑癌基因。
肿瘤细胞的侵袭和转移已成为国内外学者研究的热点之一。ADAMTS家族成员广泛参与机体多种重要的生理性以及病理性活动过程,例如细胞凋亡、血管新生、肿瘤发生发展等,因此对ADAMTS结构、功能以及其与人类多种疾病关系的深入研究,能够为疾病的早期诊断、后续治疗、预后评估提供坚实的理论依据和广阔的前景。关于ADAMTS18在ESCC组织中的异常表达对肿瘤发生发展影响的确切机制还有待进一步研究探讨。
[参考文献]
[1] Parkin DM,Bray F,Ferlay J,et al. Global cancer statistics,2002 [J]. CA Cancer J Clin,2005,55(2):74-108.
[2] Jemal A,Murray T,Ward E,et al. Cancer statistics,2005 [J]. CA Cancer J Clin,2005,55(1):10-30.
[3] Headrick JR,Nichols FC,Miller DL,et al. High-grade esophageal dysplasia:long-term survival and quality of life after esophagectomy [J]. Ann Thorac Surg,2002,73(6):1697-1703.
[4] Porter S,Clark IM,Kevorkian L,et al. The ADAMTS metalloproteinases [J]. Biochem J,2005,386(Pt 1):15-27.
[5] Robker RL,Russell DL,Espey LL,et al. Progesterone-regulated genes in the ovulation process:ADAMTS-1 and cathepsin L proteases [J]. Proc Natl Acad Sci USA,2000,97(9):4689-4694.
[6] Mittaz L,Russell DL,Wilson T,et al. Adamts-1 is essential for the development and function of the urogenital system [J]. Biol Reprod,2004,70(4):1096-1105.
[7] Blelloch R,Kimble J. Control of organ shape by a secreted metalloprotease in the nematode Caenorhabditis elegans [J]. Nature,1999,399(6736):586-590.
[8] Nagase H,Kashiwagi M. Aggrecanases and cartilage matrix degradation [J]. Arthritis Res Ther,2003,5(2):94-103.
[9] Tsai HM. Deficiency of ADAMTSl3 in thrombotic thrombocytopenic purpura [J]. Int J Hematol,2002,76(Suppl 2):132-138.
[10] Porter S,Scott SD,Sassoon EM,et al. Dysregulated expression of adamalysin-thrombospondin genes in human breast carcinoma [J]. Clin Cancer Res,2004,10(7):2429-2440.
[11] Jin H,Wang X,Ying J,et al. Epigenetic identification of ADAMTS18 as a novel 16q23.1 tumor suppressor frequently silenced in esophageal,nasopharyngeal and multiple other carcinomas [J]. Oncogene,2007,26(53):7490-7498.
[12] Li Z,Zhang W,Shao Y,et al. High-resolution melting analysis of ADAMTS18 methylation levels in gastric,colorectal and pancreatic cancers [J]. Med Oncol,2010,27(3):998-10004.
[13] Wei X,Prickett TD,Viloria CG,et al. Mutational and functional analysis reveals ADAMTS18 metalloproteinase as a novel driver in melanoma [J]. Mol Cancer Res,2010,8(11):1513-1525.
(收稿日期:2014-10-15 本文编辑:程 铭)

