杀螺胺乙醇胺盐原药的反相高效液相色谱测定
曹 佳,宋思思,李晓刚,刘一平,杨雪清
(1.湖南农业大学植物保护学院,湖南 长沙410128;2.湖南省生物农药与制剂加工工程技术研究中心,湖南 长沙410128;3.湖南省农药检定所,湖南 长沙410005;4.湖南京西祥隆化工有限公司,湖南 株洲412005)
杀螺胺乙醇胺盐原药的反相高效液相色谱测定
曹 佳1,2,宋思思1,2,李晓刚1,2,刘一平3,杨雪清4
(1.湖南农业大学植物保护学院,湖南 长沙410128;2.湖南省生物农药与制剂加工工程技术研究中心,湖南 长沙410128;3.湖南省农药检定所,湖南 长沙410005;4.湖南京西祥隆化工有限公司,湖南 株洲412005)
利用反相高效液相色谱法研究了两种色谱柱,3种流动相对杀螺胺乙醇胺盐分离效果的影响,并对测定方法进行比较。结果表明,以S purs i lTMC18为色谱柱,流动相为甲醇︰水︰三乙胺=90︰10︰0.1(V/V)时,测定值的标准偏差为0.185,变异系数为0.240%,平均回收率为97.12%,线性相关系数为0.999 9。这说明在该条件下杀螺胺乙醇胺盐的分离效果较好,同时该方法简单快捷,可作为分析杀螺胺乙醇胺盐原药的分析方法。
杀螺胺乙醇胺盐;氯硝柳胺;高效液相色谱法;三乙胺
杀螺胺乙醇胺盐又名氯硝柳胺乙醇胺盐,属酰胺类杀软体动物剂,具有胃毒作用,对螺卵、血吸虫尾蚴等有较强的杀灭作用,是WHO推荐使用的灭螺药[1-2]。近年来,国内外对杀螺胺乙醇胺盐的加工应用[3]、杀螺活性[4]、残留[5-6]及环境毒理[7]进行了大量研究报道。目前,国内外已报道的杀螺胺乙醇胺盐分析方法有电位滴定法[8]、分光光度计法[9]和高效液相色谱法[10-12]。但是,电位滴定法和分光光度计法的分析时间较长、杂质分离效果不佳。高效液相色谱法是用于检测杀螺胺乙醇胺盐的常用方法,在实际检测中,相同的色谱条件下,不同厂家生产的色谱柱对杀螺胺乙醇胺盐的分离效果有差异,有的甚至达不到分离要求,而在研究制定高效液相色谱方法时,选择适宜的流动相也很重要。因此,试验拟采用反相高效液相色谱法,筛选不同的色谱柱及流动相,以期建立较为完善的杀螺胺乙醇胺盐原药测定方法。
1 材料与方法
1.1 试验材料
供试仪器设备主要有岛津LC-20AT高效液相色谱仪,配备LC-20AT泵、20μL定量环以及紫外检测器和LC-solution色谱工作站;色谱柱:SpursilTMC18(250mm×4.6mm,5μm,北京迪科马科技有限公司)、C18-WP(250mm×4.6 mm,5μm,德国CNW科技公司);超声波清洗器;滤膜孔径0.45μm的过滤器。试验主要试剂有甲醇(色谱纯)、超纯水、三乙胺(分析纯),杀螺胺标样(已知质量分数≥99%,某公司),杀螺胺原药(湖南京西祥隆化工有限公司)。
1.2 试验方法
1.2.1 标准溶液及试样的配制 (1)标准溶液配制。准确称取杀螺胺标准品0.020 0 g于50ML容量瓶中,加入适量甲醇试剂溶解,置于超声浴槽中约10 Min,取出降至室温后,用甲醇补至刻度线摇匀,再用0.45μm滤膜过滤后备用。(2)试样配制。准确称取杀螺胺乙醇胺盐0.020 0 g,操作同(1)。
1.2.2 流动相的影响 以SpursilTMC18为色谱柱,分离条件为柱温25℃,检测波长230 nm,进样量10 μL,当流动相分别为甲醇︰水=90︰10(V︰V,下同)、甲醇︰水︰三乙胺=90︰10︰0.1、甲醇︰水︰三乙胺=54︰46︰0.115时,对流动相的影响进行分析。1.2.3 色谱柱的影响 在流动相为甲醇︰水︰三乙胺=90︰10︰0.1、柱温为25℃、检测波长230 nm、流速1.0ML/Min、进样量10μL时,分别采用以SpursilTMC18和Athena C18-WP两种色谱柱,对色谱柱影响进行分析。
1.2.4 测定 在1.2.2和1.2.3下,待仪器基线稳定后连续注入数针标准溶液,直至相邻两针的峰面积变化小于1.5%,按标准溶液、试样溶液、试样溶液、标准溶液的顺序进行测定。
1.2.5 对色谱条件的检测 (1)线性关系检测。称取一定量的杀螺胺标准品,用甲醇配制一定质量浓度的杀螺胺标准溶液,再用梯度稀释法配制成质量浓度分别为0.10、0.20、0.50、1.00、2.00、5.00、10.00mg/L的标准工作液,按条件进行反相高效液相色谱测定。以杀螺胺标准工作液的质量浓度(x,mg/L)对其所对应的色谱峰面积(y)做标准曲线,得到相应的线性关系曲线。(2)精密度检测。对同一样品分别进行5次重复测定,考查样品回收率的标准偏差及变异系数。(3)准确度检测。称取5份已知准确含量的杀螺胺乙醇胺盐试样,分别加入一定量的杀螺胺标准品,按条件进行重复测定,考查平均回收率。
1.2.6 计算 将测得的两针试样溶液和试样溶液前后两针标准溶液中的杀螺胺的峰面积分别进行平均。以质量百分数表示的杀螺胺乙醇胺盐的含量X按公式(1)计算:

式中:A1表示标准溶液中杀螺胺峰面积的平均值;A2表示试样溶液中杀螺胺乙醇胺盐峰面积的平均值;m1表示杀螺胺标样的质量(g);P表示标准品中杀螺胺的质量百分数(%);1.186 8为杀螺胺换算成杀螺胺乙醇胺盐系数。
2 结果与分析
2.1 流动相影响
由图1和图2可知,以SpursilTMC18为色谱柱,当分别以甲醇︰水=90︰10和甲醇︰水︰三乙胺=90︰10︰0.1作为流动相时,杀螺胺乙醇胺盐的保留时间分别为4.988Min和1.785Min,甲醇与水的比例一样,但是加入三乙胺后,保留时间提前,并且避免了前沿峰。Huber[13]提出,三乙胺会和固定相上残留的硅羟基结合,还会与C18发生疏水作用,可减弱溶质与固定相的相互作用,促使溶质更快地从固定相上被流动相洗脱。由于三乙胺的这种有机调节剂作用,在液相色谱分析中将其加入到流动相中,在减少样品中碱性组分前沿的同时,对峰形和保留时间也有一定影响。
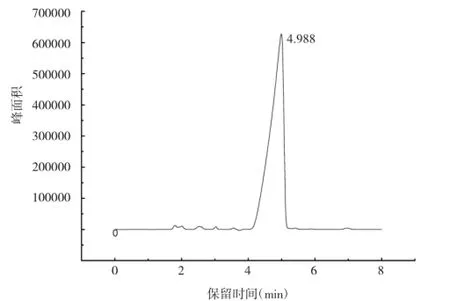
图1 色谱柱SpursilTMC18
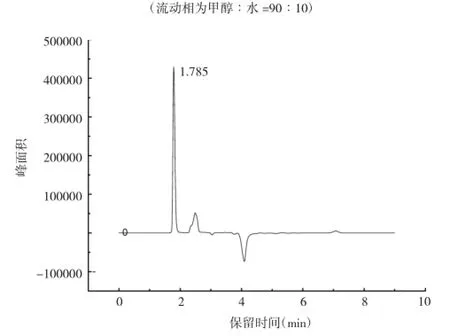
图2 色谱柱SpursilTMC18(流动相为甲醇︰水︰三乙胺=90︰10︰0.1)
以甲醇︰水︰三乙胺=54︰46︰0.115为流动相时,从图3中可以看出,样品中的成分没有完全分离。这与伍一红[5]在杀螺胺乙醇胺盐在水稻和稻田中的残留及消解动态试验的报道不一致。因此,在具体操作中,要使物质得到较好地分离,使峰形、峰纯度、分离度等达到要求,需要适当调整流动相比例。
2.2 色谱柱影响

图3 色谱柱SpursilTMC18(流动相为甲醇︰水︰三乙胺=54︰46︰0.115)
当流动相及分离条件相同时,分别以SpursilTMC18和Athena C18-WP作为色谱柱,从图2和图4中可以看出,样品出峰的时间分别为1.785Min和2.167 Min,峰形也都尖锐、对称。两根色谱柱都是高纯度硅胶基质液相色谱柱,但对杀螺胺乙醇胺盐的分离效果却不同,这可能是因为固定相的制备重复性偏差,或不同厂家生产的色谱柱在填料的粒度分布、原材料、硅胶基质表面积等方面均有差异,从而引起保留值的变化。色谱柱表面积增加,则有机相的量与保留值均有所提高,而且硅胶基质表面的硅羟基浓度差异,也能引起保留值及分离选择性的不同[14-15]。
2.3 色谱条件的检测
2.3.1 线性关系 由表1可知,色谱柱为SpursilTMC18,流动相为甲醇︰水︰三乙胺=90︰10︰0.1时,线性相关系数为0.999 9,高于另外两种方法,线性关系最好。

图4 色谱柱Athena C18-WP(流动相为甲醇︰水︰三乙胺=90︰10︰0.1)
2.3.2 精密度 由表 2可知,色谱柱为SpursilTMC18,流动相为甲醇︰水︰三乙胺=90︰10︰0.1时,标准偏差为0.185,变异系数为0.240,均低于另外两种方法,精密度最高。
2.3.3 准确度 由表3可知,色谱柱SpursilTMC18、流动相甲醇︰水︰三乙胺=90︰10︰0.1时,平均回收率高于另外两种方法,准确度最高。

表1 3种色谱条件线性关系的比较

表2 3种色谱条件精密度的比较

表3 3种色谱条件准确度的比较
3 结论
试验结果表明,在流动相中添加适当的改性剂三乙胺,使保留时间提前,分析时间缩短,同时避免了前沿峰,分离效果好。因此,甲醇︰水︰三乙胺=90︰10︰0.1的流动相分离杀螺胺乙醇胺盐的效果更好。
使用不同厂家生产的色谱柱对杀螺胺乙醇胺盐的检测效果有差别,这与色谱柱生产厂家填料等因素有关。因此,在检测分析杀螺胺乙醇胺盐时,色谱柱的选择也需要特别注意,合适的色谱柱可以得到更可信的结果。研究结果表明,色谱柱SpursilTMC18比色谱柱Athena C18-WP分离杀螺胺乙醇胺盐的效果要好。
综上所述,色谱柱为SpursilTMC18,流动相为甲醇︰水︰三乙胺=90︰10︰0.1时,杀螺胺乙醇胺盐的分离效果好,准确度较高,可以作为分析杀螺胺乙醇胺盐原药的定量分析方法。
[1] WHO/SCHISTO/92. The role of mollusciciding in schistosomiasis control division of control of tropical disease[R]. Geneva:Switzerland,1992.
[2]陈 昌.我国的杀螺剂及其应用[J].中国血吸虫病防治杂志,2003,15(5):321-322.
[3] 方益民,黄轶盺.氯硝柳胺乙醇胺盐粉剂的应用[J].中国血吸虫病防治杂志,2007,19(5):398-400.
[4]姜 柳,李树风,李新松,等.氯硝柳胺乙醇胺盐纳米剂的制备与杀螺效果[J].中国血吸虫病防治杂志,2006,19(2):102-106.
[5]伍一红,龚道新,张素芳,等.杀螺胺乙醇胺盐在水稻和稻田中的残留及消解动态[J].农业环境科学学报,2012,31(2):278-283.
[6] 严相平,王康蕊,王浦海,等.H P L C法测定泥土中氯硝柳胺的含量[J].农药,2011,50(5):350-351.
[7] 王 飞,戴建荣.氯硝柳胺的毒理学安全性评价研究概况[J].中国人兽共患病学报,2013,29(1):86-90.
[8]金良正,曹丽军,裘淑华,等.鱼塘污染灭螺剂氯硝柳胺的快速化学鉴别[J].中国卫生检验杂志,2007,17(8):1440-1441.
[9]姜友富,王 俊,嵇正平,等.氯硝柳胺现场检测方法和检测仪的研究与开发[J].中国血吸虫病防治杂志,2009,21(3):209-211.
[10]林自建,陈茹娟.氯硝柳胺乙醇胺盐高压液相色谱分析[J].四川化工与腐蚀控制,2000,2(3):9-10.
[11]杨俊柱,朱传明.50%氯硝柳胺乙醇胺盐可湿性粉剂的高效液相色谱测定[J].农药科学与管理,2006,25(7):12-14.
[12]孙 海,陈岸燕,余晓峰,等.农药产品中贝螺杀乙醇胺盐的高效液相色谱分析[J].浙江化工,2008,39(12):25-26.
[13] Huber C G.Micropellicular stationary phases for high-performance liquid chromatography of double-stranded DNA[J]. Journal of ChromatographyA,1998,806(1):3-30.
[14]张庆合.高效液相色谱实用手册[M].北京:化学工业出版社,2008. 78.
[15] McCalley D V. Study of the selectivity,retention mechanisms and performance of alternative silica-based stationary phases for separation of ionised solutes in hydrophilic interaction chromatography[J]. Journal of Chromatography A,2010,1217(20):3408-3417.
DeterMination of NiclosaMide EthanolaMine Salt by RP-HPLC
CAO Jia1,2,SONG Si-si1,2,LIXiao-gang1,2,LIU Yi-ping3,YANG Xue-qing4
(1.College of Plant Protection,Hunan Agricultural University,Changsha 410128,PRC;2.Hunan Provincial Engineering&Technology Research Center for Bio-pesticide and Formulating Processing,Changsha 410128,PRC;3.Hunan Agrochemicals Control Institute, Changsha 410005,PRC;4.Hunan Jingxi Lung Cheung Chemical Industry Co.,Ltd,Zhuzhou 412005,PRC)
In order to analyze the influence of tw o kinds of chromatographic column,three typesofmobile phase on the separating effect of NiclosaMide ethanolaMine salt,RP-HPLC wasused.The results showed thatw hen the chromatographic column was SpursilTMC18,and themobile phase ofmethanol,waterand trimethylaminewas90︰10︰0.1(V/V),the standard deviation ofmeasured valuewas 0.185, the variable coefficientwas0.240%,the average recovery rate w as 97.12%and the linearly dependent coefficientwas0.999 9.Therefore, we can conclude thatunder this condition the Niclosamide ethanolaMine salt had good separating effect,and themethod can be used to measure theactive compound ofNiclosamideethanolaminesaltbecauseof itssimpleand rapid.
NiclosaMideethanolamine salt;Niclosamide;HPLC;triethylamine
TQ450.7
A
1006-060X(2015)04-0102-03
10.16498/j.cnki.hnnykx.2015.04.032
2015-03-13
湖南省自然科学基金资助项目(13JJ5023);湖南省高等学校科学研究重点项目(11A053)
曹 佳(1990-),女,湖南郴州市人,硕士研究生,主要从事农药残留分析与环境行为研究。

