1株三乙胺高效降解菌的筛选鉴定及其降解特性研究
苏建文, 许尚营, 陈建华, 时永辉, 王俊超, 王彩冬, 郑 浩, 贾秀粉
(山东新时代药业有限公司,山东 临沂 273400)
1株三乙胺高效降解菌的筛选鉴定及其降解特性研究
苏建文, 许尚营*, 陈建华, 时永辉, 王俊超, 王彩冬, 郑 浩, 贾秀粉
(山东新时代药业有限公司,山东 临沂 273400)
从山东某制药厂污水处理系统的活性污泥中驯化、筛选分离得到1株能够以三乙胺作为唯一碳源、氮源和能源进行生长的细菌,命名为T-5。根据菌落形态观察、生理生化特征和16S rDNA基因序列同源性对比分析对其进行鉴定,发现该菌为需氧、革兰阳性菌,氧化酶呈阳性反应,吲哚试验呈阴性反应,不分解乳糖,且该菌的16S rDNA序列与蜡状芽胞杆菌(Bacilluscereus)的相似度达99%,因此,初步鉴定该菌为蜡状芽胞杆菌。通过摇瓶实验考察了温度、pH、接种量对菌株T-5降解三乙胺性能的影响,实验结果表明该菌生长和降解三乙胺的最适培养条件为温度30 ℃,pH 7.0。在最适培养条件下,T-5能够在48 h内将500 mg/L三乙胺完全降解。研究成果对高效处理环境中的三乙胺污染具有重要的应用价值。
三乙胺;菌株鉴定;蜡状芽胞杆菌;降解性能
三乙胺是一种脂肪族胺,具有强烈的氨臭味、有刺激性,易燃,易挥发,在有机合成、农药、制药、燃料等生产中被作为重要的溶剂和工业原料[1-2]。近年来工业上三乙胺废水排放量日益增加,使得三乙胺污染日益严重。许多研究表明,三乙胺对动物和人类有毒害作用,长期暴露于三乙胺中对肾、肝、肺和心血管系统均有损害[3]。因此,有效处理三乙胺废水非常重要。目前,三乙胺废水的处理方法主要为物理化学法,包括吸附法、氧化法、焚烧法和吸收法等[4-5]。然而,这些方法有许多缺点。相比之下,生物处理方法因其具有处理量大,成本低,条件温和,不产生二次污染等优点,成为三乙胺废水处理技术的研究热点[6-9]。Wang Chun-Chin 等[10]研究发现,经过驯化后污泥中的混合菌群能够利用工业合成废水中的三乙胺进行生长繁殖。Rappert S. 等[11]从被污染的土壤中分离出2株三乙胺降解菌PseudomonascitronellolisRAl和MycobacteriumdienhoferiRA2,能够利用三乙胺作为唯一碳源和能源生长。Cai Tianming等[12]自制药厂活性污泥中分离得到1株细菌ArthrobacterprotophormiaeR4,该菌珠在浓度为100 mg/L的三乙胺溶液中培养32 h,能够将三乙胺完全降解。国内有关纯种微生物降解三乙胺的报道较少。本研究自山东某制药厂污水的活性污泥中筛选得到1株能够高效降解三乙胺的菌株BacilluscereusT-5,对其生长代谢及降解特性进行了研究,实验结果将对处理工业产生的三乙胺废水提供理论依据和菌种资源。
1 材料与方法
1.1 材料
培养基(g/L) ①三乙胺无机盐培养基:KH2PO40.09,K2HPO40.22,NaH2PO40.26,MgSO4·7H2O 0.23,CaCl20.28,FeCl30.003,三乙胺浓度根据实验需要而定,pH约为7.0;②富集培养基:胰蛋白胨10,酵母浸膏5,NaCl 10,pH约为7.5,121 ℃湿热灭菌20 min;③牛肉膏蛋白胨培养基:牛肉浸膏3,蛋白胨10,NaCl 5,pH 7.2~7.4,121 ℃湿热灭菌20 min。
1.2 方法
1.2.1 样品采集与菌株的分离纯化 样品取自山东某制药厂污水处理系统中的活性污泥。取10 mL活性污泥接种于含100 mg/L三乙胺的无机盐培养基中,设定温度30 ℃,150 r/min振荡培养8 d。采用梯度压力驯化法,每隔8 d以10%的接种量依次转接到含有200、300、400和500 mg/L的三乙胺无机盐培养基中,相同条件下继续培养。前期驯化完成后,采用稀释涂布平板法,在含有500 mg/L三乙胺的无机盐固体培养基上涂布,待菌体生长后,选择生长良好,形态不同的菌落转接至含相同质量浓度的三乙胺无机盐液体培养基中,转接3次后,采用平板划线法,在含有500 mg/L三乙胺的无机盐固体培养基上分别划线,挑取单一菌落至富集培养基中培养。培养后再经多次平板划线,直至获得单一菌落。将菌株接种于三乙胺无机盐斜面培养基,置于4 ℃冰箱保存。
1.2.2 细菌生物学鉴定 ①菌株T-5的生理生化鉴定:参照《常见细菌系统鉴定手册》[13]和《伯杰氏细菌鉴定手册》[14]对降解菌株进行鉴定;②菌株T-5的16S rDNA扩增及鉴定:菌株DNA的提取方法参照文献[15],PCR引物为通用引物F27(5′-AGAGTTTGATCATGTCTCAG-3′)和R1492(5′-TACGGTTACCTTGTTACGACTT-3′)进行PCR扩增。PCR反应体系(50 μL体系):Templet(Genomic DNA)1 μL,2 mmol/L dNTPs 5 μL,10×KOD Buffer 5 μL,Forward Primer(10 μmol/L)1 μL,Reverse Primer(10 μmol/L)1 μL,KOD DNA Polymerase 1 μL,ddH2O 36 μL。PCR反应程序:预变性94 ℃ 3 min;循环94 ℃ 30 s,58 ℃ 30 s,72 ℃ 3 min,35个循环;延伸72 ℃ 10 min。PCR产物纯化后,由上海生工生物工程公司进行序列测定,获得的序列提交至GenBank,通过BLAST程序与其他细菌16S rDNA序列进行同源性对比分析。采用Clustal W软件与Mega 4.1软件中Neighbor-Joining构建系统进化树。
1.2.3 菌株T-5的降解特性研究 将分离纯化得到的菌株接种于富集培养基中,培养12 h后收集菌体,无菌条件下用无菌水洗涤3次,用等体积的无机盐培养基将菌体重悬,调菌悬液OD600至1.0,作为种子液备用。取新鲜种子液5 mL,接种于100 mL无机盐培养基的250 mL锥形瓶中,分别考察在初始三乙胺浓度500 mg/L、转数150 r/min条件下,不同接种量、温度和pH对菌株生长和三乙胺降解的影响。
1.2.4 菌株T-5对三乙胺废水的处理 三乙胺废水取自山东某制药厂,废水中三乙胺质量浓度为68 316 mg/L,将该废水稀释至三乙胺质量浓度为500 mg/L作为实验原水。取实验原水200 mL于500 mL的锥形瓶内,按5%的接种量将T-5种子液接种至锥形瓶内,置于恒温振荡培养箱中30 ℃、150 r/min条件下培养,并检测三乙胺浓度。
1.2.5 分析方法 ①三乙胺含量的测定:样品经0.22 μm过滤后,碱性条件下利用二氯甲烷萃取,釆用气相色谱法测定[16-17];②菌体生长量的测定:细菌的生长量通过分光光度法测定,以波长600 nm处的光密度(OD600)表示;③氨氮浓度的测定:样品经0.22 μm过滤后,采用纳氏试剂法测定[18]。
2 结果与分析
2.1 菌株的形态学及生理生化特征
通过富集培养从山东某制药厂污水处理系统的活性污泥样品中分离得到1株细菌T-5,该菌能以三乙胺作为唯一碳源、氮源和能源,在质量浓度为500 mg/L三乙胺的无机培养基中生长良好。菌株T-5在LB平板上培养,形成的菌落较大,圆形,灰白色,不透明,表面粗糙(似毛玻璃状),边缘呈扩散状。生理生化测试发现,菌株T-5为需氧革兰阳性菌,氧化酶呈阳性反应,吲哚试验呈阴性反应,不分解乳糖,吲哚反应、MR反应均呈阴性,能够发酵多种糖类(表1)。
2.2 菌株T-5的16S rDNA分子鉴定及系统发育分析
提取菌株T-5的基因组DNA,利用通用引物扩增得到16S rDNA,如图1所示。经测序得到的16S rDNA序列与GenBank数据库的多种芽胞杆菌相似度达99%以上。GenBank登录号为KF 877717。图2为菌株T-5的系统发育树。菌株T-5与BacilluscereusATCC14579(NR 074540)的进化距离最近。结合T-5的形态及生理生化特性实验,鉴定该菌为蜡状芽胞杆菌(Bacilluscereus)。

表1 T-5的生理生化特性
注:“+”为阳性反应;“-”为阴性反应

图1 PCR扩增产物凝胶电泳图像Fig.1 Agarosegle electrophoresis of PCR amplified 16S rDNA
2.3 菌株T-5的生长及对三乙胺的降解特性研究
将T-5的新鲜种子液以5%的接种量接种于质量浓度为500 mg/L的三乙胺的无机盐液体培养基中,30 ℃、150 r/min条件下连续振荡培养。每隔一定时间检测三乙胺、氨氮的质量浓度和OD600(图3)。由图3可知,最初16 h内T-5处于生长的延滞期,菌体生长缓慢,三乙胺的降解速率很低;16~40 h时,T-5处于对数生长期,菌体增殖迅速,生长量明显增加,三乙胺降解速率最快,降解率高达92.5%;40 h后菌体生长进入稳定阶段,最大菌体光密度达到0.294。此外,随着三乙胺的降解,培养基中的氨氮质量浓度逐渐上升,最终达到58.3 mg/L,达到理论释放值的85%。
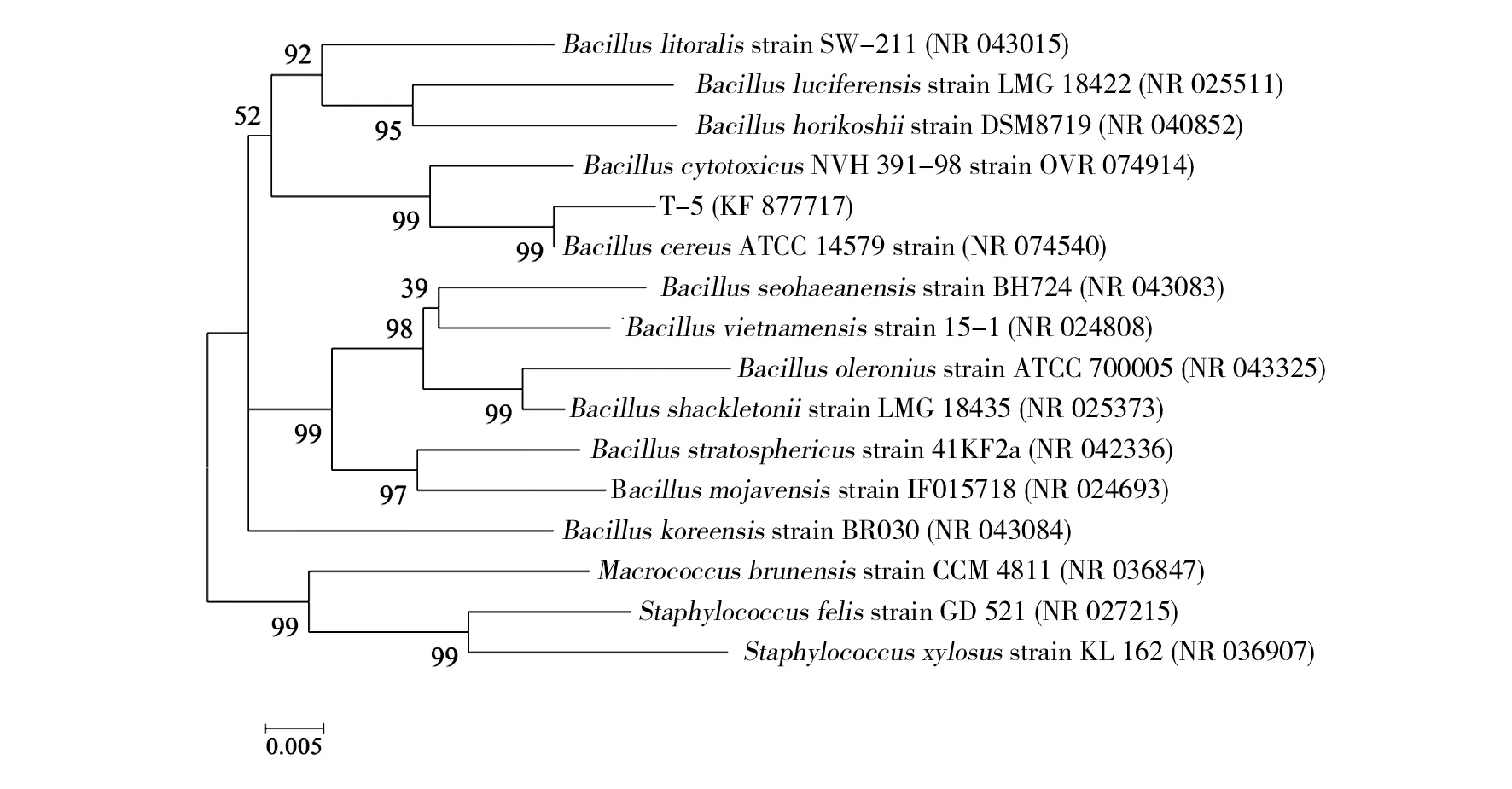
图2 菌株T-5系统发育树Fig.2 Phylogenetic tree of strain T-5
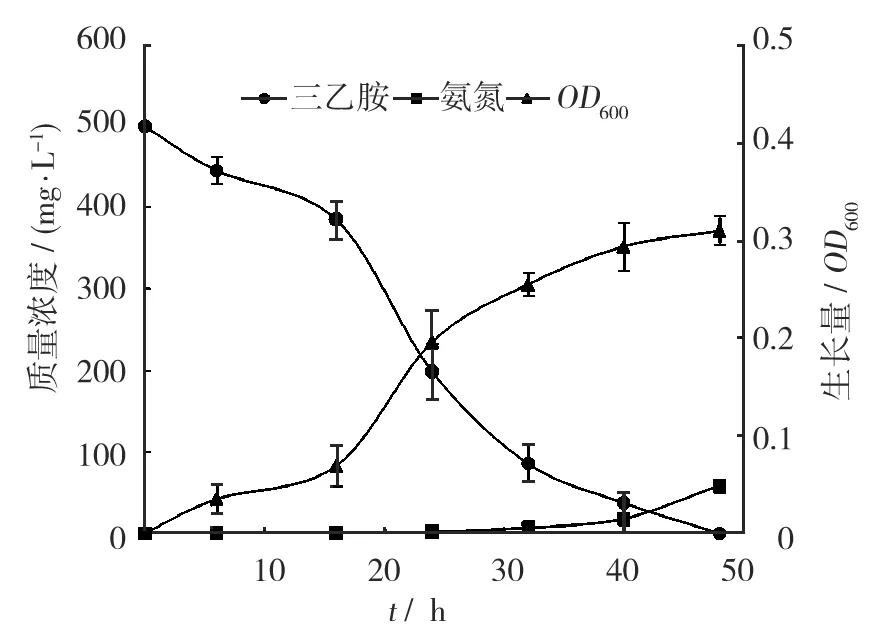
图3 菌株T-5生长曲线和三乙胺降解曲线Fig.3 Growth curve of strain T-5 and degradation curve of triethylamine
2.4 不同因素对三乙胺降解的影响
2.4.1 接种量对菌株T-5降解三乙胺的影响 按0.5%、1%、3%、5%和10%的接种量将T-5种子液接种于质量浓度为500 mg/L的三乙胺的无机盐液体培养基中,30 ℃、150 r/min条件下连续振荡培养64 h。每隔8 h测定三乙胺质量浓度。接种量表明了菌体量和底物量之间的比例关系,体现了底物和微生物之间的相互影响,接种量对T-5降解三乙胺的影响如图4所示。

图4 接种量对菌株T-5降解三乙胺的影响Fig.4 Effect of inoculation on triethylamine degradation of strain T-5
接种量由0.5%增至5%时,随着接种量的增加,三乙胺的降解效果也不断增强。当接种量继续增加至10%时,三乙胺的去除效果变化并不明显。其原因可能是当接种量较少时,底物浓度相对较高,从而使细菌长期处于生长延滞期,导致三乙胺去除率不高。当提高接种量时,能增加菌体浓度,使得延滞期缩短。但接种量过大时,由于受培养基内营养限制,菌体的数量会达到饱和,致使菌体对三乙胺的降解效率提高不明显。
2.4.2 温度对菌株T-5降解三乙胺的影响 将T-5种子液按5%的接种量接种于质量浓度为500 mg/L的三乙胺的无机盐液体培养基中,pH 7.0、150 r/min条件下,分别在20、25、30、35、40和45 ℃连续振荡培养64 h,测定三乙胺质量浓度。
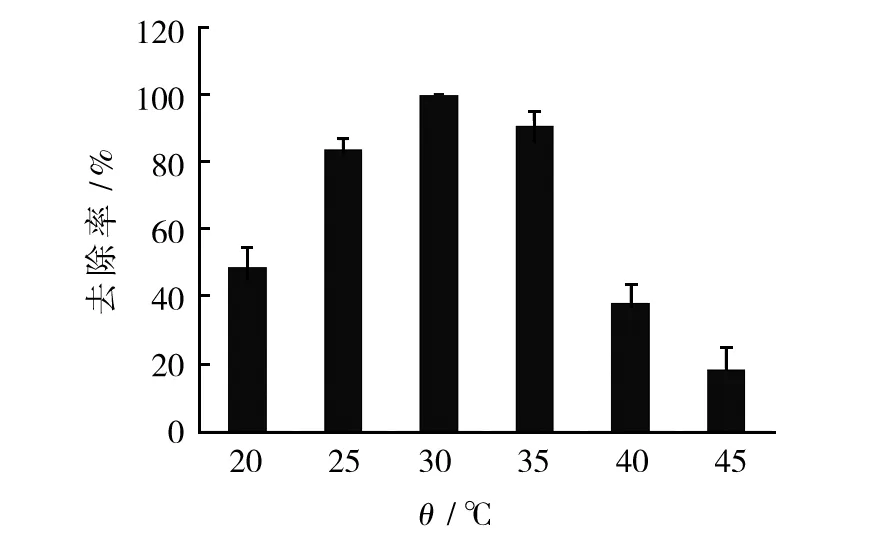
图5 温度对菌株T-5降解三乙胺的影响Fig.5 Effect of temperature on triethylamine degradation of strain T-5
由图5可知,温度对三乙胺的去除有显著的影响,温度由20 ℃升高至30 ℃过程中,三乙胺的去除率显著提高,在30 ℃时降解效果最佳,去除率为100%。然而,当温度超过40 ℃时,三乙胺的降解效果明显下降,45 ℃时三乙胺的降解率最低,这是因为高温致使代谢过程所需的酶变性或失活,导致无法实现对三乙胺的降解。因此,该菌最适降解温度为30 ℃。
2.4.3 pH对菌株T-5降解三乙胺的影响 以5%的接种量将T-5种子液接种于质量浓度为100 mL的三乙胺的无机盐液体培养基中,30 ℃、150 r/min条件下,利用2 mol/L的HCl将培养基pH分别调至5.0、6.0、7.0、8.0、9.0和10.0,连续振荡培养64 h。每隔8 h测定三乙胺浓度。由图6可知,在不同的pH条件下,菌株T-5对三乙胺均有降解作用,但降解率不同。当pH小于7.0时,随着pH增加三乙胺的去除率明显提高;而当pH大于7.0时,三乙胺的去除效果开始下降;pH为7.0时,三乙胺降解率最高,达到99.5%。结果表明酸性条件更利于三乙胺的去除。这是由于三乙胺代谢的最终产物为NH3,当初始pH过高时会使培养基中游离NH3浓度增加,导致微生物出现中毒现象,降低三乙胺的降解效率;反之,初始pH较低时,酸性环境可以减弱自身代谢产物的影响,使得三乙胺降解率提高。但是,初始pH为5.0时,由于酸性环境影响微生物的正常生理活动,使菌体受到酸性侵害,导致降解率下降。
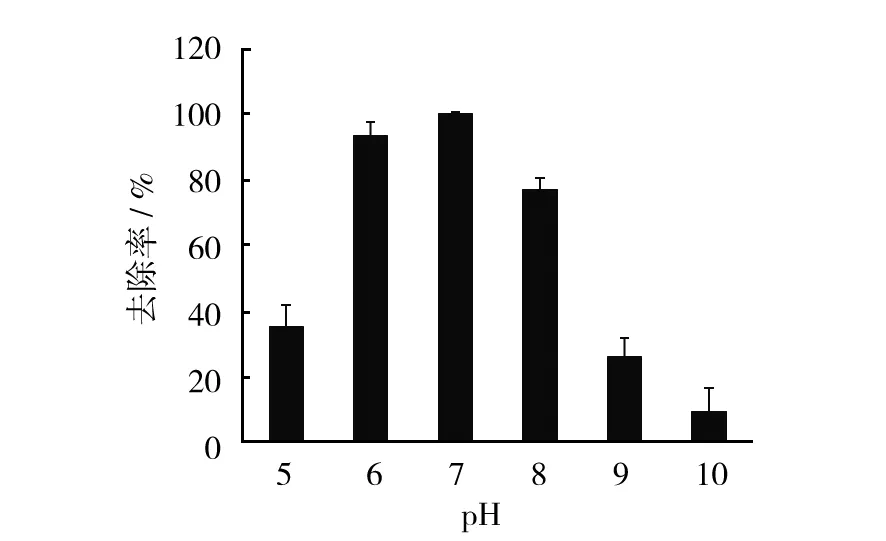
图6 pH对菌株T-5降解三乙胺的影响Fig.6 Effect of pH on triethylamine degradation of strain T-5
2.5 菌株T-5对三乙胺废水的处理效果
为考察菌株T-5对含三乙胺化学合成制药废水的处理效果,将10 mL新鲜T-5种子液接种于200 mL稀释后的三乙胺废水中,于30 ℃、150 r/min条件下恒温振荡培养48 h,并设置对照组(不接种T-5,其他条件同实验组)。利用气相色谱检测三乙胺去除效果,结果见图7。由图7可见,实验组中菌株T-5在48 h内将质量浓度为500 mg/L的三乙胺完全降解。与实验组相比,对照组中三乙胺质量浓度仅有少量降低。这说明该菌株能够在某些含三乙胺的生产废水中生长繁殖,并有效地去除三乙胺。因此,该菌株具有很好的潜在应用价值。
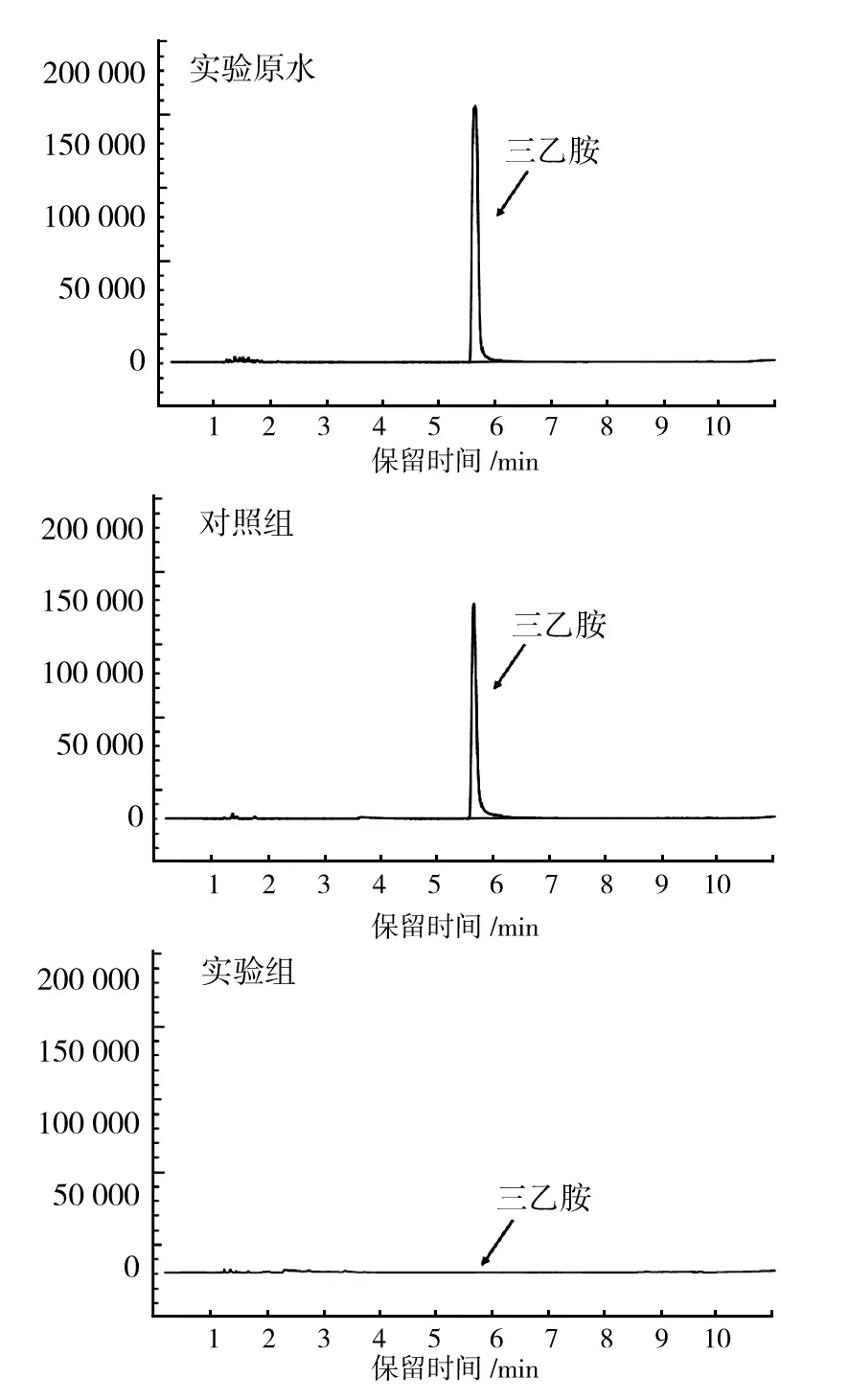
图7 降解48 h后三乙胺的GC检测Fig.7 GC detection of triethylamine after biodegradation by 48 h
3 讨 论
Bacilluscereus是一类需氧型的革兰阳性细菌,广泛存在于自然界中,能够降解多种有机污染物,如苯胺、草甘膦、氯氰菊酯等,在自然环境的生物修复中发挥着重要作用。本研究自山东某制药厂污水处理系统的活性污泥中驯化、筛选分离得到1株高效三乙胺降解菌,命名为T-5。该菌能以三乙胺作为唯一碳源、氮源及能源。将该菌株的16S rDNA序列在GenBank数据库上比对分析,发现与多种芽胞杆菌的相似度达99%,同时结合菌体的形态观察、生理生化特性,鉴定该菌为蜡状芽胞杆菌(Bacilluscereus)。降解性能实验表明:菌株T-5的最佳降解条件是接种量为5%,pH 7.0,温度为30 ℃。最佳降解环境下对质量浓度为500 mg/L的三乙胺在48 h内降解率达到100%。
本研究首次发现了该菌属的菌株能够降解三乙胺,具有进一步研究的价值。在目前的研究报道中,菌株PseudomonascitronellolisRA1和MycobacteriumdienhoferiRA2需要4 d才能够降解初始质量浓度为200 mg/L的三乙胺。菌株ArthrobacterprotophormiaeR4在32 h内仅能降解质量浓度为100 mg/L的三乙胺。相比之下,菌株T-5在48 h内能够完全降解质量浓度为500 mg/L的三乙胺,具有更高的耐受性和降解速率,具有明显的优势。
[1]Abdolkarim Zarea,Ahmad Reza Moosavi-Zareb,Maria Merajoddina,et al.Ionic liquid triethylamine-bonded sulfonic acid d {[Et3N-SO3H]Cl} as a novel,highly efficient and homogeneous catalyst for the synthesis of β-acetamido ketones,1,8-dioxo-octahydroxanthenes and 14-aryl-14H-dibenzo[a,j]xanthenes[J].Journal of Molecular Liquids,2012,167:69-77.
[2] Ochoa-Gómeza JR.,Gómez-Jiménez-Aberasturia Olga,Camilo A. Ramírez-Lópeza,et al.Synthesis of glycerol carbonate from 3-chloro-1, 2-propanediol and carbon dioxide using triethylamine as both solvent and CO2fixation-activation agent[J]. Chemical Engineering Journal,2011,175(15):505-511.
[3]谢钦铭.三乙胺对水生生物毒性的研究[J].江西大学学报)自然科学版),1992,12(1):88-94.
[4]曾帆,于萍,罗运柏.水体中二甲胺的吸附与氧化降解[J].环境科学与技术,2012,35(2):148-153.
[5]H. Aimin, L.X. Cao, C. Jie, et al. Photocatalytic degradation of triethylamine on titanium oxide thin films[J]. J. Catal,1999,188:40-47.
[6]赵冬梅,顾文杰,张发宝,等.1株好氧堆肥高温H2S脱臭菌的筛选、鉴定及生长特性[J].微生物学杂志,2012,32(6):47-52.
[7]毛菲菲,刘畅,何梦琦,等.红霉素降解菌的筛分及其降解特性的研究[J].环境科学与技术,2013,36(7):9-12.
[8]Li T., Liu J., Bai R., et al. Biodegradation of organonitriles by adapted activated sludge consortium with acetonitrile-degrading microorganisms[J].Water Research,2007,41:3465-3473.
[9]Dash R.R., Gaur A., Balomajumder C.. Cyanide in industrial wastewaters and its removal:a review on biotreatment[J].Journal of Hazardous Materials,2009,163:1-11.
[10]Wang Chun-Chin, Lu Kuei-Lieh, Chen Xin-Yi. Removal of triethylamine from synthetic wastewater by acclimated mixed bacteria cultures[J].International Biodeterioration &Biodegradation,2007,59:202-205.
[11]Rappert S., Ayoub R., Li R., et al. Biologischer Abbauvon geruchsaktiven Einzelstoffen und von realen Vielstoffgemischen[D]. Erfassungund Minimierung von Gerüchen, in: B. Niemeyer, A. Robers, P. Thiesen (Eds.), Messungund Minimierung von Gerüchen, Hamberburger Berichte,2004,pp.203-220.
[12]Cai Tianming, Chen Liwei, Ren Qian, et al. The biodegradation pathway of triethylamine and its biodegradation by immobilized Arthrobacter protophormiae cells[J].Journal of Hazardous Materials,2011,186(1):59-66.
[13]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[14]Buchanan R.E., Gibbons N.E. Bergey's Manual of Determinative Bactreiology[M].8h ed. Baltimore: Williams&Wilikins Company,1974.
[15]齐育平,陈丹凤,黄樟阳,等.1株拮抗水稻纹枯病菌鼠乳杆菌的筛选与鉴定[J].微生物学杂志,2013,33(6):43-48.
[16]林惠文,秦榜辉.废水中三乙胺的顶空气相色谱分析方法的研究[J].化工时刊,2012,26(4):32-34.
[17]Ashish Ravindra Deshpande, Ramesh Yamgar, Ganesh Ramachandran. Determination of Diethylamine and Triethylamine quantitatively using GC-headspace chromatography[J].Eurasian Journal of Analytical Chemistry,2012,7(1):43-48.
[18]国家环境保护总局.水和废水监测分析方法(第4版)[M].北京:中国环境科学出版社,2002.
Screening and Identification of Triethylamine-Degradable Bacteria and Its Biodegradation Characteristics
SU Jian-wen, XU Shang-ying, CHEN Jian-hua, SHI Yong-hui,WANG Jun-chao, WANG Cai-dong, ZHENG Hao, JIA Xiu-fen
(ShandongNewTimePharm.Co.,Ltd.,Linyi273400)
A bacteria strain named as T-5 that could grow utilizing triethylamine as sole carbon source, nitrogen source, and energy was tamed and isolated from activated sludge in wastewater treatment pool in a pharmaceutical plant Shandong Province. It was an aerobic, Gram-positive, oxidase reaction positive, indole test reaction positive, lactose indecomposable, similarity of its 16S rDNA withBacilluscereuswas 99%, therefore, it was initially identified asBacilluscereusbased on 16S rRNA gene sequence analysis, homology comparison and analysis, morphological, and physiological properties. The pH, temperature and inoculation for the growth of T-5 were observed in shaker flash for the effect of its triethylamine degradable performance, the results showed that the optimal conditions were pH 7.0, 30 ℃, and 5%, respectively. T-5 was able to completely degrade 500 mg/L triethylamine within 48 hours under the optimal degradable conditions. This research achievement has very important application value for efficient treatment of triethylamine pollution in the environment.
triethylamine; identification;Bacilluscereus; degradation performance
苏建文 男,工程师。主要研究方向为环境生物技术。Tel:0539-5030891,E-mail:suda1999@163.com
* 通讯作者。男,工程师。研究方向为环境微生物学。Tel:0539-5030891,E-mail:xushangying@126.com
2014-05-04;
2014-08-29
Q939.99; X172
A
1005-7021(2015)01-0054-07
10.3969/j.issn.1005-7021.2015.01.011