树突状细胞与调节性T细胞在大鼠动脉粥样硬化中的作用及氟伐他汀的干预效应研究*
牛 川,王 清
(1.潍坊医学院心血管内科,山东潍坊 261053;2.山东省千佛山医院心内一科,济南 250014)
论著·基础研究
树突状细胞与调节性T细胞在大鼠动脉粥样硬化中的作用及氟伐他汀的干预效应研究*
牛 川1,王 清2△
(1.潍坊医学院心血管内科,山东潍坊 261053;2.山东省千佛山医院心内一科,济南 250014)
目的 探讨树突状细胞(DCs)与调节性T细胞(Treg)在动脉粥样硬化过程中的作用机制及DCs与Treg之间的相关性,观察氟伐他汀对大鼠主动脉粥样硬化的干预效应。方法30只雄性Wistar大鼠,分为3组。其中,对照组10只,喂养普通饲料;高脂组10只,喂养普通AS饲料;氟伐他汀组10只,喂养AS饲料+氟伐他汀0.1 g·kg-1·d-1。喂养20周,取胸主动脉,采用流式细胞仪检测各组DCs的免疫表型CD11c、HLA-DR及Treg免疫分子CD4、CD25、FoxP3的表达,分析DCs、Treg在各组主动脉壁中的数量分布变化及DCs与Treg相关性。结果(1)流式细胞术检测,CD11c+及CD11c+HLA-DR+双阳性分子表达,高脂组及氟伐他汀组与对照组比较明显上调,差异有统计学意义(P<0.01);氟伐他汀组与高脂组比较明显下调,差异有统计学意义(P<0.01);(2)CD4+CD25+及CD4+CD25+FoxP3+Treg淋巴细胞表达,氟伐他汀组与高脂组比较,Treg淋巴细胞表达明显增加,差异有统计学意义(P<0.01),对照组血管壁内未见Treg表达;(3)相关性分析,动脉粥样硬化病变组织中CD11c+HLA-DR+DCs与CD4+CD25+FoxP3+Treg相关性分析显示,在高脂组与氟伐他汀组中均呈明显负相关。结论免疫细胞DCs与Treg均参与了AS大鼠主动脉粥样硬化病变的发生与发展过程,且氟伐他汀可通过降低粥样斑块内DCs的数量、增加CD4+CD25+FoxP3+Treg的表达来实现抗AS病变的目的。
动脉粥样硬化;树突细胞;调节性T细胞;氟伐他汀;免疫调节
动脉粥样硬化是一种免疫炎症性疾病,是通过一系列免疫反应来实现的,在经历脂质条纹、脂质斑块到纤维斑块和粥样硬化斑块的过程中,始终都有各种炎性细胞和大量炎症介质参与。目前,很多研究发现,在动脉粥样硬化斑块中存在大量的树突状细胞(DCs)和T淋巴细胞的浸润,DCs作为体内最强有力的抗原提呈细胞(antigen presenting cell,APC),在长期高血脂环境下,一旦被充分激活会将自身抗原提呈给T淋巴细胞而直接在血管壁发生炎性反应。调节性T细胞(Treg)是一组建立和维持外周免疫耐受的成熟CD4+CD25+T淋巴细胞亚群,而其中FoxP3是检测Treg的特征性标志,现已证实动脉粥样硬化病变外周血中的Treg数量会减少并成为动脉粥样硬化发生、发展的重要因素[1]。他汀类药物对心血管疾病有着多方面的作用,包括抑制血管内炎症、增强内皮细胞功能、增加循环血内皮祖细胞及增强其功能、减少血管平滑肌细胞的扩增及迁移、稳定动脉粥样硬化斑块及抑制血小板聚集等。目前,对粥样硬化斑块组织内DCs及Treg细胞表型的分布、两者之间的关系及药物的干预性研究较少。本实验通过对大鼠主动脉粥样硬化病变组织中DCs及Treg表型的分布及数量变化,进一步研究DCs及Treg与动脉粥样硬化形成过程的关系,并探讨在动脉粥样硬化过程中氟伐他汀对DCs及Treg的免疫调控作用,为他汀类药物抗动脉粥样硬化寻找新的理论依据及机制。
1 材料与方法
1.1 动物与试剂 健康雄性Wistar大鼠30只,鼠龄2~3个月,体质量200~220 g,购自山东大学实验动物中心。流式试剂:Anti-ratHLA-DR-FITC、Anti-ratCD11c-PE、anti-ratCD4-PC5、anti-ratCD25-PE、anti-ratFoxP3-PE、固定破膜液均购自eBioscience公司,兔抗大鼠IgG-PC5、IgG-PE、IgG-FITC购自BD公司。
1.2 实验动物模型的建立 30只雄性大鼠在比较理想的实验室条件下进行喂养[室内相关湿度为(80±2)%,温度为(24±1)℃]。先将大鼠适应性喂养7 d后,分为3组。(1)对照组(10只):给予普通饲料饮食;(2)高脂组(10只):给予普通AS饲料(5.0%胆固醇、0.7%胆酸钠、0.5%丙基硫氧嘧啶、6.0%白糖、10.0%猪油、77.8%基础饲料);(3)氟伐他汀组(10只):在给予AS饲料基础上,加用氟伐他汀0.1 g·kg-1·d-1。每天对大鼠的摄入量和体质量进行测定,以评估各种变化,20周后进行实验。喂养过程中对照组死亡2只,高脂组死亡3只,氟伐他汀组死亡5只。
1.3 标本采集 所有大鼠用戊巴比妥钠进行深度麻醉(120 mg/kg,腹腔内注射)后固定在手术台上,无菌操作下开胸,钝性分离胸主动脉并进行肝素盐水灌洗,剪下胸主动脉段组织1~2 cm置于75%乙醇中备用。
1.4 组织单细胞悬液的制备 将主动脉剪碎至小块放入离心管中,加入2~3 mL胶原酶及胰蛋白酶恒温37 ℃消化30 min,期间进行间接振荡,加入少量RPMI1640后以200目尼龙网过滤除去大团块并低速离心除去细胞碎片,弃上清液后用PBS漂洗沉淀细胞3次,离心后再次弃上清液得到细胞悬液。
1.5 DCs与Treg的流式细胞术检测 取各组主动脉单细胞悬液并调整细胞密度为1×106/mL,每组取细胞悬液各100 μL分别加入4个离心管中,对DCs及Treg分别进行检测。对DCs的检测标记为实验管和同型对照管,其中实验管加FITC anti-ratHLA-DR抗体、PE anti-ratCD11c抗体各10 μL,同型对照管加兔抗大鼠IgG-FITC、IgG-PE各10 μL,在室温避光反应30 min,用含0.5%的胎牛血清洗涤2遍,再加入300 μL PBS重悬成单细胞悬液后上机检测。对Treg的检测标记为实验管和同型对照管,其中,实验管加anti-ratCD4-PC5抗体、anti-ratCD25-PE抗体,对照管加兔抗大鼠IgG-PC5、IgG-PE各10 μL,避光孵育20 min,PBS液洗涤后重悬,加入1 mL固定、破膜工作液混匀,4 ℃避光60 min后加入2 mL PBS液离心洗涤2次,在实验管加入anti-ratFoxP3-PE抗体10 μL,对照管加入IgG-PE 10 μL,4 ℃避光后孵育40 min,用500 μL PBS重悬细胞后上机检测。

2 结 果
2.1 3组大鼠体质量变化比较 3组大鼠在喂养结束后体质量均出现不同程度增加,对照组、高脂组及氟伐他汀组大鼠的体质量分别为(30.52±1.58)g、(31.85±2.14)g、(28.63±1.75)g,3组大鼠间体质量比较差异无统计学意义(P>0.05)。见表1。
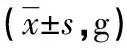
表1 3组大鼠体质量情况比较
2.2 3组大鼠主动脉壁内DCs水平变化比较 细胞流式结果分析,高脂组、氟伐他汀组的CD11c分子、CD11c+HLA-DR+双阳性分子表达较对照组明显上调,差异有统计学意义(P<0.01)。氟伐他汀组的CD11c分子、CD11c+HLA-DR+双阳性分子表达较高脂组明显下调,差异有统计学意义(P<0.01)。见表2、图1。

表2 3组大鼠DCs细胞表型的流式细胞分析比较
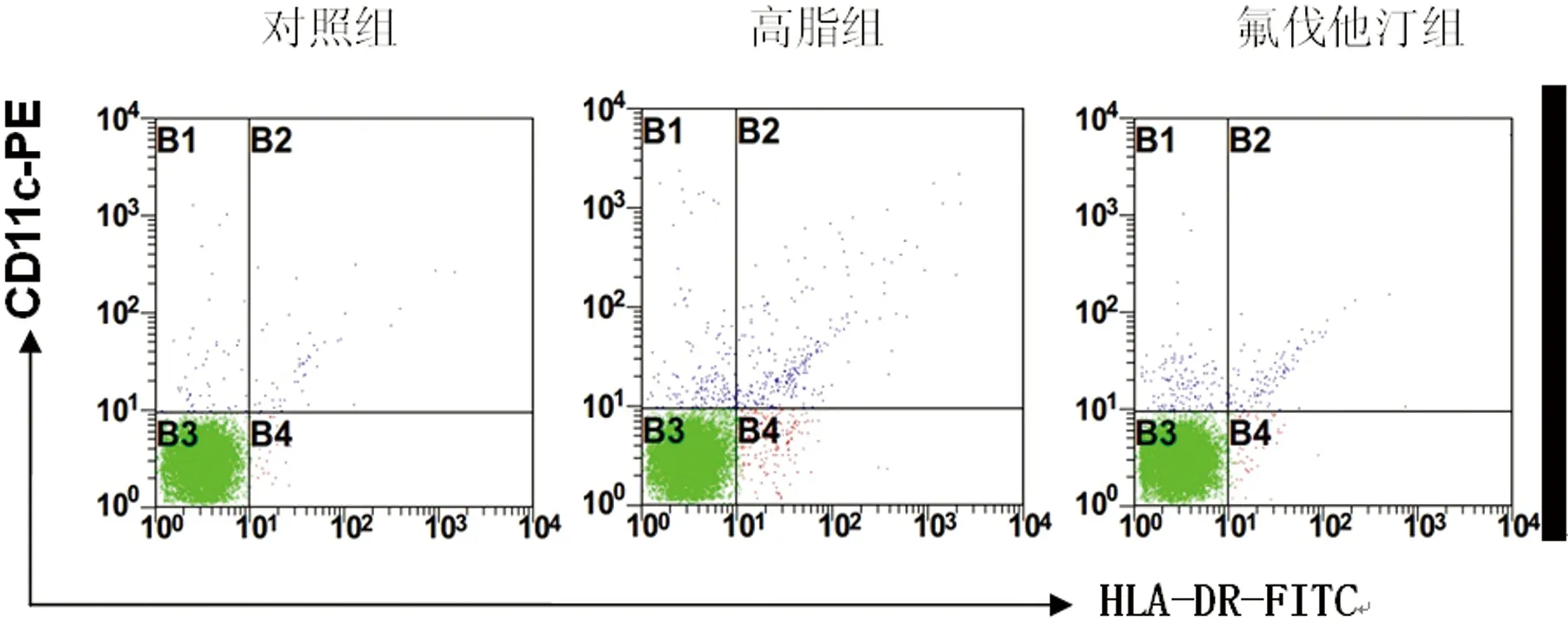
图1 流式细胞术检测各组CD11c+DCs和CD11c+HLA-DR+DCs的比例
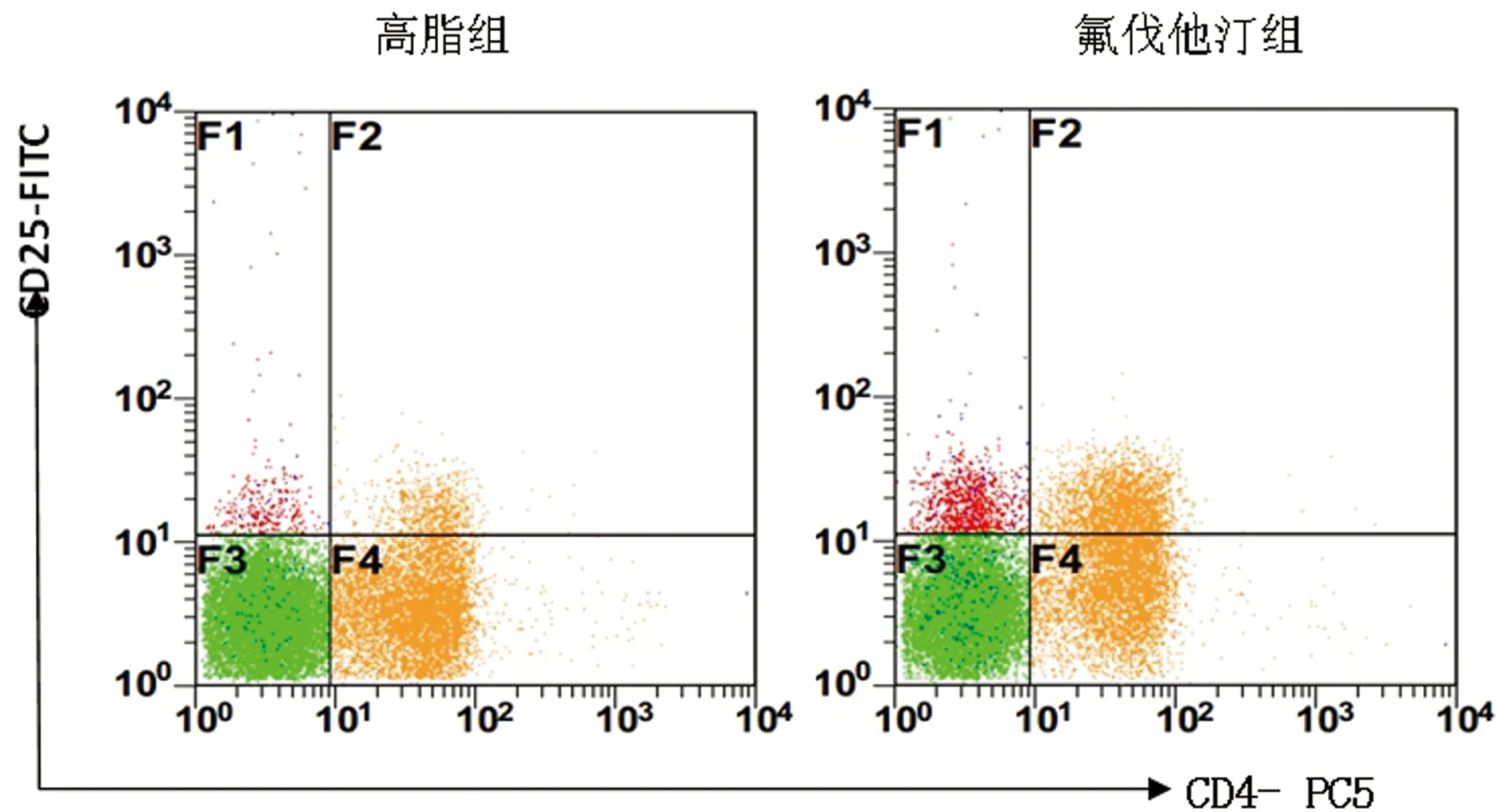
图2 流式细胞术检测高脂组与氟伐他汀组CD4+CD25+Treg占CD4+T细胞的比例
2.3 高脂组与氟伐他汀组大鼠主动脉壁病变组织Treg水平变化比较 流式细胞术检测结果分析,对照组血管壁内未见Treg细胞表达,高脂组与氟伐他汀组CD4+CD25+与CD4+CD25+FoxP3+Treg分别占CD4+T淋巴细胞比例的比较中显示,氟伐他汀组中二者的表达较高脂组均明显上调,差异有统计学意义(P<0.01)。见表3、图2。
2.4 高脂组与氟伐他汀组大鼠主动脉壁病变组织中DC与Treg的相关性 分析显示高脂组与氟伐他汀组CD11c+HLA-DR+DC细胞与CD4+CD25+FoxP3+Treg细胞在数量上呈明显负相关。见表4、图3。
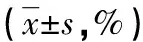
表3 高脂组与氟伐他汀组Treg细胞表型的流式细胞术分析
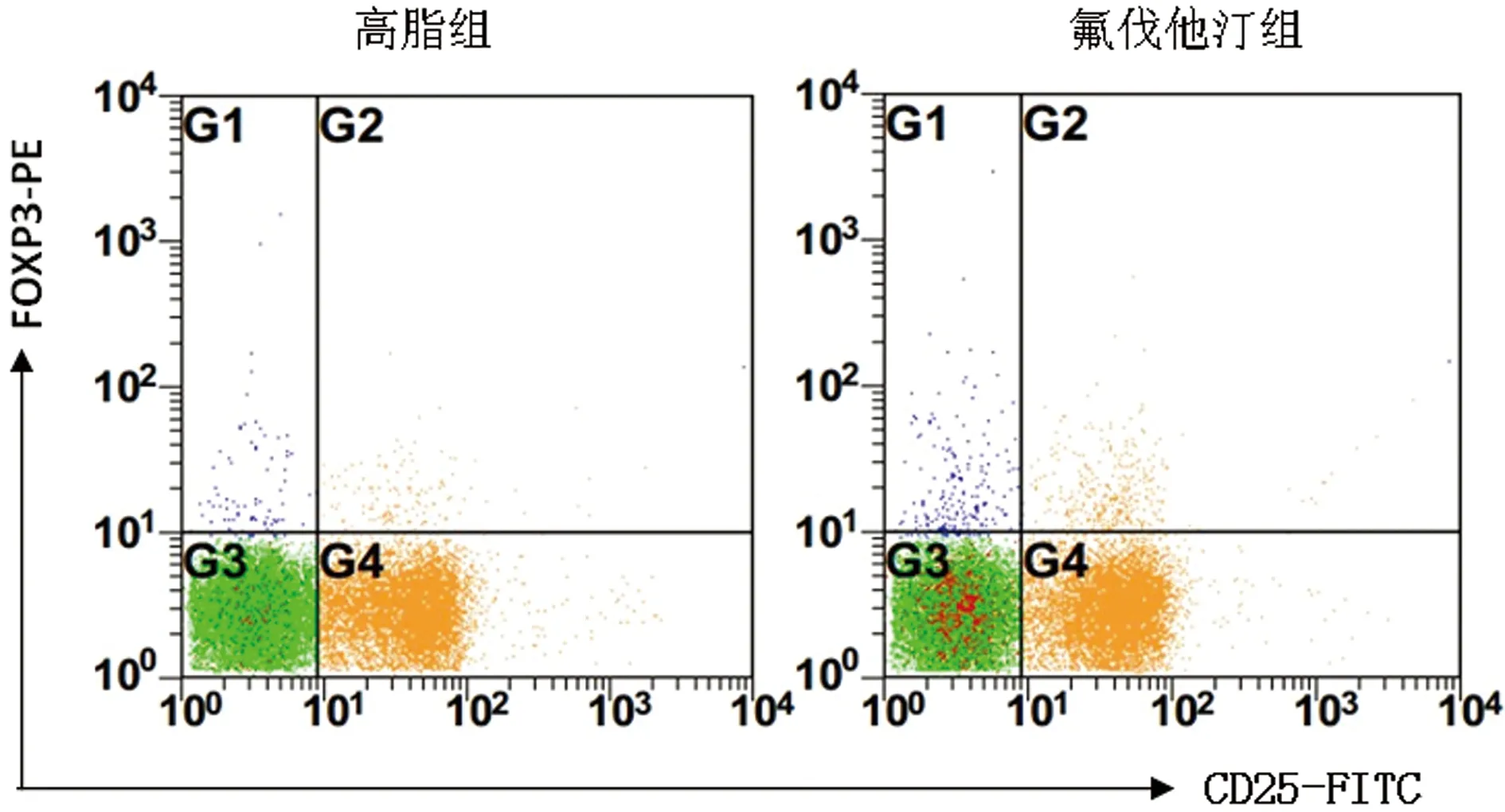
图3 流式细胞术检测高脂组与氟伐他汀组CD4+CD25+FoxP3+Treg占CD4+T细胞的比例

表4 DC细胞与Treg细胞水平对比及相关性分析
3 讨 论
动脉粥样硬化目前被认为是一种慢性免疫炎症性疾病,在病变过程中发现有T淋巴细胞、树突状细胞、巨噬细胞等多种免疫细胞参与其中。研究发现在正常动脉管壁内膜下及外膜处定居着一定数量的树突状细胞,这部分细胞被称为血管树突状细胞(VDCs),现有研究表明广泛分布在动脉血管内膜并表达HLA-DR的VDCs有可能在维持血管内环境的平衡中起着重要作用[2-3]。在高血脂、高血压等危险因素条件下,血管内皮细胞因血流条件的改变而发生功能变化,从而促使了正常内皮组织发生炎症反应,使得这些损伤的内皮组织区域优先获得大量的树突状细胞和巨噬细胞的定居。大鼠DCs细胞膜表面特异性地表达CD11c分子,而研究发现在动脉粥样硬化形成的起始阶段CD11c+DCs则起着重要的积极作用[4],HLA-DR是MHC Ⅱ类分子的一种,一般在树突状细胞、B淋巴细胞、单核细胞、巨噬细胞中表达,在成熟树突状细胞表面HLA-DR能明显上调。动脉粥样硬化是由脂质类物质调控的疾病,正常情况下DCs首先摄取内膜和循环血中的脂质,通过迁移机制输送至外周淋巴结,经过对抗原的加工后提呈给T淋巴细胞发生特异性免疫反应,而在长期的高血脂环境作用下,血管内皮损伤后脂质不断在血管壁滞留,特别是氧化的低密度脂蛋白(ox-LDL)能影响树突状细胞迁移至外周淋巴结[5],并逐渐打破血管内环境的稳态,促进动脉粥样硬化形成。本实验通过流式细胞术检测了AS大鼠主动脉壁粥样斑块病变内DCs表面分子CD11c、HLA-DR数量的变化,研究结果显示主动脉粥样斑块内CD11c+及CD11c+HLA-DR+双阳性分子数量较正常动脉血管壁明显增加,提示DCs向炎性斑块内迁移并且在斑块病变中大量聚集和定居并诱导成熟,使DCs摄取相关免疫抗原并激活、扩增T淋巴细胞而发生免疫应答。
调节性T细胞在动脉粥样硬化的进展中同样发挥着重要作用,Veillard等[6]将ApoE--/CXCR3--小鼠与ApoE-小鼠模型进行比较,发现动脉粥样斑块形成减少但病变组织内Treg的数量却明显增加,提示Treg在动脉粥样硬化早期发挥着重要作用。Maganto-Garcia等[7]研究也发现在动脉粥样硬化形成早期斑块内Treg数量是增加的,Treg会逐渐向斑块病变组织内迁移,但在长期高血脂环境下Treg迁移至动脉粥样病变部位的能力会大大下降,动脉粥样硬化进展的后期粥样斑块内Treg的数量也会明显减少。本实验研究发现CD4+CD25+FoxP3+Treg在高脂组及氟伐他汀组均有不同程度表达,提示CD4+CD25+FoxP3+Treg参与了动脉粥样硬化的形成过程,并发挥了积极的免疫调节作用。Liu等[8]研究发现淋巴器官Treg数量的减少可以促使DCs的分化与扩增,而机制是通过依赖增强的Flt3受体信号转导完成的。本研究在对DCs与Treg的相关性分析中,高脂组动脉粥样斑块中DCs细胞的数量与Treg细胞呈明显负相关,Treg含量表达越少而DCs的表达越多,提示在高血脂环境下,病变组织中Treg数量的减少可能弱化了对DCs的抑制作用从而增加了DCs的数量,从另一个角度说明Treg在参与动脉粥样硬化形成的过程中很可能通过抑制了DCs的成熟分化来发挥免疫调节功能。
他汀类药物目前已成为治疗心血管疾病的基石,也是构成动脉粥样硬化二级预防的基础之一[9]。研究证实,他汀类药物能抑制血管内炎症及稳定动脉粥样硬化斑块等功能[10-11]。Maganto-Garcia等[7]对Treg相关研究中认为逆转高脂血症能增加Treg对病变组织的迁移,并能大大增加斑块内Treg的数量。而本研究发现大鼠病变组织中经过氟伐他汀的药物干预后Treg数量较高脂组明显增加,而DCs的数量较高脂组却明显减少了。提示氟伐他汀的稳定斑块、抗炎机制是通过多种途径来实现的,其中包括增加Treg细胞数量、促进Treg的免疫抑制功能,以及减少DCs的数量、抑制其分化成熟来达到抗动脉粥样硬化的目的。另外,在对DCs与Treg的相关性分析中发现氟伐他汀组中DCs细胞的数量与Treg细胞也呈明显负相关,也提示氟伐他汀很可能增强了Treg的免疫调节功能来抑制DCs的成熟与分化,但具体机制仍需进一步研究。
动脉粥样硬化的发展始终伴随着DCs、Treg及效应T淋巴细胞三者之间免疫平衡的破坏过程。在长期高血脂环境下,大量的ox-LDL作为抗原被DC摄取并由DC模式识别受体(PRR)通过细胞信号转导触发炎症反应[12-13],促使树突状细胞的成熟和细胞因子的合成,包括上调细胞表面MHC-Ⅱ复合分子以及共同刺激分子CD40、CD80、CD86的表达,从而激活Th1、Th2、Th17淋巴细胞,同时Treg通过分泌TGF-β、IL-10等细胞因子来抑制效应T淋巴细胞的免疫反应[14]。随着动脉管壁内环境的不断紊乱,最终打破了效应T淋巴细胞与Treg之间的免疫平衡,促进效应T淋巴细胞的扩增而导致了动脉粥样硬化的发生[15]。他汀类药物能够纠正粥样斑块组织内免疫平衡紊乱,逆转Treg与DCs、效应T淋巴细胞间的比例失衡,从而达到抑制斑块内免疫反应、稳定斑块的目的。关于DCs、Treg在动脉粥样硬化过程中的作用及与效应T淋巴细胞之间的关系还有许多问题需要深入研究,并为临床中他汀类药物的作用靶点提供新的思路。
[1]Ait-Oufella H,Salomon BL,Potteaux S,et al.Natural regulatory T cells control the development of atherosclerosis in mice[J].Nat Med,2006,12(2):178-180.
[2]Bobryshev YV,Moisenovich MM,Pustovalova OL,et al.Widespread distribution of HLA-DR-expressing cells in macroscopically undiseased intima of the human aorta:a possible role insurveillance and maintenance of vascular homeostasis[J].Immunobiology,2012,217(5):558-568.
[3]Wick G,Knoflach M,Xu QB.Autoimmune and inflammatory mechanisms in atherosclerosis[J].Annu Rev Immunol,2004,22(19):361-403.
[4]Jongstra-Bilen J,Haidari M,Zhu SN,et al.Low-grade chronic inflammation in regions of the normal mouse arterial intima predisposed to atherosclerosis[J].J Exp Med,2006,203(9):2073-2083.
[5]Llodra J,Angeli V,Liu J,et al.Emigration of monocyte-derived cells from atherosclerotic lesions characterizes regressive,but not progressive,plaques[J].Proc Natl Acad Sci USA,2004,101(32):11779-11784.
[6]Veillard NR,Steffens S,Pelli G,et al.Differential influence of chemokine receptors CCR2 and CXCR3 in development of at herosclerosis in vivo[J].Circulation,2005,112(6):870-878.
[7]Maganto-Garcia E,Tarrio ML,Grabie N,et al.Dynamic changes in regulatory T cells are linked to levels of diet-induced hypercholesterolemia[J].Circulation,2011,124(2):185-195.
[8]Liu K,Victora GD,Schwickert TA,et al.In vivo analysis of dendritic cell development and homeostasis[J].Science,2009,324(5925):392-397.
[9]Maria B,Piotr K,Mike S,et al.Effectiveness of lipid-lowering therapy with statins for secondary prevention of atherosclerosis-guidelines vs.Reality[J].Pharmacological Reports,2012,64(12):377-385.
[10]Greenwood J,Steinman L,Zamvil SS.Statin therapy and autoimmune disease:from protein prenylation to immunomodulation[J].Nat Rev Immunol,2006,6(5):358-370.
[11]Rasmussen LM,Hansen PR,Nabipour MT,et al.Diverse effects of inhibition of 3-hydroxy-3-methylglutaryl-CoA reductase on the expression of VCAM-1 and E-selectin in endothelial cells[J].Biochem J,2001,360(Pt 2):363-370.
[12]Tabas I,Williams KJ,Borén J.Subendothelial lipoprotein retention as the initiating process in atherosclerosis:update and therapeutic implications[J].Circulation,2007,116(16):1832-1844.
[13]Hansson GK,Hermansson A.The immune system in atherosclerosis[J].Nat Immunol,2011,12(3):204-212.
[14]Kim JM,Rasmussen JP,Rudensky AY.Regulatory T cells prevent catastrophic autoimmunity throughout the lifespan of mice[J].Nat Immunol,2007,8(2):191-197.
[15]Mallat Z,Tedgui A.Immunomodulation to combat atherosclerosis:the potential role of immune regulatory cells[J].Expert Opin Biol Ther,2004,4(9):1387-1393.
The effects of fluvastatin on dendritic cells and regulatory T cells in experimental atherosclerosis rat model*
NiuChuan1,WangQing2△
(1.DepartmentofCardiology,WeifangMedicalCollege,Weifang,Shandong261053,China; 2.DepartmentofCardiology,QianfoshanHospital,Jinan,Shandong250014,China)
Objective To establish experimental atherosclerosis (AS) rat model,and to investigate the effects of fluvastatin on dendritic cells(DCs) and regulatory T cells in the model.MethodsThirty male Wistar rats were divided into 3 groups:control group(fed with normal diet),high-fat diet group(fed with AS feed),fluvastatin group(fed AS diet plus fluvastatin 0.1 g·kg-1·d-1).For all the 3 groups,the samples of aorta were obtained after 20 weeks.The flow cytometry was used to detect the immune-phenotypic expression of DCs(CD11c,HLA-DR) and CD4+CD25+FoxP3+regulatory T cells.Results(1)The numbers of CD11c+and CD11c+HLA-DR+double positive cells were significantly increased in the high-fat and fluvastatin group compared with the control group(P<0.01),while fluvastatin treatment reduced the CD11c+and CD11c+HLA-DR+ expression of DCs significantly(P<0.01).(2)the numbers of CD4+CD25+and CD4+CD25+FoxP3+regulatory T cells were higher significantly in fluvastatin group than the high-fat group(P<0.01).No CD4+CD25+and CD4+CD25+FoxP3+regulatory T cells was detected in control group.(3)Correlation analysis between CD11c+HLA-DR+DCs and CD4+CD25+FoxP3+Treg showed that,there was a negative correlation in high-fat diet group and fluvastain group.ConclusionFluvastatin could regulate immune-phenotypic expression of DCs(CD11c,HLA-DR) and numbers of CD4+CD25+FoxP3+regulatory T cells,which shows a new immune regulating mechanism of statins for its anti-atherosclerotic effect.
atherosclerosis;dendrtic cells;regulatory T cell;fluvastatin;immunoregulation
10.3969/j.issn.1671-8348.2015.35.006
山东省自然科学基金资助项目(2007ZRB14126)。
:牛川(1982-),医师,硕士,主要从事临床心血管内科研究。△
,Tel:13791120930;E-mail:nrz20110530@163.com。
R541.4
A
1671-8348(2015)35-4913-04
2015-05-08
2015-07-23)

