Wnt/β-连环蛋白信号通路在诱导气道平滑肌细胞外基质蛋白沉积中的作用*
霍雅婷,程远雄△,赖文岩,蔡开灿
(南方医科大学南方医院:1.呼吸科;2.心血管内科;3.心胸外科,广州 510515)
·论 著·
Wnt/β-连环蛋白信号通路在诱导气道平滑肌细胞外基质蛋白沉积中的作用*
霍雅婷1,程远雄1△,赖文岩2,蔡开灿3
(南方医科大学南方医院:1.呼吸科;2.心血管内科;3.心胸外科,广州 510515)
目的 探讨Wnt/β-连环蛋白信号通路在TGF-β1诱导人气道平滑肌细胞(HASMC)细胞外基质(ECM)蛋白沉积中的作用。方法将原代培养的HASMC用于实验。用Western blot的方法来分析蛋白表达量,用实时荧光定量PCR的方法来分析ECM蛋白的基因表达。结果用TGF-β1刺激体外培养的HASMC,可以引起胶原蛋白Ⅰα1(P<0.01)及ECM蛋白mRNA(包括胶原蛋白Ⅰα1、纤连蛋白、多功能蛋白聚糖、层粘连蛋白α2及核心蛋白多糖)表达增加(P<0.01)。TGF-β1可以引起β-连环蛋白(P<0.05)及其mRNA表达显著增加(P<0.01)。TGF-β1通过抑制糖原合酶激酶3(GSK3)β活化(P<0.01)而引起非磷酸化的β-连环蛋白表达增加(P<0.01)。此外,用Wnt信号通路药理学抑制剂PKF115-584可以明显抑制TGF-β1诱导的胶原蛋白Ⅰα1(P<0.01)及ECM蛋白(包括胶原蛋白Ⅰα1、纤连蛋白及多功能蛋白聚糖)的基因表达(P<0.01)。结论HASMC中Wnt/β-连环蛋白信号通路的活化,参与了TGF-β1诱导的ECM蛋白沉积。
肌细胞,平滑肌;细胞外基质;转化生长因子β1;β-连环蛋白
气道重塑是支气管哮喘的病理特征之一,是导致哮喘气道高反应性和气流受限的关键因素,彻底控制或延缓气道重塑,对哮喘尤其是难治性哮喘的治疗及改善预后有重要意义[1]。有文献报道气道平滑肌细胞(ASMC)可通过细胞增殖、释放多种炎症介质、生长因子及细胞外基质(ECM)蛋白参与气道重塑[2]。而Thomson等[3]认为,由ASMC分泌的ECM蛋白占气道重塑组分的50%之多,是气道重塑的关键因素。因此,研究气道平滑肌细胞分泌ECM蛋白的机制,对控制气道重塑具有十分重要的意义。转化生长因子β(TGF-β)可以刺激肺脏中的结构细胞和炎性细胞产生ECM,参与气道重塑[4]。β-连环蛋白是Wnt/β-连环蛋白信号通路中的核心蛋白,它参与调节成纤维细胞中纤连蛋白[5]及血管平滑肌细胞中多功能蛋白聚糖等ECM蛋白的基因转录。然而,β-连环蛋白在ASMC分泌ECM蛋白中的作用研究尚少。因此,本文探讨β-连环蛋白在气道平滑肌细胞分泌ECM蛋白中的作用,为治疗气道重塑寻找新的治疗靶点。
1 材料与方法
1.1 材料 优级胎牛血清(Gibco公司)、DMEM(Hyclone公司)、胰蛋白酶(Hyclone公司);TGF-β1(Prospec公司)、PKF115-184(Tocris公司);BCA100蛋白定量分析试剂盒和全蛋白提取试剂盒(上海碧云天生物技术研究所);总RNA提取试剂(Trizol公司)、逆转录试剂盒(TOYOBO公司)SYBR®Premix Ex TaqTM、PrimeScript®RTreagentKit(TOYOBO公司);小鼠抗平滑肌肌动蛋白(α-SMA,上海碧云天生物技术研究所)、小鼠抗β-actin(北京中杉金桥生物科技有限公司)、小鼠抗GAPDH抗体(北京博奥森生物技术有限公司)、兔抗β-连环蛋白抗体(Millipore公司)、小鼠抗非磷酸化β-连环蛋白抗体(Millipore公司),兔抗糖原合酶激酶3(GSK3)α+β抗体(Abcam公司)、兔抗磷酸化GSK3β抗体(Abcam公司)、兔抗胶原蛋白Ⅰα1抗体(北京博奥森生物技术有限公司)、山羊抗兔、小鼠IgG-HRP二抗(杭州弗德生物技术有限公司)、FITC-山羊抗小鼠(北京中杉金桥生物科技有限公司);DAPI(广州威佳科技有限公司);ECL化学发光染色液(杭州弗德生物技术有限公司)。
1.2 方法
1.2.1 原代HASMC的培养与鉴定 采用组织块贴壁法原代培养HASMC。经患者家属同意,取南方医院胸外科肺叶切除术手术标本,无菌条件下分离叶、段支气管中膜平滑肌层,剪成约1 mm3大小贴于培养瓶底,加入含20%胎牛血清的DMEM,置于37 ℃、5% CO2孵箱中培养。待细胞从组织块周围爬出并生长融合,传代,用含10%胎牛血清的DMEM培养,取第2~6代对数生长期细胞用于实验研究。用细胞免疫荧光α-SMA特异性染色对细胞进行鉴定。
1.2.2 qRT-PCR检测mRNA表达量 细胞培养结束后,采取Trizol一步法提取细胞总RNA,再经试剂盒逆转录为cDNA,以GAPDH为内参,实时荧光定量检测基因相对表达量。各基因的基因库编号及上下游引物序列如下:
β-连环蛋白(NM_001904):5′-CCC ACT AAT GTC CAG CGT TT-3′,5′-AAT CCA CTG GTG AAC CAA GC-3′;
胶原蛋白Ⅰ(NM_000088):5′-AGC CAG CAG ATC GAG AAC AT-3′,5′-TCT TGT CCT TGG GGT TCT TG-3′;
纤连蛋白(NM_212482):5′-TCG AGG AGG AAA TTC CAA TG-3′,5′-ACA CAC GTG CAC CTC ATC AT-3′;
层粘连蛋白α2(NM_000426):5′-GCC TTC TTC TCG GTG ACT TG-3′,5′-CCC TCT GCC AGC TGA ATA AG-3′;
多功能蛋白聚糖(NM_004385):5′-GGG AAC CTG GTG AAG AAA CA-3′,5′-CTT CCA CAG TGG GTG GTC TT-3′;
核心蛋白多糖(NM_001920):5′-AAT TGA AAA TGG GGC TTT CC-3′,5′-GCC ATT GTC AAC AGC AGA GA-3′;
GAPDH(NM_002046):5′-GCA CCG TCA AGG CTG AGA A-3′,5′-TGG TGA AGA CGC CAG TGG A-3′。
逆转录反应条件为:37 ℃变性15 min,98 ℃退火5 min,逆转录为cDNA。于罗氏480定量PCR仪行标准两步法PCR反应,第一阶段:95 ℃预变性30 s;第二阶段:95 ℃变性5 s,60 ℃退火及延伸30 s;重复40个循环,冷却40 ℃,30 s。反应结束后观察融解曲线、扩增曲线,以2-△△CT值表示各组目的基因相对表达水平。
1.2.3 Western blot检测蛋白水平变化 细胞培养结束后,按全蛋白提取试剂盒说明书程序操作:细胞经预冷的PBS液洗2次,快速加入蛋白裂解液,冰上充分裂解后,收集细胞,转移至EP管,4 ℃ 12 000 g离心20 min。吸取上清液,BCA法测定蛋白浓度。与5×loading buffer按4∶1体积比混匀,煮沸变性7 min。取20 μg总蛋白以10%聚丙烯酰胺凝胶电泳,湿转蛋白质至PVDF膜,室温下5% BSA封闭2 h后,分别加入兔抗β-连环蛋白(1∶5 000稀释)、GSK3(α+β)(1∶1 000稀释),磷酸化GSK3β(1∶500稀释)、胶原蛋白Ⅰα1(1∶500稀释),小鼠抗非磷酸化β-连环蛋白(1∶1 000稀释)、β-actin(1∶1 000稀释)、GAPDH(1∶1 000稀释)一抗,4 ℃孵育过夜。漂洗3次后加入山羊抗兔、鼠IgG-HRP二抗(1∶5 000稀释),室温孵育1 h,漂洗3次后,ECL化学发光法显示结果。用ImageJ2x图像分析软件分析条带灰度值,以目的蛋白与β-actin或GAPDH条带灰度值之比表示相应蛋白表达水平;p-GSK3β与GSK3(α+β)条带灰度值之比表示GSK3β磷酸化水平。
1.3 统计学处理 采用SPSS13.0软件进行分析处理,多组比较采用单向方差分析,先进行方差齐性检验,方差齐,选用LSD即最小差异法;若方差不齐,采用校正的F检验(Welch法),并选用DunnettT3做多重比较。以P<0.05为差异有统计学意义。
2 结 果
2.1 原代HASMC培养与鉴定 光学显微镜下,HASMC呈长梭形,卵圆形胞核位于中央,生长融合后呈典型峰谷征;α-SMA免疫荧光染色阳性,鉴定为平滑肌细胞,见图1。
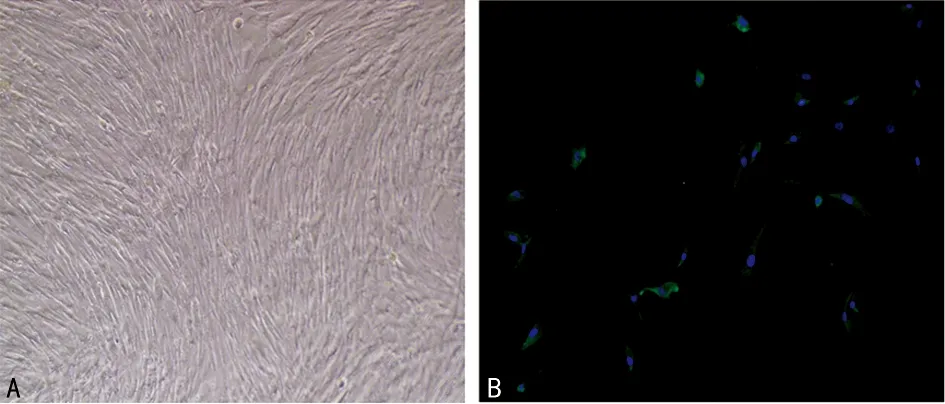
A:普通光可见“峰谷征”;B:免疫荧光染色可见α-SMA为荧光。
图1 原代培养的HASMC形态及表型鉴定(×100)
2.2 TGF-β1引起β-连环蛋白表达上调 用递增浓度的TGF-β1(0.1~10.0 ng/mL)刺激HASMC 24 h,不同浓度的TGF-β1均能引起β-连环蛋白表达增加,对照组、0.1 ng/mL组、1.0 ng/mL组、10.0 ng/mL组的蛋白相对表达量分别为0.287 7±0.035 0、0.455 8±0.250 3、0.444 4±0.288 0、0.471 6±0.423 5,且与对照组比较差异均有统计学意义(P<0.05);选取2.0 ng/mL作为刺激浓度,TGF-β1组β-连环蛋白表达量较对照组显著增加(P<0.05);TGF-β1也可引起β-连环蛋白mRNA表达增加(P<0.001)。
2.3 TGF-β1引起GSK3β磷酸化 用TGF-β1(2.0 ng/mL)刺激细胞不同时间(0~2 h),P-GSK3β蛋白表达量在15~60 min范围内明显增加(P<0.01),说明TGF-β1在早期即可引起GSK3β磷酸化,见图2。
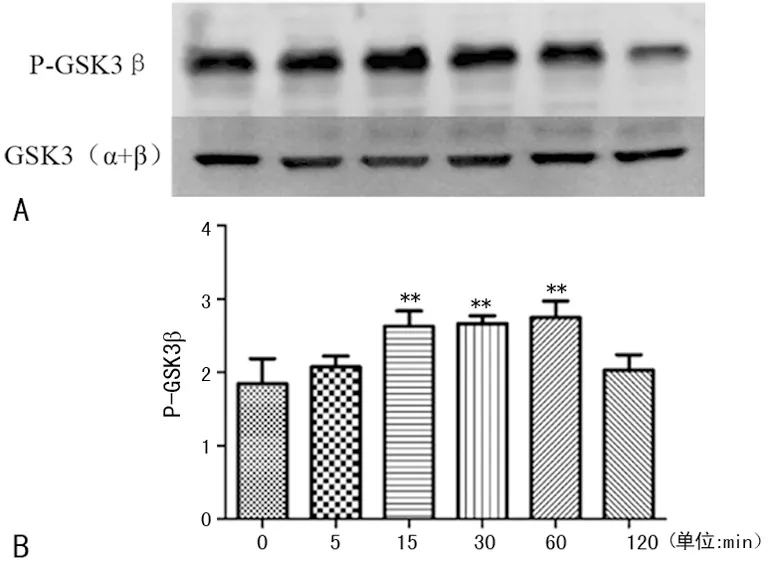
**:P<0.01,与0 min比较。
图2 不同时间GSK-3β蛋白磷酸化水平的改变
2.4 TGF-β1导致非磷酸化β-连环蛋白表达增加 用TGF-β1(2.0 ng/mL)刺激细胞不同时间(0~24 h),非磷酸化β-连环蛋白表达量在2~16 h范围内增加,且在16 h时达到最大(P<0.01),说明TGF-β1可以引起非磷酸化(活化的)β-连环蛋白表达增加,见图3。
2.5 β-连环蛋白信号通路在TGF-β1诱导ECM基因表达中的作用 用TGF-β1(2 ng/mL)刺激细胞24 h,层粘连蛋白α2、多功能蛋白聚糖mRNA表达增加(P<0.01),胶原蛋白Ⅰα1、纤连蛋白mRNA表达增加(P<0.01),而核心蛋白多糖mRNA表达减少(P<0.01),见图4A。用药理学抑制剂PKF115-584(100 nM)干预后,有效抑制了胶原蛋白Ⅰα1、纤连蛋白、多功能蛋白聚糖mRNA的表达(P<0.01),见图4B。
2.6 β-连环蛋白信号通路在胶原蛋白表达中的作用 用TGF-β1(2 ng/mL)刺激HASMC,胶原蛋白Ⅰα1表达量增加(P<0.01),再用药理学抑制剂PKF115-584(100 nM)干预细胞,胶原蛋白Ⅰα1表达量明显减少(P<0.01),见图5。
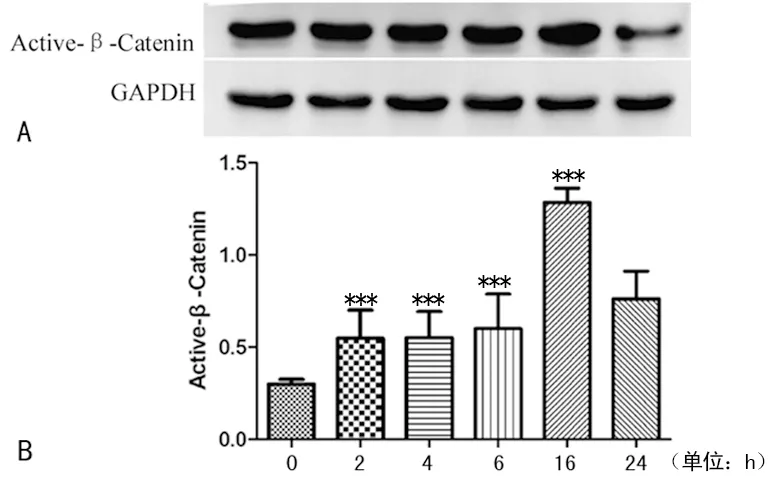
***:P<0.01,与0 h比较。
图3 非磷酸化β-连环蛋白表达水平
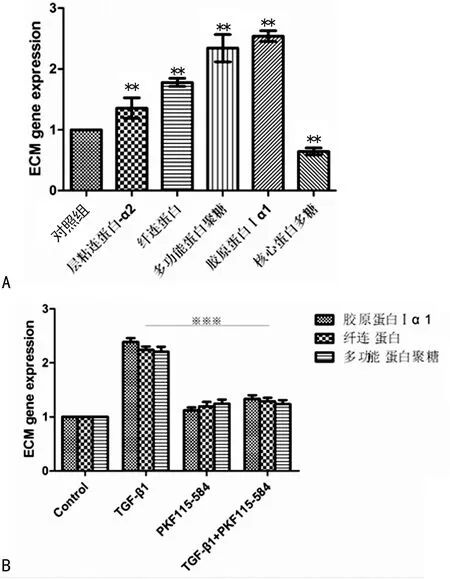
**:P<0.01,与对照组比较;※※※:P<0.01,(TGF-β1+PKF115-584)组与TGF-β1组比较。
图4 β-连环蛋白信号通路在ECM基因表达中的作用
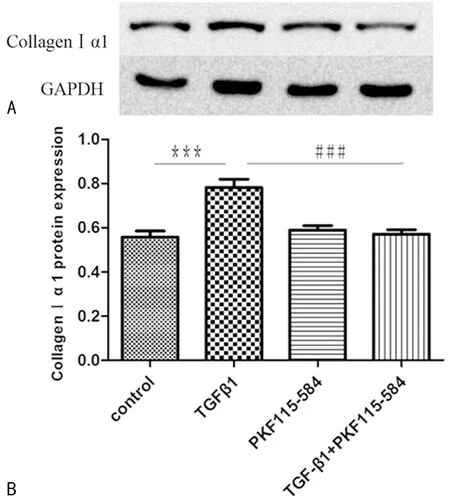
***:P<0.01,与对照组比较;###:P<0.01,(TGF-β1+PKF115-584)组与TGF-β1组比较。
图5 PKF115-584对TGF-β1引起的胶原蛋白Ⅰα1表达的抑制作用
3 讨 论
TGF-β是一种多功能细胞因子,在哮喘患者气道中表达上调,并能刺激肺脏中多种结构细胞和炎性细胞产生大量ECM蛋白[6]。ECM是一种具有复杂结构的大分子物质,发挥机械支撑作用,以维持气道的正常功能。但在哮喘患者气道平滑肌层中ECM蛋白表达异常增多[7],增多的胶原蛋白Ⅰα1和纤连蛋白可以促进ASMC增殖、迁移[6],促使气道重塑的发生、发展。
β-连环蛋白是Armadillo蛋白家族中的一员,与细胞粘合连接处的钙粘蛋白/连环蛋白复合物相关,发挥稳定细胞-细胞接触的作用[8]。同时,β-连环蛋白在经典的Wnt/β-连环蛋白信号通路中调节T细胞因子/淋巴增强因子(TCF/LEF)介导的基因转录[9]。既往对Wnt通路的研究主要集中在肿瘤的发生上,近年来有研究发现Wnt/β-连环蛋白信号通路还与某些增生性疾病有关,如特发性肺纤维化等[10]。目前还认为β-连环蛋白可能在哮喘气道重塑过程中起重要作用[11]。有文献报道β-连环蛋白通过稳定细胞间的接触而调节ASMC的主动张力[12],还可以促进ASMC增殖[13],但在分泌ECM蛋白中的作用尚缺乏详细研究。
本研究发现2.0 ng/mL为TGF-β1的有效刺激浓度,用此浓度的TGF-β1刺激HASMC,可引起β-连环蛋白在细胞质中表达上调,且β-连环蛋白mRNA表达增加,说明β-连环蛋白的再合成也受到TGF-β1的调控。同样浓度的TGF-β1也可诱导多种ECM蛋白的mRNA转录增强(层粘连蛋白α2、多功能蛋白聚糖、胶原蛋白Ⅰα1、纤连蛋白等),其中以胶原蛋白Ⅰα1 mRNA表达增加最为明显,故在后续实验中,可将胶原蛋白Ⅰα1作为ECM蛋白的代表。有文献认为细胞质中β-连环蛋白水平是由GSK3严格调控的[14]。在本实验中,TGF-β1引起GSK3β持续而强烈的磷酸化,继而活化的(非磷酸化)β-连环蛋白表达增加,与文献报道相符。Wnt信号通路药理学抑制剂PKF115-584主要破坏细胞核中活化的β-连环蛋白与TCF-4之间的相互作用,进而抑制包括ECM蛋白在内的靶基因转录[15]。本研究用100 nM浓度的PKF115-584对细胞进行干预,结果发现胶原蛋白Ⅰα1、纤连蛋白、多功能蛋白聚糖mRNA及胶原蛋白Ⅰα1蛋白表达均受到抑制,表明阻止β-连环蛋白与细胞核中转录因子的相互作用可以有效抑制ECM蛋白的表达增加。
综上所述,经典的Wnt/β-连环蛋白信号通路是TGF-β1诱导HASMC分泌ECM蛋白中的关键途径,阻断该通路可显著减少ECM表达。
目前,吸入糖皮质激素是治疗哮喘的主要方法,但这只能控制哮喘症状,却不能充分抑制ECM蛋白表达导致的气道重塑。因此,抑制β-连环蛋白的活化及其与细胞核内转录因子LEF/TCF复合物的结合,可能成为治疗哮喘气道重塑的新靶点。
[1]牛毅,程远雄,李宁,等.ERK信号通路在血管紧张素Ⅱ诱导的人气道平滑肌细胞增殖中的作用[J].广东医学,2013,34(3):352-355.
[2]Lazaar AL,Panettieri RA.Airway smooth muscle:a modulator of airway remodeling in asthma[J].J Allergy Clin Immunol,2005,116(3):488-495.
[3]Thomson RJ,Bramley AM,Schellenberg RR.Airway muscle stereology:implications for increased shortening in asthma[J].Am J Respir Crit Care Med,1996,154(3 Pt 1):749-757.
[4]Duvernelle C,Freund V,Frossard N.Transforming growth factor-beta and its role in asthma[J].Pulm Pharmacol Ther,2003,16(4):181-196.
[5]Gradl D,Kühl M,Wedlich D.The Wnt/Wg signal transducer beta-catenin controls fibronectin expression[J].Mol Cell Biol,1999,19(8):5576-5587.
[6]De Boer WI,Van Schadewijk A,Sont JK,et al.Transforming growth factor beta1 and recruitment of macrophages and mast cells in airways in chronic obstructive pulmonary disease[J].Am J Respir Crit Care Med,1998,158(6):1951-1957.
[7]Prakash YS.Airway smooth muscle in airway reactivity and remodeling:what have we learned?[J].Am J Physiol Lung Cell Mol Physiol,2013,305(12):L912-933.
[8]Clevers H.Wnt/β-Catenin signaling in development and disease[J].Cell,2006,127(3):469-480.
[9]Thompson B,Townsley F,Rosin-Arbesfeld R,et al.A new nuclear component of the Wnt signalling pathway[J].Nat Cell Biol,2002,4(5):367-373.
[10]Chilosi M,Poletti V,Zamò A,et al.Aberrant Wnt/beta-catenin pathway activation in idiopathic pulmonary fibrosis[J].Am J Pathol,2003,162(5):1495-1502.
[11]Kumawat K,Koopmans T,Gosens R.β-catenin as a regulator and therapeutic target for asthmatic airway remodeling[J].Expert Opin Ther Targets,2014,18(9):1023-1034.
[12]Jansen SR,Van Ziel AM,Baarsma HA,et al.β-Catenin regulates airway smooth muscle contraction[J].Am J Physiol Lung Cell Mol Physiol,2010,299(2):L204-214.
[13]Gosens R,Baarsma HA,Heijink IH,et al.De novo synthesis of beta-catenin via H-Ras and MEK regulates airway smooth muscle growth[J].FASEB J,2010,24(3):757-768.
[14]Jope RS,Yuskaitis CJ,Beurel E.Glycogen synthase kinase-3 (GSK3):inflammation,diseases,and therapeutics[J].Neurochem Res,2007,32(4/5):577-595.
[15]Baarsma HA,Menzen MH,Halayko AJ,et al.β-Catenin signaling is required for TGF-β1-induced extracellular matrix production by airway smooth muscle cells[J].Am J Physiol Lung Cell Mol Physiol,2011,301(6):L956-965.
Effect of β-Catenin signaling pathway on extra cellular matrix deposition by using airway smooth muscle cells induction*
HuoYating1,ChengYuanxiong1△,LaiWenyan2,CaiKaican3
(1.DepartmentofRespiratory;2.DepartmentofCardiology;3.DepartmentofThoracicCardiovascularSurgery,NanfangHospital,SouthernMedicalUniversity,Guangzhou,Guangdong510515,China)
Objective To investigate the effect of Wnt/β-Catenin signaling pathway on EMC(extra cellular matrix) deposition by HASMC(human airway smooth muscle cells) in response to TGF-β1.MethodsThe primary cultured human bronchial smooth muscle cells were applied in this experiment.Protein expression was analyzed by Western blot and gene expression of ECM was evaluated by real-time fluorescent quantitative PCR.ResultsHASMC,cultured in vitro,by the stimulation of TGF-β1,can increase the expression of collagen I α1(P<0.01) and ECM protein mRNA(including collagen Iα1,fibronectin,versican,laminnα2 and decorin) (P<0.01).Meanwhile,TGF-β1 can cause an increase of nonphosphorylated β-Catenin protein expression and it′s mRNA(P<0.01) by inhibited the activation of glycogen synthase kinase 3(GSK3)β(P<0.01),but not induced the increase of phosphorylated β-Catenin(P<0.01).Besides,Wnt sigals pharmacology inhibitors PKF 115-584 can inhibit the gene expression of TGF-β1 induced collagen I α1(P<0.01) and ECM protein(including collagen I α1,fibronection,and versican) (P<0.01).ConclusionThe activation of Wnt/β-Catenin signaling pathway in HASMC(human airway smooth muscle cells),which involving the deposition of TFGβ1 induced ECM protein .
mgocytes,smooth muscle;extra cellular matrix;transforming growth factor β1;β-Catenin
10.3969/j.issn.1671-8348.2015.35.001
广东省自然科学基金资助项目(s2012010009036);南方医院院长基金资助项目(2014A001)。
:霍雅婷(1988-),在读硕士,主要从事哮喘气道重塑研究。△
,Tel:(020)61641572;E-mail:drchengyx@126.com。
R562.25
A
1671-8348(2015)35-4897-03
2015-05-08
2015-07-11)

