miRNA-29a对平滑肌细胞增殖凋亡的影响
冯洪涛,李红普
(河南郑州市人民医院普外二科 450000)
论著·基础研究
miRNA-29a对平滑肌细胞增殖凋亡的影响
冯洪涛,李红普△
(河南郑州市人民医院普外二科 450000)
目的 检测miRNA-29a在腹主动脉瘤患者与正常人血清中的表达差异,探讨miRNA-29a过表达对人腹主动脉平滑肌细胞(HVSMCs)增殖凋亡的影响。方法收集该院2011年3月至2014年3月间确诊腹主动脉瘤患者血清标本25例,平均年龄(62.9±13.6)岁;同期收集与其年龄相匹配的正常老年人血清标本25例,平均年龄(61.5±11.8)岁。用RT-PCR分别检测其miRNA-29a表达。构建人重组慢病毒载体MCS-CMV-miRNA;将构建载体MCS-CMV-miRNA-29a转染HVSMCs细胞,荧光显微镜下观察其转染效率,RT-PCR及Western blot法检测转染后各组细胞中miRNA-29a和miRNA-29a靶基因COL1A1的表达,最后应用Annexin V/7-AAD双染法检测转染后72 h对HVSMCs细胞凋亡的影响。结果在腹主动脉瘤患者中miRNA-29a表达较正常人低。构建的重组慢病毒载体MCS-CMV-miRNA-29a转染效率为(74.25±10.10)%,转染后miRNA-29a及蛋白表达在靶细胞较对照组增多,MTS及Annexin V显示miRNA-29a过表达后细胞增殖增多,凋亡减少。结论成功构建携带miRNA-29a慢病毒载体,转染后miRNA-29a稳定表达,miRNA-29a过表达可促进细胞增殖,抑制其凋亡。
主动脉瘤,腹;miRNA-29a;慢病毒载体;肌细胞,平滑肌
腹主动脉瘤(abdominal aortic aneurysm,AAA)是指由于腹主动脉壁的病变或损失,造成腹主动脉的局限性扩张、膨出,以搏动性肿块为主要症状的疾病。通常将腹主动脉段动脉壁三层结构持续性扩张至肾动脉处腹主动脉直径1.5倍以上即定义为AAA,是一种常见的高病死率动脉退行性疾病[1-2]。目前,对于腹主动脉瘤具体发病机制尚不完全清楚,已有的报道显示其发病与遗传因素、炎症、蛋白酶降解、平滑肌细胞凋亡等因素密切相关,其发病与其他肿瘤因化学辐射、基因突变等不同。人腹主动脉平滑肌细胞(HVSMCs)作为腹主动脉中膜的主要构成成分,对维持动脉壁结构和功能的完整性起到重要作用。近年来,一些报道显示腹主动脉瘤组织中VSMC数量的减少是其形成过程中一个关键因素[3]。如何有效抑制VSMC的凋亡有望为延缓AAA的形成、发展提供新的治疗思路。
微小RNA(micro RNA,miRNA)是在真核生物中发现的一类内源性的具有调控功能的非编码RNA。研究表明miRNA参与各种生理、病理调节途径,包括发育、造血过程、器官形成、细胞增殖凋亡,以及脂肪代谢等[4-5]。MiRNA-29a在各种实质肿瘤细胞中表达增高,具有显著的促增殖、抗凋亡的作用。同时,其在血管中层平滑肌细胞中表达丰度较高,通过促进新生内膜形成帮助损伤血管修复[6]。且miRNA在恶劣的条件下仍保持稳定,这使得通过检测循环血中的miRNA作为疾病标志物成为近年来的一个研究热点。
MiRNA-29家族的成熟序列在人、大鼠、小鼠中几乎是相同的。目前在人类中发现miRNA-29的靶基因数量最多,主要有COL1A1、COL1A2、MMP2等。其中,靶基因COL1A1与成骨不全及肝癌的形成有关。本研究旨在首先探讨miRNA-29a在腹主动脉瘤患者和正常人血清中的表达差异;其次用慢病毒构建miRNA-29a过表达模型,初步探究miRNA-29a对VSMC细胞增殖凋亡的影响,意在为今后临床AAA的防治工作找到新的靶点。
1 材料与方法
1.1 主要材料 构建慢病毒的主要载体系统由如下3个部分组成:Helper1.0载体,pHelper2.0载体及MCS-CMV载体(上海吉凯,中国);大肠埃希菌DH5α,293T细胞本室保存;人主动脉血管平滑肌细胞(美国ScienCell公司,No.6110)。
1.2 主要试剂 Lipofectamine 2000(Invitrogen公司,美国);Plasmid抽提Kit(Qiagen公司,美国);淋巴细胞分离液(天津灏洋,中国);DMEM、胎牛血清、胰蛋白酶(GIBOCO公司,美国);Taq polymerase、Primer、dNTP(TaKaRa公司,日本);COL1A1小鼠抗人抗体、山羊抗小鼠二抗(Abcam公司,美国);琼脂糖(赛百盛公司,中国);MTS(Promega公司,美国)。
1.3 方法
1.3.1 资料收集 收集2011年3月至2014年3月间本院门诊及住院AAA患者血清25例,其中,男16例,女9例,年龄49~81岁,平均(62.9±13.6)岁;同期收集本院体检中心正常老年人血清25例,其中,男15例,女10例,年龄55~85岁,平均(61.5±11.8)岁。
1.3.2 血清中miRNA-29a的RT-PCR检测 用淋巴细胞分离液提取分离淋巴细胞,收集完全血清层,按照说明要求常规提取RNA,并逆转录为cDNA。每孔RT-PCR反应体系为25 μL,所加试剂分别如下:SYBR Premix EX Taq Ⅱa(12.5 μL),primer(10 μmol/L×1 μL),DNA(50 ng/μL×2 μL),ddH2O(8.5 μL),结果经ABI PRISM 7500系统分析。miRNA-29a引物F:5′-ACC TGT CAC TGT CTT GTA CCC TTG T-3′,R:5′-CGG CGT TTG GAG TGG TAG AA-3′。RT-PCR反应条件为97 ℃预变性5 min,97 ℃ 1 min变性,60 ℃ 30 s退火,72 ℃ 30 s,共循环30次,后72 ℃延伸7 min,所得结果经2-ΔΔCT计算得出目的RNA的相对含量(relative quantity,RQ)。
1.3.3 慢病毒MCS-CMV-miRNA-29a载体构建及病毒包装 miRNA-29a基因由PCR进行扩增,反应条件如下:95 ℃预变性5 min,95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,共循环30次,最后72 ℃延伸10 min。将目的基因克隆到慢病毒MCS-CMV Vector中,所用引物上游序列为:5′-CAA AAC CCC CAC CAA GTC TAT GGA A-3′,下游序列:5′-TAA AGT ATA ACC ATT CAT GA-3′。LB培养液扩增转化菌DH5α,Plasmid抽提盒提取MCS-CMV-miRNA-29a,包装质粒pHelper1.0、pHelper2.0 DNA。根据Invitrogen公司Lipofectamine 2000说明书将构建质粒MCS-CMV-miRNA-29a及慢病毒包装pHelper1.0、pHelper2.0共转染293T细胞,荧光显微镜下观察细胞荧光融合现象,收集含慢病毒颗粒的细胞上清液,-80 ℃保存,RT-PCR检测病毒滴度。
1.3.4 细胞培养 将在干冰保存中的原代细胞悬液常规解冻、复苏。以1×105细胞密度培养于含10%胎牛血清DMEM培养基中,置于细胞培养箱中,以37 ℃、5% CO2条件下培养,相差倒置显微镜下观察,融合率在90%左右时胰酶消化法传代培养,采用对数生长期细胞进行实验。
1.3.5 慢病毒细胞转染 以每孔4×104细胞数接种于6孔板中,按照说明以感染复数(MOI值)100进行转染。分MCS-CMV-miRNA-29a(转染组),MCS-CMV-EGFP(阴性对照组),以及不加病毒的空白对照组。转染第4天后荧光显微镜下进行观察,以评估转染效率。
1.3.6 半定量RT-PCR 半定量RT-PCR与前述RT-PCR步骤相似,最后将cDNA在3%的琼脂糖凝胶中行电泳,结果用Quantity one软件分析。miRNA-29a引物F:5′-ACC TGT CAC TGT CTT GTA CCC TTG T-3′,R:5′-CGG CGT TTG GAG TGG TAG AA-3′。反应条件如下:97 ℃预变性5 min,97 ℃ 1 min变性,56 ℃ 30 s退火,72 ℃延伸30 s,共循环30次,后72 ℃延伸7min。
1.3.7 Western-blot检测蛋白 每组细胞经处理后常规提取蛋白,BCA法测定蛋白浓度。每组50 μg体系下行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,PVDF膜转膜,5%脱脂牛奶封闭2 h。按1∶1 000比例稀释的一抗,在4 ℃下孵育过夜。次日用TBST洗涤,15 min/次×3次,4 ℃孵育COL1A1抗体(1∶1 000稀释)过夜,TBST缓冲液洗膜,37 ℃下山羊抗小鼠二抗孵育1 h,再用TBST洗膜。最后ECL显影,bio-rad凝胶成像仪拍照分析。
1.3.8 MTS法检测细胞增殖 取对数期细胞接种于96孔板中。每孔约6×103个细胞,实验组分为miRNA-29a转染组、阴性对照组、空白对照组共3组,每组设立4个平行复孔。分别在24、48、72 h后加入MTS试剂20 μL/孔,37 ℃的5% CO2饱和湿度孵箱中静置1 h,酶调仪在490 nm的波长下读取OD值,各平行孔取平均值。实验独立重复3次。
1.3.9 Annexin V/7-AAD检测细胞凋亡 各组处理后的细胞分别换用无血清的DMEM培养基培养,以诱导凋亡。72 h后胰酶消化收集细胞,用PBS洗2遍,按照说明分析加入Binding Buffer(200 μL)、Annexin V-PE(10 μL)和7-AAD(5 μL)避光孵育15 min,最后加入300 μL ending Buffer,上机检测细胞凋亡的变化。

2 结 果
2.1 RT-PCR检测miRNA-29a的表达 经RT-PCR检测结果得出miRNA-29a表达在AAA中比正常人低,差异有统计学意义(P<0.01),见图1。

图1 RT-PCR检测AAA与正常人miRNA-29a的表达
2.2 miRNA-29a重组慢病毒载体在腹主动脉瘤细胞中的绿色荧光蛋白表达及转染效率的检测 将MCS-CMV-miRNA-29a质粒转染入人腹主动脉瘤细胞,在荧光显微镜下观察荧光表达情况(图2)。取3个视野下平均转染效率达(74.25±10.01)%,说明构建的慢病毒载体高效转染人腹主动脉瘤细胞。
2.3 RT-PCR结果显示miRNA-29a表达增高 在慢病毒MCS-CMV-miRNA-29a载体转染腹主动脉瘤细胞第4天后,miRNA-29a表达明显高于阴性对照组和空白对照组,差异有统计学意义(P<0.05),如图3。

图2 慢病毒转染后VSMC荧光检测
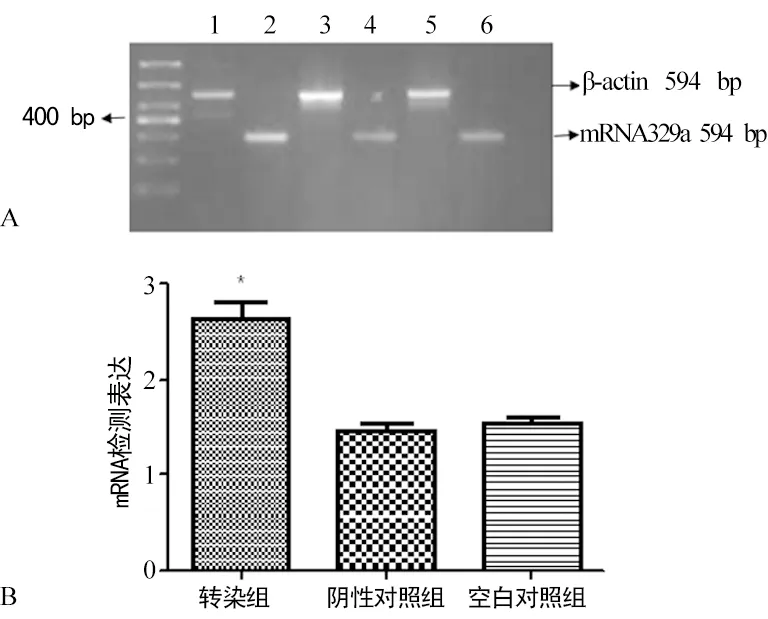
1、3、5:β-actin;2:转染组;4:阴性对照组;6:空白对照组。
图3 RT-PCR检测转染后miRNA-29a的表达
2.4 Western-blot检测miRNA-29a靶基因蛋白稳定表达 转染后miRNA-29a靶基因COL1A1蛋白表达量明显较其他实验组增高,差异有统计学意义(P<0.05),见图4。

1:转染组;2:阴性对照组;3:空白对照组。
图4 Western-blot检测MCS-CMV-miRNA-29a转染AAA-SMC细胞后第4天miRNA-29a靶基因蛋白表达
2.5 miRNA-29a对人AAA-SMC细胞增殖的影响 各组细胞在处理24、48、72 h后,MTS检测结果显示不同时间点miRNA-29a转染组的OD值明显高于其他两组,miRNA-29a转染组与其他两组间经单因素方差分析差异有统计学意义(P<0.05),说明miRNA-29a过表达能够有效促进VSMC的增殖。而阴性对照组及空白对照组间OD值比较差异无统计学意义(P>0.05)。

表1 MTS检测各组HVSMCs增殖率的改变(OD值)
2.6 Annexin V/7-AAD检测各组细胞凋亡情况 各组细胞无血清培养基饥饿刺激72 h后,流式细胞仪检测细胞凋亡率显示miRNA-29a转染组细胞凋亡率较其他两组明显减低,差异有统计学意义(P<0.05)。而阴性对照组及空白对照组间细胞凋亡率比较差异无统计学意义(P>0.05)。

表2 Annexin V/7-AAD检测各组细胞凋亡的影响(%)
3 讨 论
多数AAA是无症状的,早期的发现经常伴有一些偶然因素,如其他原因行腹部B超、CT或磁共振成像(MRI)检查时被发现。但AAA一旦发生破裂导致破裂性腹主动脉瘤(rupture abdominal aortic aneurysm,rAAA)则是临床上病死率最高的并发症之一,通常因为发病迅猛,不能及时得到救治。流行病学调查显示,大约4%~5%美国人的猝死源于rAAA[7]。由此可见,AAA的早期筛查和预防其进一步发展在临床实践中有着重要作用。
miRNA是一类单链小分子RNA,通过与靶基因的3′-UTR端结合配对,在转录水平对靶基因进行表达调控,从而参与了细胞的增殖、突变及细胞凋亡等生理病理过程[8]。Redova等[9]首先报道证实了人体外周血中存在大量miRNA,且其以一种非常稳定的形式存在于人体循环血中。因此,将血清中miRNA作为疾病标志物的研究成为近年来的热点。Jones等[10]研究发现胸主动脉瘤组织中包括miRNA-29a在内的miRNAs的表达水平降低,且与主动脉瘤的直径呈负相关。本研究通过对比AAA患者及正常人群血清中miRNA-29a的表达差异发现,前者miRNA-29a的表达显著低于正常组(P<0.05)。这一发现为miRNA-29a成为AAA的血清标志物奠定了基础,同时也为研究其在AAA发病过程中发挥的作用提供了可能。
主动脉平滑肌细胞(VSMCs)是腹主动脉中层的主要细胞,直接或间接地分泌弹力蛋白、胶原蛋白及其他基质蛋白主动脉壁最重要的结构成分,对动脉弹力板层的构建和修复起重要作用。Rowe等[11]比较了正常、粥样硬化和AAA主动脉中VSMCs的凋亡情况,结果显示在AAA组织中细胞凋亡的数量是其他两组的3倍以上,差异有统计学意义。由此可见,VSMCs增殖抑制、凋亡增加是AAA发生、发展的一个重要原因。因此,本研究以HVSMCs为研究对象,意在探讨miRNA-29a对于其体外培养环境中增殖、凋亡的影响。
慢病毒作为一种基因调控的载体,能高效、稳定地转染细胞,且其本身的转染对细胞生物学行为影响较小,这种方法已被广泛用于科研中[12]。本研究结果显示,慢病毒为载体的转染效率(74.25±10.10)%,功能学检测显示,miRNA-29a的mRNA及其靶基因蛋白COL1A1表达均在转染组显著升高,证实慢病毒对VSMCs有着较高的转染效率。
细胞的正常增殖、凋亡平衡对维持器官内环境的稳定有着至关重要的作用,其细胞的恶性增殖或凋亡受到抑制被认为是肿瘤发生的重要机制,因此,调控细胞增殖及凋亡成为研究肿瘤发病机制及治疗的有效方法。在骨肉瘤和肾纤维化的研究中,miRNA-29a对平滑肌细胞的增殖、凋亡有着明显的调控作用[13-14],但其对HVSMCs增殖、凋亡影响还未见报道。通过MTS结果显示miRNA-29a过表达的HVSMCs在不同时间点的OD值均明显高于其他两组(P<0.05),而空病毒转染组与空白对照组间的OD值比较差异无统计学意义。这一结果说明病毒本身的转染并不影响细胞的增殖,而miRNA-29a能够有效促进HVSMCs细胞的增殖。另一方面,流式细胞检测结果显示miRNA-29a过表达能够有效地保护无血清培养所诱导的细胞凋亡,与其他两组比较,miRNA-29a转染组细胞的凋亡率显著下降(P<0.05)。
综上所述,本研究显示在AAA患者血清中miRNA-29a的表达较正常人显著降低,miRNA-29a低表达与AAA的发生有着密切关系。所构建的miRNA-29a过表达慢病毒载体能有效提高HVMSCs中miRNA-29a的表达水平,通过对非编码RNA及其靶基因的增加血管平滑肌细胞的增殖,同时抑制其凋亡,为研究AAA的发病机制及治疗方法开拓了新思路及新方法。
[1]Coughlin PA,Jackson D,White AD,et al.Meta-analysis of prospective trials determining the short-and mid-term effect of elective open and endovascular repair of abdominal aortic aneurysms on quality of Life[J].Br J Surg,2013,100(4):448-455.
[2]Wang XL,Thompson MM,Dole WP,et al.Standardization of outcome measures in clinical trials of pharmacological treatment for abdominal aortic aneurysm[J].Expert Rev Cardiovasc Ther,2012,10(10):1251-1260.
[3]Charchian ER,Stepanenko AB,Gens AP,et al.Clinical management of patients with abdominal aortic aneurysms combined with coronary artery disease and multifocal atherosclerosis[J].Kardiologiia,2014,54(3):37-41.
[4]Rico-Rosillo MG,Vega-Robledo GB,Oliva-Rico D.The role and importance of the microRNAs in the diagnosis and development of diseases[J].Revista Medica Del Instituto Mexicano Del Seguro Social,2014,52(3):302-307.
[5]Fic P,Kowalczuk K,Grabarska A,et al.MicroRNA--a new diagnostic tool in coronary artery disease and myocardial infarction[J].Postepy Hig Med Dosw (Online),2014,68:410-418.
[6]Jiang H,Zhang G,Wu JH,et al.Diverse roles of miR-29 in cancer(review)[J].Oncol Rep,2014,31(4):1509-1516.
[7]Kent KC.Clinical practice.Abdominal aortic aneurysms[J].N Engl J Med,2014,371(22):2101-2108.
[8]Liu H,Wang B,Lin J,et al.microRNA-29b:an emerging player in human cancer[J].Asian Pac J Cancer Prev,2014,15(21):9059-9064.
[9]Redova M,Sana J,Slaby O.Circulating miRNAs as new blood-based biomarkers for solid cancers[J].Future Oncol,2013,9(3):387-402.
[10]Jones JA,Stroud RE,O′quinn EC,et al.Selective microRNA suppression in human thoracic aneurysms:relationship of miR-29a to aortic size and proteolytic induction[J].Circ Cardiovasc Genet,2011,4(6):605-613.
[11]Rowe VL,Stevens SL,Reddick TT,et al.Vascular smooth muscle cell apoptosis in aneurysmal,occlusive,and normal human aortas[J].J Vasc Surg,2000,31(3):567-576.
[12]Lei CJ,Yao C,Pan QY,et al.Lentivirus vectors construction of SiRNA targeting interference GPC3 gene and its biological effects on liver cancer cell lines Huh-7[J].Asian Pac J Trop Med,2014,7(10):780-786.
[13]Muniyappa MK,Dowling P,Henry M,et al.MiRNA-29a regulates the expression of numerous proteins and reduces the invasiveness and proliferation of human carcinoma cell lines[J].Eur J Cancer,2009,45(17):3104-3118.
[14]Zhang W,Qian JX,Yi HL,et al.The microRNA-29 plays a central role in osteosarcoma pathogenesis and progression[J].Mol Biol (Mosk),2012,46(4):622-627.
The effect of miRNA-29a on the proliferation and apoptosis of HVSMCs cells
FengHongtao,LiHongpu△
(TheSecondDepartmentofGeneralSurgery,ZhengzhouPeople′sHospital,Zhengzhou,Henan450000,China)
Objective To detect the expression of miRNA-29a in abdominal aortic aneurysm(AAA) patients and construct a recombinant lentiviral vector carrying miRNA-29a,transfection of human abdominal aortic vascular smooth muscle cells(HVSMCs),and to investigate the alteration on the proliferation in HVSMCs.MethodsCollected 25 AAA patients′ serum and 25 normal elderly serum specimens from March 2011 to March 2014,the mean age were 62.9±13.6 and 61.5±11.8 separately.Employ RT-PCR analysis the miRNA-29 expression in different group.The MCS-CMV-miRNA-29a was transfected into HVSMCs cells,the transfection efficiency was observed with fluorescence microscope,the mRNA and COL1A1 protein expresstion was detected by RT-PCR and Western blot respectively.MTS method was used to determine effects of cell inhibition rates of different groups,cell apoptosis was analysised by Annexin V/7-AAD double staining after 72 h.ResultsThe expression of miRNA-29a with AAA was lower than normal group.The transfection efficiency was (74.25±10.10)%.miRNA-29a mRNA and its target protein COL1A1 expression increased significantly compared with the control group after transfection,MTS and Annexin V/7-AAD results showed that cell apoptosis was decreased after miRNA-29a overexpression,cell proliferation was increased compared with the control group.ConclusionThe miRNA-29 expression decreased associated with the occurrence of abdominal aortic aneurysm,but overexpress miRNA-29a in HVSMC cells by lentivirus mediated,which could promote the proliferation of cells,inhibit its apoptosis.
aortic aneurysm,abdominal;miRNA-29a;lentiviral vector;mgocgtes,smooth muscle
10.3969/j.issn.1671-8348.2015.35.009
冯洪涛(1973-),医师,硕士,主要从事周围血管外科研究。△
,Tel:13937122886;E-mail:lihongpu371@126.com。
R654.4
A
1671-8348(2015)35-4925-04
2015-05-26
2015-07-16)

