磁性碳纳米管载附5 -FU 对胃癌淋巴结转移模型抑制作用研究
金彦召 曹家庆 胡小云 毛盛勋 沈 威 贾惊宇 李正宇 辛 林
淋巴道转移是胃癌主要的转移途径,除了手术对淋巴的廓清,全身静脉化疗很难在局部淋巴结保持有效的药物浓度,治疗效果不理想。淋巴靶向化疗概念的提出,有效解决的这个难题,将化疗药物通过淋巴靶向载体在淋巴结高效浓集,保持淋巴道内有效的化疗药物浓度,杀灭癌灶,而血液内及重要脏器内药物浓度较低,减轻全身毒副作用。本研究前期将纳米级氧化铁磁性成分、多壁碳纳米管、抗肿瘤药物5 -FU 结合起来,制备成磁控靶向药物传递系统,通过体外、体内实验研究发现其对结肠癌淋巴结转移有一定抑制作用,本研究旨在进一步探讨磁性碳纳米管载附5-FU 对胃癌淋巴结转移模型抑制作用。
1 材料和方法
设计:实验性研究。
时间及地点:2013 年9 月~2015 年1 月,南昌大学第二附属医院分子中心实验室、基础医学院动物科学部。
材料:
1.1 试药与材料
磁性多壁碳纳米管(mMWNTs),北京博宇高科新材料公司;5-氟尿嘧啶(5 -FU):德国Ruibio(进口分装);pvp k30:德国BASF(进口分装);SD 大鼠;BALB/cA 裸小鼠,4 ~5 周龄,雌雄各半,体质量21.50 ~25.70 g,均购自南昌大学实验动物科学部;SGC7901 细胞株为同行转赠。
1.2 实验方法
1.2.1 载药体系的构建 mMWNTs、PVP -K30 及5 -FU,按实验要求比例加入去离子水,35℃,40kHz 超声分散4h,得到黑色稳定的磁性碳纳米管混悬液及磁性碳纳米管载附5 -氟尿嘧啶混悬液。紫外分光光度法测定载附5 -FU 剂量。
上述方法配制以下药物。
1.2.2 体外对胃癌细胞的杀伤效应 将mMWNTs(3 mg/ml)、mMWNTs-5 -FU(3 mg/ml-12 mg/ml)、5 -FU(12 mg/ml)及空白组加入进入对数生长期的胃癌SGC7901 培养基中,观察其在24 h、48 h 和48 h 对细胞的抑制率。
1.2.3 体内对淋巴结转移的抑制作用 建立裸鼠胃癌淋巴结转移模型,选取五周后左侧腘窝淋巴结直径0.5 cm 大小时备用。
淋巴结转移模型随机分为6 组,每组7 只,共42 只,A 组-生理盐水组、B 组-5 -FU 单药组、C 组-mMWNTs(3 mg/ml)空白载体组、D 组-低浓度不加磁场mMWNTs-5-FU(3 mg/ml ~12 mg/ml)组、E 组- 加磁场mMWNTs - 5 - FU(3 mg/ml ~12 mg/ml)组,均于足垫0.1 ml 剂量注射,1、7 天给药方案化疗,左下肢足垫皮下给药,化疗21 天处死裸鼠,按照公式淋巴结肿瘤和瘤体体积生长抑制率=(1 -治疗组平均体积/对照组平均体积)×100%,检测血白细胞和肌酐。1 ~8 天取腘窝淋巴结高效液相检测淋巴结5 -FU 缓慢释放情况,TUNNEL 法检测细胞凋亡率。
2 结果
2.1 mMWNTs 表征数、分散及淋巴结示踪情况
成品mMWNTs 的相关指标见下图;配置成混悬液后,室温下,分散比较均匀,呈现黑色,四周后有少许分层,轻轻震荡后后,又分散均匀,超声分散后可恢复原状,外磁场作用下有很好的磁顺应性,SD 鼠足垫注射用,各站淋巴结黑染示踪效果好。全身心、肝、肾、肺病理HE 未见碳纳米管。而且对5 -FU 有好的载附效果。
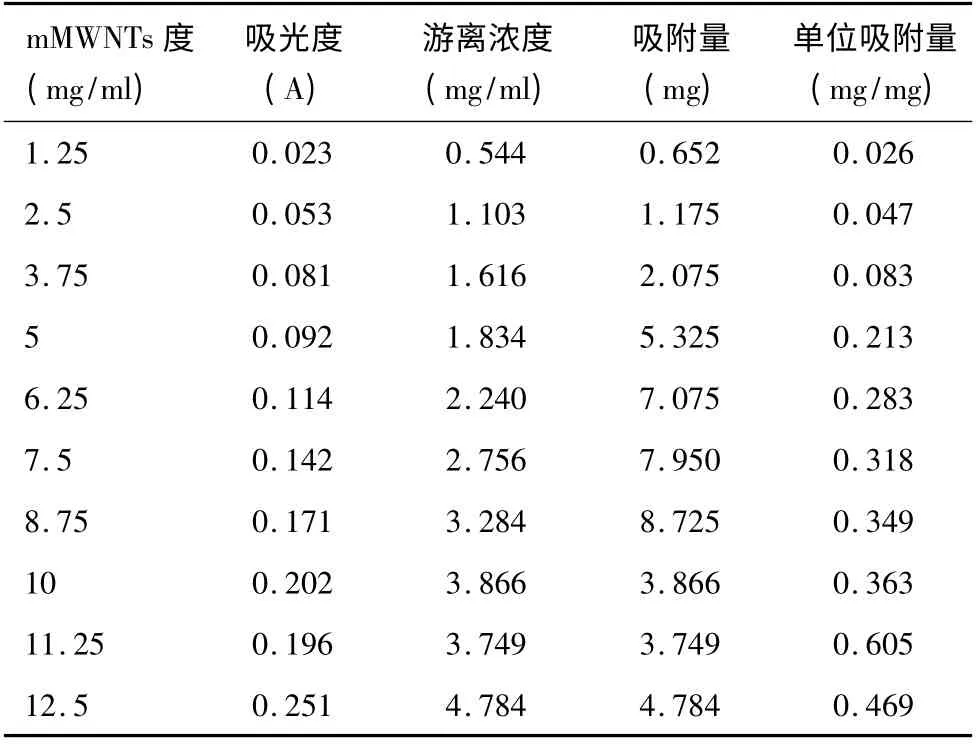
表1 紫外分光光度法测定mMWNTs 载附5 -FU 剂量

图1 mMWNTs 表征数、分散及淋巴结示踪情况
2.2 mMWNTs、mMWNTs-5-FU 对体外SW480 细胞的抑制作用
将mMWNTs(3 mg/ml)、mMWNTs - 5 - FU(3 mg/ml - 12 mg/ml)、5-FU(12 mg/ml)稀释到不同倍数,发现mMWNTs 的浓度高达3 mg/ml 与0.0003 mg/ml 时,对胃癌SGC7901 细胞的杀伤都不明显,但与含有5 -FU 的两组相比,其杀伤力明显较低,细胞抑制率明显较低(p <0.05)。含有5 -FU 两组对细胞的抑制率与5 -FU 有关,但mMWNTs-5 -FU 组杀伤效应强于5 -FU组,但无统计学差异(p >0.05)。
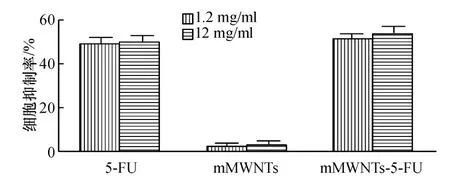
图2 各组药物对胃癌SGC7901 细胞的抑制率
2.3 mMWNTs、mMWNTs-5-FU 体内研究
裸鼠胃癌淋巴结模型成瘤率为90%,胃癌转移淋巴结经病理HE 证实,给药前及给药后三周小鼠的体重和肿瘤体积变化见表4 -1 所示,结果显示给药前和给药后各组间小鼠体重变化差异不大。C、D 及E 组与A、B 两组之间比较治疗后肿瘤体积的变化,C、D 及E 肿瘤体积明显有减小,但四组间肿瘤体积减少无明显差别。第21 天摘取左侧腘窝淋巴结,计算质量和体积抑制率,两者成线性相关,R2=0.864,B 组淋巴结质量和体积较A 组明显增高(p <0.05),E 组淋巴结质量和体积较A 组明显降低(p <0.05),与C 组比较淋巴结质量和体积也明显降低(p <0.05)。5 -FU组小鼠的白细胞低于正常范围,与D 及E 组比较差异有显著意义(p <0.05)。
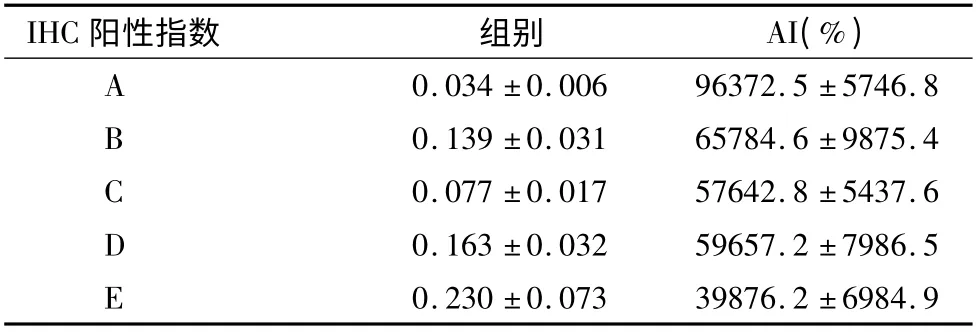
表2 各化疗组AI 及IHC 阳性指数(平均值±标准差)
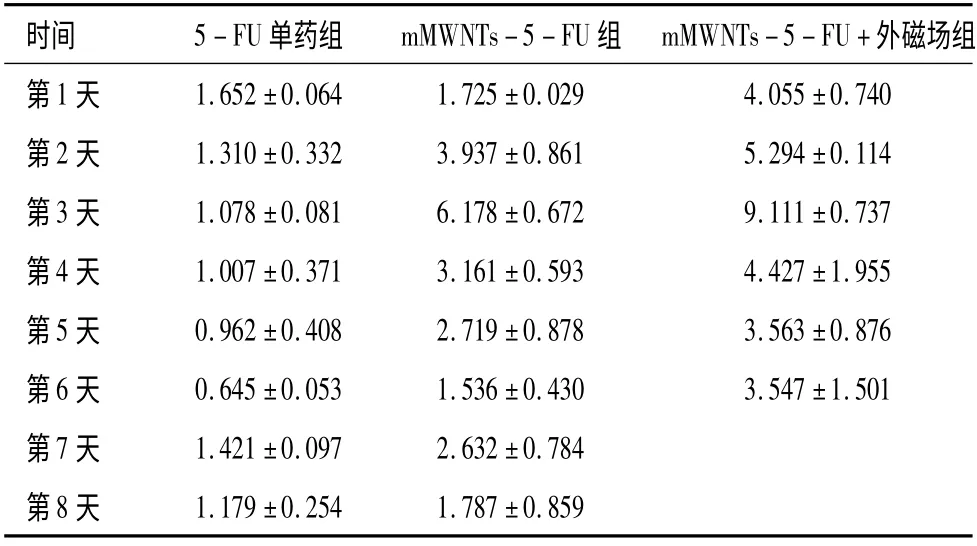
表3 淋巴结药物浓度(平均值±标准差)单位(ug/g)
3 讨论
磁性碳纳米管混悬液具有一定的稳定性,与超声震荡时间有关,4 小时为最佳时间,而且在外磁场下有很好的磁顺应性,对5-FU有很好的缓释作用。这在既往研究中[1]得以证实,混悬液注射鼠足垫后,相应三站引流淋巴结有很好的黑染示踪效果,局部皮肤不会发生红肿、溃烂及坏死等情况,碳纳米管主要经肾脏代谢,未发现重要脏器聚集及病理反应,磁性碳纳米管浓度高低对细胞的抑制无差别,而且抑制率很低,都显示磁性碳纳米管磁靶向药物载体的低毒性。行为、食欲和精神上无明显异常。说明这种载体无抗原性、对机体的刺激小和与生物体的相容性也比较好。既往LAM 等[2-3]也证明小鼠体内无明显的毒害作用。但也有研究[4-5]对其毒性尚持怀疑态度。
从体外实验结果分析,磁性多壁碳纳米管对胃癌SGC7901细胞的杀伤效应不明显,这与一些文献的报道类似[6-7]。含相同浓度载附在磁性多壁碳纳米管的5 -FU 与未载附在磁性多壁碳纳米管的5-FU 对胃癌SGC7901 细胞的杀伤效应相似,但是他们对细胞的抑制率与阿霉素的浓度呈正相关。这两者所含的5-FU旳浓度越大,其细胞的抑制率越大,这表明在体外,真正对SGC7901 细胞起杀伤作用的是5 - FU,并且与其有量效依赖关系。有学者研究提示这与磁性碳纳米管的穿透性对5 -FU 的协助作用有关[8-9]。
建立的足垫原发瘤+三站淋巴结转移模型,成瘤率90%。在此基础上研究以上靶向药物,对于治疗前后肿瘤体积的变化,C、D、E 组与A、B 组相比有统计学意义,C、D、E 组肿瘤体积减小比较明显,但这四组间肿瘤体积减少无明显差异。研究表明磁性碳纳米管可以作为淋巴靶向化疗载体,对化疗药物有相应的控释效应,对胃癌淋巴结转移有明显的抑制作用。YANG[10]和LU[11]均撰文磁性碳纳米管载附吉西他滨和阿霉素对淋巴结癌转移有抑制作用。靶向化疗后重要脏器病理HE 提示未见药物载体沉积,抽血相关检查未见异常,说明磁性多壁碳纳米管作为药物的载体可以减少化疗药物进入血液循环,从而降低全身不良反应。但也有个别持相反观点的报道毒[12-13]。透射电镜提示其能载附化疗药物进入细胞,可定位于胞浆空泡[14]。而细胞对颗粒的摄入导致细胞内活性氧的升高(Reactive Oxygen Species,ROS),进而攻击细胞膜,损伤DNA,导致细胞凋亡[15]。总之磁性碳纳米管作为新型的化疗药物载体的应用前景通过本实验得到进一步证实[16]。
[1] 金彦召,谭 敏.磁性碳纳米管载附5 -氟尿嘧啶对结肠癌淋巴结转移的靶向抑制作用[J]. 中国组织工程研究,2012,16(16):2884 -2888.
[2] LAM C W,JAMES J T,MCCLUSKEY R,et al. Pulmonary toxicity of single-wall carbon nanotubes in mice 7 and 90 days after intratracheal instillation[J],Toxicol Sci,2004,77(1):126 -134.
[3] GOODWIN S C,BITTNER C A,PETERSON C L,et al. Single -dose toxicity study of hepatic intra-arterial infusion of doxorubicin coupled to a novel magnetically targeted drug carrier[J]. Toxicol Sci,2001,60(1):177 -183.
[4] S. V. PRYLUTSKAA,I. I. GRYNYUKA,O. P. MATYSHEVSKA,et al. Estimation of multi - walled carbon nanotubes toxicity in vitro[J]. Physica E 40,2008:2565 -2569.
[5] C. CHENG,K.H. M.LLER,K.K.K. KOZIOL,et al. Toxicity and imaging of multi - walled carbon nanotubes in human macrophage cells[J]. Biomaterials 30,2009:4152 -4160.
[6] AJIMA K,YUDASAKA M,MURAKAMI T,et al. Carbon nanohorns as anticancer drug carriers[J]. Mol Pharm,2005,2(6):475 -480.
[7] SHI X,SITHARAMAN B,PHAM Q,LIANG F,WU K,EDWARD BILLUPS W,et al. Fabricationof porous ultra - short single- walled carbon nanotube nanocomposite scaffolds for bone tissueengineering[J]. Biomaterials,2007,28(28):4078 -4090.
[8] TOLIS C,PETERS GJ,FERREIRA CQ,et al. Cell cycle disturbances and apoptosis induced by topotecan and gemcitabine on human lung cancer cell lines[J]. Eur J Cancer,1999,35(5):796 -807.
[9] CUI D,TIAN F,OZKAN CS,et al. Effect of single wall carbon nanotubes on human HEK293 cells[J]. Toxicol Lett,2005,155(1):73 -85.
[10] Yang F,Jin C,Yang D,et al. Magnetic functionalised carbon nanotubes as drug vehicles for cancer lymph node metastasis treatment[J]. Eur. J. Cancer,2011,47:1873 -1882.
[11] Lu Y J,Wei K C,Ma,C.C.,Yang,S.Y.,Chen,J.P. Dual targeted delivery of doxorubicin to cancer cells using folate-conjugated magnetic multi-walled carbon nanotubes[J]. Colloids Surf,B Biointerfaces,2012,89:1 -9.
[12] Yang F,Hu J,Yang D,et al. Pilot study of targeting magnetic carbon nanotubes to lymph nodes[J].Nanomedicine (Lond),2009,4(3):317 -330.
[13] Liu Z,Davis C,Cai W,et al. Circulation and long - term fate of functionalized,biocompatible single - walled carbon nanotubes in mice probed by Raman spectroscopy[J]. Proc Natl Acad Sci USA,2008,105(5):1410 -1415.
[14] Monteiro - Riviere NA,Nemaniehb RJ,Inman AO etal.,Multi -walled Carbon Nanotube Interaetions with Human EPidermal Keratinoeytes[J].Toxicology Letters,2005,155(3):377 -384
[15] 高素莲. 功能化多壁碳纳米管的细胞毒性研究[D]. 济南:山东大学,2008:37 -56.
[16] 何 璐,周新科,刘季芳. 纳米粒子在肿瘤治疗中的应用[J].现代医院,2013(07).

