190 例药品不良反应报告分析
祁 平 ,黄 炜,尹志国(安康市中心医院药学部,陕西 安康 725000)
药品不良反应(adverse drug reaction,ADR)是指合格的药品在正常用法、用量下出现的与用药目的无关的或意外的有害反应。对ADR 进行监测、报告,可提高临床药物治疗水平,减少药源性疾病发生,对药物上市再评价等有重要作用[1]。现对安康市中心医院(以下简称“我院”)上报的ADR 报告进行统计分析,为临床合理用药提供参考。
1 资料与方法
收集我院2012 年1 月1 日—2015 年1 月21 日上报的ADR 报告190 例,对患者姓名、性别、用药的种类、给药途径、累及器官和(或)系统等信息进行统计分析,按照国家ADR 监测中心ADR 因果关系判断标准(肯定、很可能、可能、可能无关、待评价和无法评价)进行关联性评价。
2 结果
2.1 发生ADR 患者的性别与年龄分布
190 例发生ADR 的患者中,男性116 例(占61.05%),女性74 例(占38.95%),男女比例为1.6∶1.0;年龄3 个月~86 岁,中位年龄45 岁,见表1。
2.2 引发ADR 的给药途径分布
静脉给药引发的ADR 最多,为127 例(占66.84%),其次为口服给药50 例(26.32%),见表2。

表1 发生ADR 患者的年龄分布Tab 1 Distribution of age in ADR cases
表2 引发ADR 的给药途径分布
Tab 2 Distribution of route of administration in ADR cases
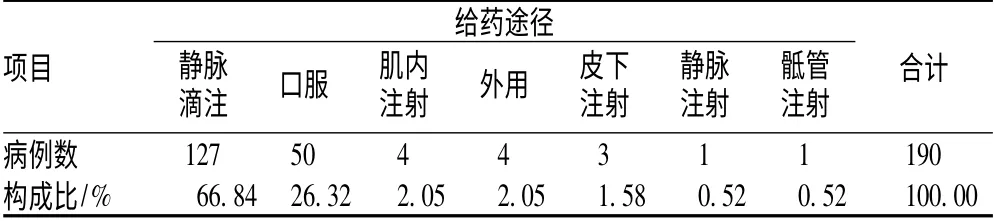
项目给药途径静脉滴注 口服 肌内注射 外用 皮下注射静脉注射骶管合计注射127 50 4 4 3 1 1 190构成比病例数/% 66.84 26.32 2.05 2.05 1.58 0.52 0.52 100.00
2.3 引发ADR 的药物种类分布
190 例ADR 共涉及15 类药物、105 个品种,其中抗感染药发生ADR 的例次数居首位,其次为中成药,见表3。
表3 引发ADR 的药物种类分布
Tab 3 Distribution of types of ADR-inducing drugs
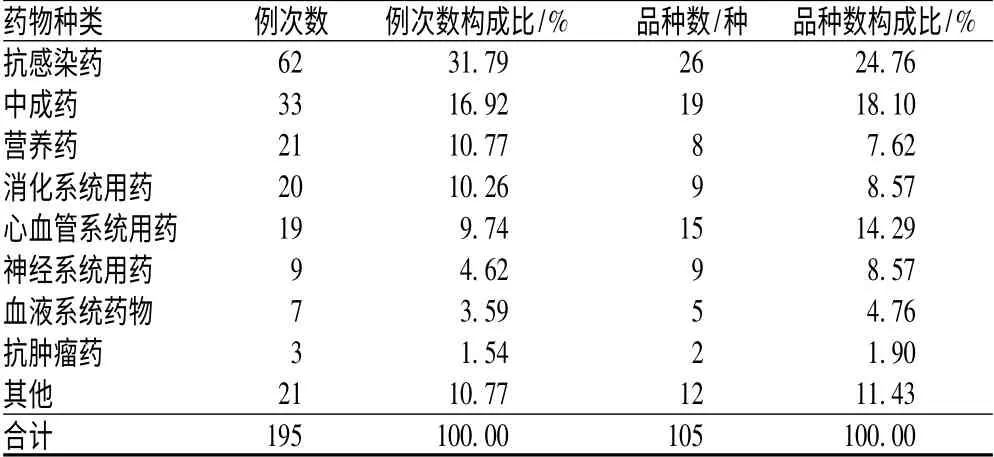
注:同一ADR 可由多种药物引起,故总例次数>190Note:The same ADR can be induced by a variety of drugs,so the total cases >190
2.4 引发ADR 的抗感染药种类分布
抗感染药引发的62 例次ADR 中,头孢菌素类、氟喹诺酮类和大环内酯类发生ADR 的例次数居前3 位,见表4。
2.5 ADR 累及器官和(或)系统及临床表现
190 例ADR 共累计器官和(或)系统255 例次,其中以皮肤及其附件损害为主(85 例次,占33.33%),临床表现多为皮疹和瘙痒;其次为消化系统损害(57 例次,占22.35%)、神经系统损害(29 例次,占11.37%),见表5。
2.6 引发严重ADR 的药品及其主要临床表现
190 例ADR中,11 例为严重的ADR。其中,抗感染药引发的严重ADR 共5 例,包括抗结核药3 例、抗病毒药1 例、抗菌药物1 例;复方氨基酸注射液(18AA-Ⅳ)、都梁软胶囊引发的严重ADR 未见文献报道,见表6。
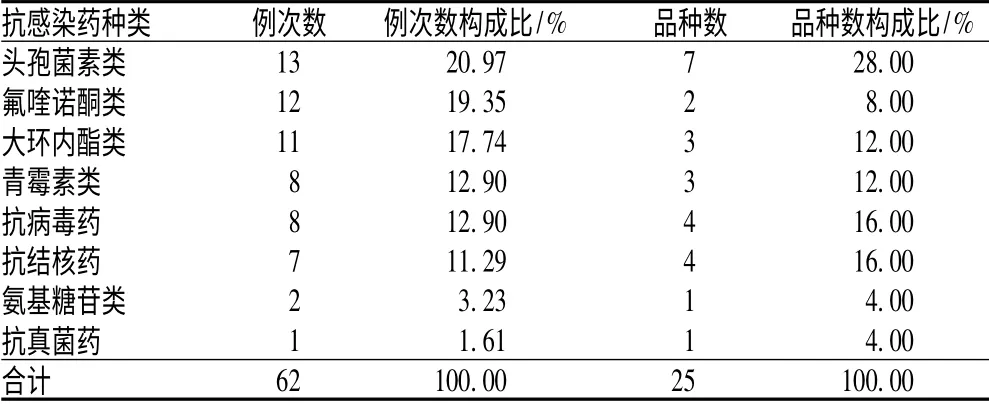
表4 引发ADR 的抗感染药种类分布Tab 4 Distribution of types of ADR-inducing antiinfectious agents
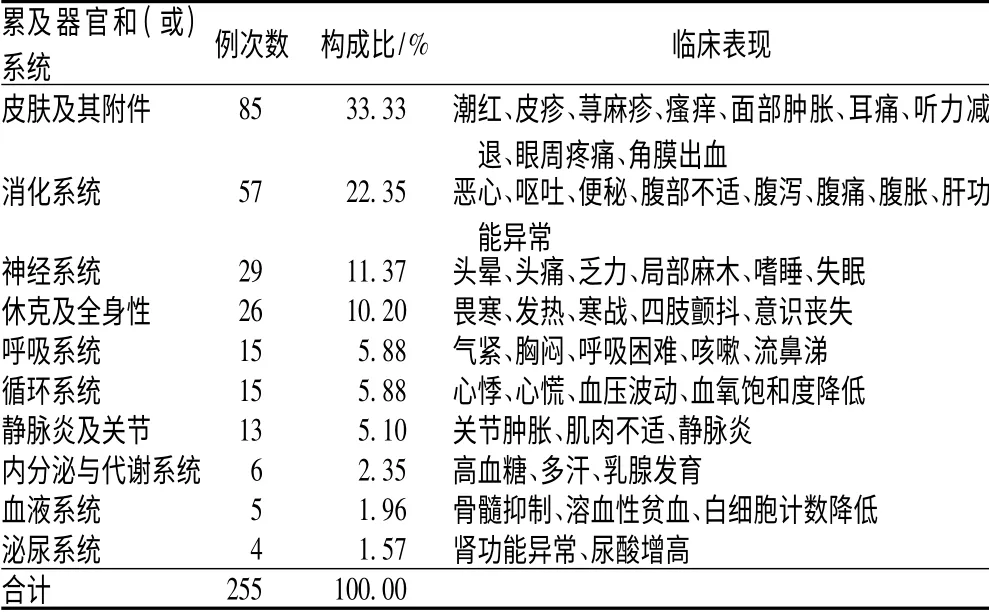
表5 ADR 累及器官和(或)系统及临床表现Tab 5 ADR-involved organs and(or)systems and clinical manifestations
2.7 ADR 的因果关系评价及转归
按ADR 因果关系对190 例ADR 进行评价,我院ADR 监测小组评价为:“肯定”95 例(占50.00%),“很可能”72 例(占37.89%),“可能”20 例(占10.53%);190 例ADR 经治疗或停药后,治愈94 例(占49.47%),好转92 例(占48.42%),结果不详1 例(占0.53%)。
3 讨论
3.1 ADR 与患者性别、年龄的关系
发生ADR的190例患者中,男女患者比例为1.6∶1.0,男性多于女性,与相关文献报道不一致[2-4]。我院ADR 高发于中老年患者,>40 岁患者占57.89%。老年人各项生理功能衰退,肝、肾等器官功能减退,药物代谢能力降低,并且可能同时患有多种疾病,使用药的种类及频率明显增加,加之药物之间的相互作用复杂,导致其ADR 发生率升高[5]。因此,应对老年人制定合理的给药方案,指导老年人科学用药,减少ADR 的发生。
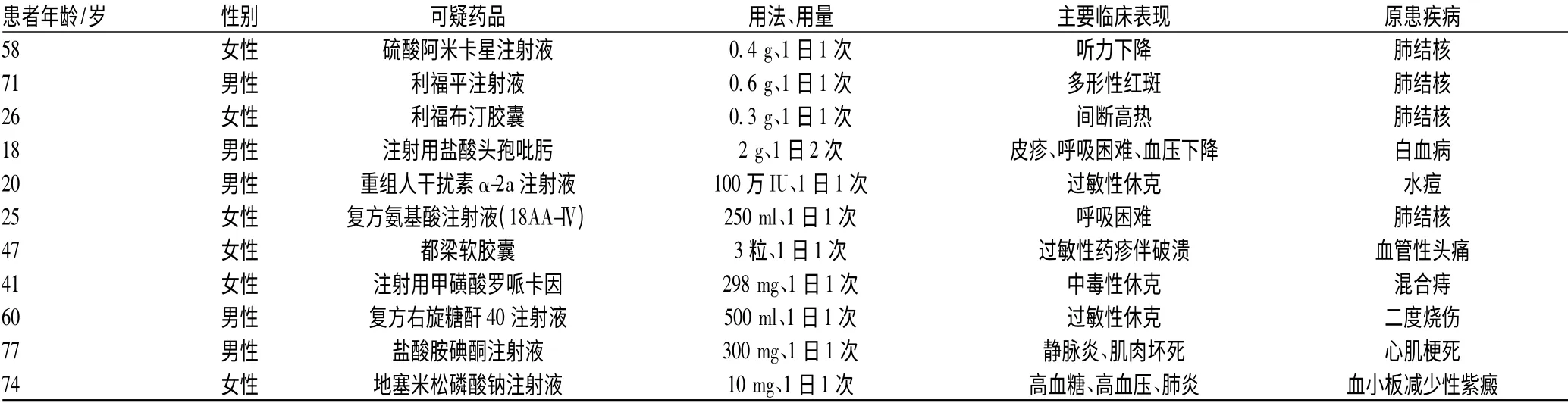
表6 引发严重ADR 的药品及其主要临床表现Tab 6 Drugs of serious ADR-inducing and the main manifestations
3.2 ADR 与给药途径的关系
190 例ADR 中,注射剂静脉滴注给药引发127 例(占66.84%),片剂、胶囊等口服给药引发50 例(占26.32%),其他给药途径引发13 例(占6.84%)。静脉给药相对于其他给药途径可能更容易发生ADR,因为静脉给药时,药物直接进入血液,避免了肝脏的首关效应,其致ADR 的发生率可能升高。另外,静脉给药,药液中存在的微粒和药液的pH 值、浓度、渗透压及稳定性等均可能诱发ADR[6]。尤其是抗菌药物注射剂及中药注射剂,其成分多为大分子或聚合物,静脉给药过程中常易引起ADR 发生[7]。因此,门诊医师应严格控制静脉给药的比例,尽可能选择安全度高的口服给药方式;同时,住院医师在用药时,也应尽量减少静脉给药。
3.3 ADR 与药物种类的关系
抗感染药致ADR 例次数居首位(62 例次,占合计195 例次的32.63%),以头孢菌素类(占20.97%)、氟喹诺酮类(占19.35%)、大环内酯类(占17.74%)为主,三者致ADR 例次数共占抗感染药致ADR 例次数的58.06%,与文献报道一致[8-9]。这3 类药物在我院的使用频率较高,不合理使用现象也较多,在一定程度上造成了ADR 的多发。中药制剂致ADR例次数仅次于抗感染药,其中又以中药注射剂所占比例较高。这与我院中药注射剂的不合理使用有关,如儿科诊断为上呼吸道感染、肺炎等疾病几乎均会使用喜炎平注射液、炎琥宁注射液等,这很容易造成适应证不适宜、给药途径不适宜或用法、用量不适宜等情况发生;再加上中药注射剂成分复杂、不同厂家制备工艺存在差异等问题,造成了其稳定性差,质量很难得到严格、有效的控制,导致其ADR 发生率较高[10-12]。临床医师应严格掌握药物的适应证、用法、用量及疗程,辨证施药;护士应严格按照规定的方法配置药品溶液,输液过程中应密切关注患者,一旦出现不良反应应及时停药、对症处理。
3.4 ADR 累及器官和(或)系统
我院ADR 以累及皮肤及附件损害为主,其次为消化系统、神经系统。原因可能是这3 类ADR 的临床表现易于患者发现并被医师诊断,而其他器官和(或)系统损害可能较为隐匿,患者及医务人员都不容易发现,导致其不良反应数量较少[13]。虽然其他系统如泌尿系统、血液系统的不良反应不易被发现,但其较容易对人体造成较为严重的后果,这值得引起临床高度关注。
3.5 严重的ADR 与抗结核药的关系
15 例严重的ADR 中,抗结核药引起5 例,占严重ADR 的33.33%。其原因包括:(1)安康市作为贫困偏远地区,结核病是高发病种,因此,抗结核药引发的ADR 病例数也较多[14];(2)我院传染病疾病科对开展ADR 工作颇为重视,故上报的ADR 报告较多,也是造成抗结核药引起的ADR 病例数偏多的原因。但是,抗结核药引起的ADR 应得到重视,临床药师应配合医师,针对不同患者制定合理的个体化给药方案,掌握合适的用药剂量,选择合理的给药方法,对于有合并症的患者注意调整其服药方法与剂量[15]。同时,应做好宣传解释工作,在患者开始治疗后的前2 个月内给予密切关注,一旦发生不良反应,及时妥善处理。
3.6 ADR 的因果关系评价及转归
我国目前采用的ADR 报告因果关系评价方法易受评价专家知识背景及临床经验的影响[16]。因此,还需要加强对ADR监测人员及临床医护人员的培训和指导。190 例ADR 经停药或对症治疗后,186 例(占97.89%)治愈或好转,没有对患者造成进一步的损害。
开展ADR 监测工作是医疗机构的一项重要任务。自2012 年以来,我院的ADR 上报数量逐年增加,质量也有所提高,但仍存在如下问题:(1)部分科室对ADR 的重视程度不够,存在漏报、拖延上报的现象,更有个别医务人员因认识上的误区对一些严重的ADR 往往不上报,害怕引起纠纷或承担责任,造成了ADR 报告的种类构成欠合理,儿童、老年人等不良反应易发人群的ADR 反而上报较少的现象。(2)报告中,患者的基本信息填写不完整,药品的批准文号、药品批号填写不清甚至不填写。(3)报告中,不良反应发生的时间描述不全,不良反应过程的描述过于简单。我院仍应逐步提高ADR 上报的数量与质量,秉着“真实、完整、准确”的原则,按“3 个时间3个项目2 个尽可能”的格式,尽量把不良反应过程描述清楚,使ADR 报告更规范。在我院,ADR 多由临床医师上报,而护士、门诊药房的药师及临床药师上报的相对较少。护士是药物治疗的直接实施者,对患者用药后的反应了解得最直接、最具体;临床药师通过每日参与医师的查房工作,也可以及时了解到患者的用药感受;门诊药房的药师在患者退药时,通过了解退药原因,也可以发现ADR,因此,护士、药师也应成为上报ADR 的骨干力量[17]。另外,药源性皮疹也属于ADR 范畴,皮肤科医师应引起关注并积极上报。总之,我院还需进一步加强对ADR 相关知识的培训,提高ADR 上报的数量和质量,并将ADR 的信息反馈给临床,提高临床合理用药水平,促进临床药学可持续性发展。
[1] 周银才.我院187 例药品不良反应报告分析[J]. 中国药业,2010,19(17):56-58.
[2] Liu B,Liu LZ,Xuan J,et al. Treatment patterns associated with stroke prevention in patients with atrial fibrillation in three major cities in the People's Republic of china[J]. Int J Gen Med,2013(7):29-35.
[3] 梁聂彦,陈柱强,曾立威,等.198 例国家基本药物致不良反应/事件报告分析[J].中国医院用药评价与分析,2013,13(1):64-66.
[4] 陆惠平,严晓沁,顾正平,等. 我院585 例药品不良反应的回顾性分析[J].中国药房,2012,23(22):2084-2086.
[5] 张灵,程娟,赵黎明,等.188 例药品不良反应报告分析[J].药物流行病学杂志,2014,23(11):670-673,684.
[6] 巫海英.抗菌药物不良反应分析及合理应用的对策[J].临床合理用药杂志,2009,2(19):119-120.
[7] 卢靖.中药常见不良反应分析及安全用药管理[J].亚太传统医药,2015,11(1):134-135.
[8] 李芳,周琦,姜霖,等.抗菌药物不良反应报道分析[J]. 中华医院感染学杂志,2010,20(18):2832-2833.
[9] 郑火珺,叶建云. 我院抗菌药物不良反应报告相关因素分析[J].中国药业,2013,22(6):94-96.
[10] 郑丽梅,卢健平.某院2011 年度药物不良反应报告的分析[J].中国医药指南,2013,11(15):119-121.
[11] 刘丹,赵丽霞,丁长玲,等. 我院4 种中药注射剂不良反应分析[J].药学研究,2013,32(9):554-556.
[12] 管玫,陈泽莲,潘晓鸥,等. 中成药药物不良反应的临床特征及发生的相关因素分析[J].中国药房,2004,15(7):428-430.
[13] 曾海萍,黄健,崔岚,等.98 例药品不良反应报告分析[J]中国药业,2013,22(2):44-45.
[14] 万春阁.安康市1998—2011 年肺结核流行病学分析[J]医学动物防制,2012,28(11):1202-1204.
[15] 刘春光,钟凤云,李绍飞.182 例肺结核患者化疗不良反应分析[J].浙江预防医学,2015,27(1):60-62.
[16] 魏晶,王瑜歆.药品不良反应报告因果关系评价方法概述[J].中国药物警戒,2011,8(10):600-603.
[17] 李虹,曹永红.321 例药品不良反应报告分析[J].中国医院用药评价与分析,2011,11(10):940-942.

