熊猫粪便中纤维素降解菌的筛选与鉴定
曹涵文,吴珑韬,甘乾福,鲍若虹,梁学武
(福建农林大学 动 物科学学院,福建 福 州350002)
纤维素是自然界中广泛存在的一类结构性碳水化合物,每年通过陆生及海洋藻类的光合作用,可产生0.85×1011t纤维素,相当于世界总能值消耗的四倍[1],是地球上蕴藏最为丰富的可再生资源之一。纤维素是植物细胞壁的主要成分,由D-葡萄糖以β-1,4糖苷键组成的链状高分子化合物。在纤维素中不仅存在着分子内氢键还存在着分子间氢键,在秸秆中纤维被半纤维素和木质素包裹并且通过结晶结构与之相连,从而导致纤维素的水解与糖化受到显著的抑制作用。影响纤维素水解的因素还包括原材料的多孔性、纤维的结晶度、木质素以及半纤维素含量[2]。植物纤维水解为可溶性糖依赖于复杂纤维素酶的协同作用[3]。当今,随着全球能源与粮食资源的大量消耗,人们迫切的希望找到一种将纤维素加以利用的新方法。
大熊猫虽为肉食动物,但其食物多以竹笋和竹叶为主,平均每只成年大熊猫每日进食竹子量可达12.5 kg。大熊猫除消化竹子中90%以上的蛋白质和脂肪等营养物质外,还能利用8%的纤维素和27%的半纤维素[4]。黄河等[5]报道,大熊猫以竹子叶为食时,对粗蛋白、粗脂肪和半纤维素的消化率分别为61.5%、50.3%和23.3%;而当以竹笋为食时,消化率分别达71.9%、61.5%和29.6%,大熊猫对竹笋中营养物质的利用率高于竹叶。大熊猫虽然有着草食性哺乳动物进食特点,却拥有典型的肉食性哺乳动物的消化系统。2010年大熊猫的基因组序列公布[6],从其基因组序列中可以找到编码与肉食性动物消化系统相关酶的基因,但编码纤维素酶的相关基因却并没有被发现,因此大熊猫对纤维素的消化必然要依赖肠道菌群的作用。孙飞龙等[7]研究了不同时期大熊猫肠道的菌群种类及分布,证明了熊猫肠道内纤维素的利用依靠菌群的协作。本试验对大熊猫粪便中的纤维降解菌进行分离鉴定,和对产酶特性进行研究,探索熊猫肠道内能够高效利用纤维素的菌株,为实现高纤维类资源饲料化提供支撑[8]。
1 材料与方法
1.1 样品的采集
大熊猫粪便采集于福州动物园,采集时去除表面杂质,装入自封袋中并编号,取样是在灭菌的超净工作台中进行,将粪样用灭菌的刀片剖开,于中心位置取样,剩余粪样-20℃保存。
1.2 纤维素降解菌的培养及筛选
纤维素降解菌的培养利用了察克贝氏培养基[9],羧甲基纤维素(CMC)作为唯一碳源。其主要成分包括羧甲基纤维素10 g;MgSO4·7 H2O 0.2 g;K2HPO41 g;NH4NO31 g;FeCl3·6 H2O 0.05 g;CaCl20.02 g。将粪样加入到液体培养基中恒温震荡培养3 d,将菌液稀释到10-6、10-7、10-8并涂布到平板上,25℃倒置培养3 d。取纯化后的菌液20μL滴加到培养基中,待菌落长出后,用刚果红染色1 h,然后用1 mol/L的无菌生理盐水浸泡1 h,根据菌落产生透明水解圈直径大小,评定菌株的产酶能力。
1.3 酶活性检测
以葡萄糖的浓度为纵坐标,对应的吸光度为横坐标,绘制葡萄糖标准曲线用于后续酶活性的测定。将发酵液于8 000 r·min-1、4℃条件下离心20 min所得到的上清液即为粗酶液。测定羧甲基纤维素酶(CMCase)活性、滤纸酶(FPase)活性,分别利用羧甲基纤维素和中性滤纸作为底物进行培养,采用3,5-二硝基水杨酸显色法[10]测定。酶促反应在25℃,p H为7.0的条件下进行。酶活性单位(U)定义为:在p H为7.0温度为25℃的条件下,每分钟产生相当于1μmol葡萄糖的还原糖所需的酶量为1个酶活性单位。将初筛得到的27株菌株接种至20 m L的试管中制成菌悬液,然后接种到液体培养基中发酵培养,25℃,150 r/min培养3 d后测定发酵液的酶活。
1.4 菌落及细胞形态学观察
形态学观察包括细胞形态鉴定和菌落形态鉴定两类,菌落形态鉴定主要是了解菌落大小、形态、颜色、光泽度、透明度、质地、隆起形状、边缘特等。细胞的形态鉴定主要是通过革兰氏染色[11],借助显微镜对细胞的 大小、结构、排列方式以及芽孢、鞭毛、细胞膜等进行观察[12]。
1.5 菌株的生理生化试验
细菌生理生化测定参照《伯杰氏细菌鉴定手册》[13]的有关方法进行测定。主要包括糖醇的发酵实验、淀粉的水解实验、V~P试验、甲基红试验、明胶(Gelatin)液化试验、氧化酶试验、过氧化氢酶试验(接触酶试验)、硝酸盐还原反应、p H生长测定等[14]。
1.6 16S r DNA序列分析
采用试剂盒法提取菌液中菌株的DNA,利用微生 物 16S r DNA 通 用 引 物 27F(5'-AGAGTT TGATCATGGCTC AG-3')、1492R(5'-TAGGGTTACCTTGTTACGACTT-3')[15]对 其 16S r DNA序列进行扩增,PCR产物回收纯化后与p MD19-T相连接,连接产物转化Ecoli JM 109感受态细胞。挑取转化子并提取质粒后PCR验证[16],经验证确定转入外源细菌16S r DNA片段的单菌落,最后将转化子质粒送至上海英骏生物技术有限公司测序,将测序结果与GeneBank中已有序列进行比对。用NCBI建立系统发育树,确定所选菌株的种属[17]。
1.7 菌株的产酶条件研究
取适量的菌液及液体培养基置于250 m L锥形瓶中进行液体发酵,在培养温度、初始p H、接种量以及装液量不变的条件下,设置不同的培养时间作为梯度,通过测得菌液的CMCase活性大小,得出最佳的培养时间。同样的方法可以得出,在单因素中达到最大酶活性时所需的培养温度、p H、接种量以及装液量[18]。
利用CCD中心组合,判断产酶条件的单因素之间有无交互作用,如表1所示。实验设计基于二阶数学模型:

Y为响应值,β0为常数项βI、βIJ、βII为回归系数xI、xJ为编码后的变量(培养时间、装液量、接种量、p H、温度)。
Y(酶活性)=20.89+5.050×10-3*A+0.010*B-0.017* C+1.248×10-3* D+0.039* E+9.426×10-5* A *B-1.596×10-3* A * C-0.010* A * D-5.531×10-3* A * E-0.013*B* C-0.014* B* D-8.721×10-3* B* E-0.019* C* D+0.018* C* E-4.998×10-3* D*E-1.790×10-3* A2+0.045*B2+0.064* C2-0.48* D2-0.30* E2
A为培养时间,B为装液量,C为接种量,D为p H,E为温度。

表1 CCD实验设计中变量的编码和水平表Table 1 Encoding and level of variance in CCD experiment
2 结果与分析
2.1 纤维素降解菌的筛选结果
从初筛的菌落中选取大而明显37株菌落,纯化后接种于平板上,通过刚果红染色及1 mol/L的NaCl浸泡,发现有27株具有明显的透明圈。
2.2 CMCase和FPAase酶活性测定结果
2.2.1 葡萄糖标准曲线的绘制
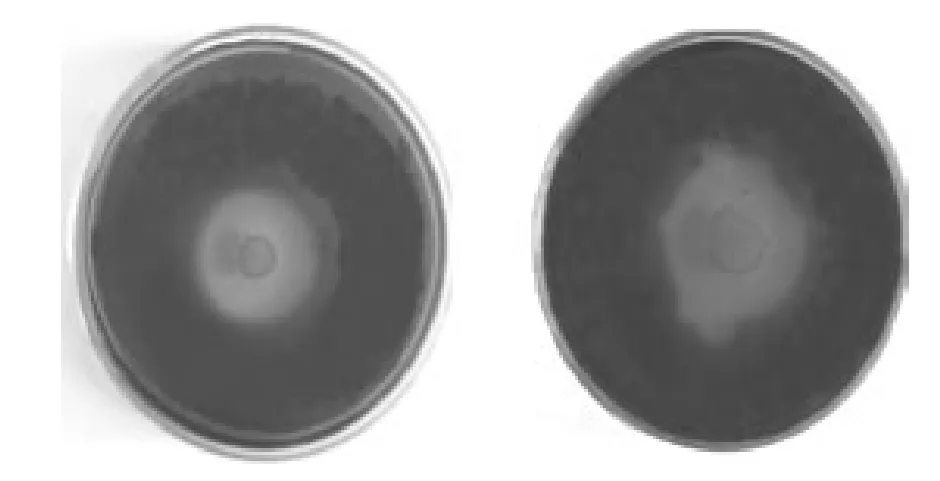
图1 染色的水解圈Fig.1 Hydrolysis circle of dyeing
2.2.2 酶活性的测定 羧甲基纤维素酶(CMCase)活性、滤纸酶(FPase)活性结果如表2所示。
结果表明,初筛所得到的菌株,能够在以羧甲基纤维素为碳源的平板上产生透明圈,但一部分菌株不能很好的利用纤维素这种天然物质。根据CMCase和FPAase活力,选出生长旺盛,产酶能力较强的3号菌株并对其进行传代培养。菌株经过多次的传代培养,其产酶能力依然稳定,没有呈现出退化迹象,如表3所示。

图2 葡萄糖标准曲线Fig.2 Standard curve of glucose
2.3 菌株的形态学观察
在羧甲基纤维素钠平板25℃培养72 h,该菌株菌落圆形,直径0.25μm~0.4μm,乳白色,边缘齐整,呈液滴状、表面光滑,中凸,无光泽。革兰氏染色结果为阴性,直的杆菌。如图3所示。

表2 菌株的复筛Table 2 Re-screening of bacterial strains

表3 菌株的传代培养Table 3 Subculture of the strain
2.4 菌株的生理生化试验
NC020209菌株革兰氏染色鉴定为阴性,好氧,有机化能异养。生长温度范围5~40℃,最适生长温度为25~30℃。在p H为4.0~8.0的范围内均能生长,最适p H为6.0。在培养基上长势良好,根据该菌株对不同碳源和氮源的利用情况,对菌株进行鉴定。由表4可知菌株利用葡萄糖不产气,可以利用麦芽糖、尿素、甘露糖、蔗糖、蕈糖、果糖,不能同化阿拉伯糖、甘油、棉籽糖、山梨糖、木糖、D-核糖、鼠李糖、木糖、乳糖、枸橼酸盐。靛基质试验、硫化氢、VP、葡萄糖酸盐试验均为阴性,能够将明胶液化单不能将淀粉水解,甲基红试验、氧化酶、接触酶试验均为阳性,初步鉴定该菌株为假单胞菌。

图3 菌株的形态学观察Fig.3 Morphological observation of the strain

表4 菌株NC020209的生理生化特性Table 4 Physiological-biochemical characteristic of the NC020209
2.5 16S r DNA测序与分析
该菌株通过PCR扩增16S r DNA片段的长度约为1 500 bp,选取亲缘关系最近的24个菌株序列进行比较。由图4可知,该菌株与Pseudomonas poae RE*1-1-14的同源性为99%,利用临近序列分析法构建了菌株遗传进化树。由此判断该菌属于革兰氏阴性好氧假单胞菌。
2.6.1 培养时间对产酶的影响 NC020209菌株在培养18 h进入对数生长期,培养至36 h达到最大值,这个阶段中菌株产生了大量的纤维素酶和滤纸酶等胞外酶,由图5可知,最佳培养时间为36 h。
2.6.2 培养温度对产酶的影响 温度对NC020209菌株的产酶能力有较大的影响。从图6可知该菌株的产酶温度范围很广,从10℃至25℃期间,其酶活性不断的增加,25℃达到最大值,该菌株的最佳培养温度为25℃。
2.6.3 p H值对产酶的影响 由图7可知,初始p H为4.0~5.5,NC020209菌株的产酶效果较好,产酶能力逐步提高。p H为6时产酶效果最好,当p H继续增大,该菌株的产酶能力逐步下降并趋于平缓。
2.6.4 接种量对产酶的影响 从图8分析可知,NC020209菌株接种量在0.5%~3.5%期间,产酶效果较好且趋于平稳。接种量在4%达到最高,接种量大于4%则产酶效果急剧降低。
2.6.5 装液量对产酶的影响 装液量影响氧气的溶解速率,进而影响菌株的产酶和生长[19]。由图9可知,装液量在10%~30%范围内,NC020209菌株酶活性逐步提升,装液量为30%,酶活性达到最大值。
2.6.6 CCD中心组合实验设计优化发酵条件 图10显示了接种量和装液量位于实验设计的中心水平时,对NC020209菌株酶活性影响的等高线图和响应面图。由图10可知,接种量为3.8%~4.1%,装液量为37%~42%时,二者添加量过多或过少均会影响该菌株酶活性的大小。由培养时间与装液量交互影响得出的等高线图可以看出,这两个变量没有交互影响,说明接种量与装液量变化能单独引起该菌株酶活性的变化(P>0.05)。同理,培养时间、装液量、接种量、p H、温度等因素之间也不存在交互作用。
3 讨 论

图4 菌株的系统进化树Fig.4 Phylogenetic tree of strains

图5 培养时间对NC020209菌株产酶的影响Fig.5 Effect of culture time on CMCCase synthesis of NC020209
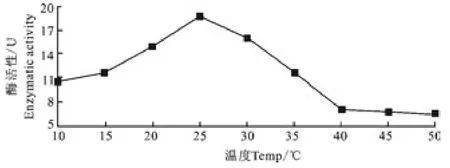
图6 培养温度对NC020209菌株产酶的影响Fig.6 Effect of temperature on the CMCcase synthesis of NC020209

图7 p H对NC020209菌株产酶的影响Fig.5 Effect of p H on the CMCCase synthesis of NC020209

图8 接种量对NC020209菌株产酶的影响Fig.8 Effect of inoculation amount on the CMCCase synthesis of NC020209

图9 装液量对NC020209菌株产酶的影响Fig.9 Effect of broth content on the CMCCase synthesis of NC020209
大熊猫为肉食动物,其对纤维素的消化依赖于肠道菌群的协同作用。朱立峰等从大熊猫粪便样本中提取的16Sr RNA序列发现,大熊猫肠道菌群主要由梭菌纲(Clostridia)和厚壁菌门(Firmicutes)的芽胞杆菌纲(Bacilli)细菌组成[20]。通过测定熊猫肠道宏观基因组,发现了纤维素酶和半纤维素酶的编码基因[21],该实验在分子水平上证明了熊猫利用肠道内微生物对竹子纤维素和半纤维素加以降解。王海娟[22]报道已发现的大熊猫肠道菌类共22种,分属于7个菌门,分别是变形菌门、厚壁菌门、放线菌门、子囊菌门、拟杆菌门、酸杆菌门、蓝菌门。
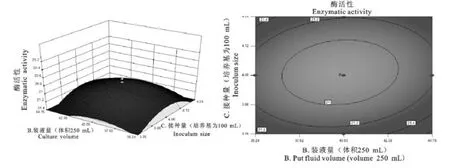
图10 接种量和装液量交互影响NC020209菌株酶活性水平的等高线图及响应面图Fig.10 Contour plots and response surface diagram of the effect of inoculum sizeand loaded liquid on NC020209 enzymatic activity
本实验从熊猫粪便分离到一株革兰氏阴性好氧假单胞菌(NC020209菌株)。Zhang[23]等报道,假单胞菌所产生的漆酶,在降解植物细胞壁过程中起重要作用,它能瓦解纤维素的晶体结构,解除木质素对半纤维素和纤维素的封闭,从而增加其可及度,提高酶的水解效率。由此可见,正是假单胞菌对纤维类物质的“破壁”作用,才使得熊猫肠道内后续的纤维降解过程得以顺利进行。采用DNS法测定酶活性及对产酶条件进行研究,培养温度25℃,初始p H为6.0,接种量4%,装液量为30%,摇床转速为150 rpm的条件下培养36 h,所测得NC020209菌株酶活为24.362 U。
[1] Rajoka I M,Malik A K.Cellulase production by Cellulomonas biazotea cultured in media containing different cellulosic substrates[J].Bioresour Technol,1997,59:21-7.
[2] Mc Millan J D.Pretreatment of lignocellulosic biomass.In:Himmel M E,BakerJ O,Overend R P,editors.Enzymatic conversion of biomass for fuels production[J].Washington,DC:American Chemical Society,1994.292-324.
[3] Romanowska I,Polak J,Bielecki S.Isolation and properties of Aspergillus niger IBT 90 xylanase for bakery[J].Appl Microbiol Biotechnol,2006,69:665-671.
[4] 樊 程,李双江,李成磊,等.大熊猫肠道纤维素分解菌的分离鉴定及产酶性质[J].微生物学报.2012,52(9):1 113-1 121.
[5] 黄 河,张志和,侯 蓉.粪样在大熊猫研究上的应用[J].动物学杂志.2012,47(6):156-163.
[6] Li R Q,Fan W,Tian G,et al.The sequence and de novo assembly of the giant panda genome[J],Nature,2010,463(7279):311-317.
[7] 孙飞龙,刘敬贤,席 丹,等.大熊猫肠道疾病致病菌[J].经济动物学报.2002,6(2):20-23.
[8] Ragauskas A J,Williams C K,Davison B H,et al.The path forward for biofuels and biomaterials[J].Science,2006,311:484-489.
[9] 付丽丽.作物秸秆纤维素降解菌的分离与筛选[D].浙江大学,2012:14-15.
[10] 胡国全,邓 宇,徐 恒,等.极端嗜热厌氧纤维素菌的分离、鉴定、系统发育分析及其酶学性质的研究[J].应用与环境生物学报,2004,10(2):197-201.
[11] 孙纪全,黄 星,何 健,等.异丙隆降解菌Y57的分离鉴定及其降解特性[J].中国环境科学.2006,26(3):315-319.
[12] 周生飞.高效降解棉酚菌种筛选、降解机理及固体发酵工艺研究[D].甘肃农业大学,2011:26-28.
[13] 布坎南R E.伯杰氏细菌鉴定手册[M].北京:科学出版社,1988.
[14] 解林奇.多菌灵降解菌系筛选、组成分析及其降解效果[D].北京:中国农业科学院,2012:33-37.
[15] Baker G C,Smith J J,Cowan D A.Reviewandre-analysis of domain-specific 16S primers[J].Journal of Microbiological Methods,2003,55(3):541-555.
[16] 吕莉华.瘤胃纤维素降解菌Real-Time PCR荧光定量方法的建立及其初步应用[D].呼和浩特:内蒙古农业大学,2007:16-18.
[17] 孙一博.高效纤维素降解菌的筛选鉴定及特性研究[D].哈尔缤:东北农业大学,2013:24-29.
[18] 张晓辉,郭春华,江晓霞.饲用木聚糖酶生产菌株的筛选及部分酶学性质的研究[J].兽药与饲料添加剂,2007,12(2):4-6.
[19] 郭 勇.酶工程[M].北京:中国轻工业出版社,1994:42-43.
[20] Teather R M,Wood P J.Use of Congo red-polysaccharide interactions in enumeration and characterization of cellulolytic bacteria from the bovine rumen[J].Applied and Environmental Microbiology,1982,43(4):777.
[21] 吴 华,詹祥江,张保卫,等.大熊猫微卫星位点的筛选与鉴定[A].野生动物生态与资源保护第三届全国学术研讨会论文摘要集[C].2006.
[22] 王海娟,潘 渠.大熊猫肠道正常菌群降解纤维素的机制[J].中国微生态学杂志.2014,26(2):225-228.
[23] Zhang X,Xu C,Wang H.Pretreatment of bambooresidues with Coriolus versicolor for enzymatic hydrolysis[J].J Biosci Bioeng,2007,104(2):149-151.

