64排螺旋CT血管成像评价椎动脉起始部支架术后再狭窄随访研究
蒋超 李递通
闭塞性脑血管疾病是导致椎基底动脉缺血最常见的危险因素,其中椎动脉颅外段狭窄或闭塞占30.05%,并以椎动脉起始段为好发部位[1],是后循环缺血性卒中的重要原因之一。近年来,随着椎动脉支架成形术的广泛应用,改善了后循环缺血性卒中的预后。然而,对支架置入后长期随访结果以及支架内再狭窄等有关的研究多应用彩超和多谱勒,方便但受操作者影响大。本研究应用64排螺旋CT血管成像对椎动脉起始段介入后的血管形态学变化进行观察,旨在客观评价椎动脉内置入支架的疗效,并客观评价椎动脉起始部支架术后血管再狭窄情况。
1 资料与方法
1.1 一般资料 选择2010年3月~2012年10月玉林第二人民医院住院的症状性椎动脉起始段狭窄(狭窄率≥70%)并接受支架成形术治疗的54例患者,置入球囊扩张式支架共62枚(8例为双侧椎动脉置入支架)。其中,男38例(70.4%),女16例(29.6%),年龄 48~81 岁,平均(64±10)岁。病例纳入标准:(1)术前DSA证实椎动脉起始部重度狭窄。(2)支架置入术后即刻造影示残余狭窄率<20%。(3)术后规律服用阿司匹林和氯吡格雷。排除标准:(1)伴有锁骨下动脉病变者和椎动脉开口远端狭窄者不纳入本组研究。(2)资料不全或失访者。(3)随访期间发生其他重大疾病,影响资料准确性。
1.2 危险因素分析 相关危险因素包括性别、年龄、高血压、糖尿病、冠心病、高脂血症、吸烟、饮酒、合并其他血管狭窄、术前后循环供血不足症状。高血压、糖尿病及冠心病的诊断根据既往病史及此次住院的最后诊断确定。收缩压≥140 mmHg和(或)舒张压>90 mmHg为高血压;有糖尿病病史(经区县级以上医院诊断)或空腹血糖≥7.0 mmoL/L为糖尿病;总胆固醇≥5.72 mmoL/L或三酰甘油≥1.70 mmol/L或高密度脂蛋白≤0.90 mmoL/L或低密度脂蛋白I>3.64 mmol/L为高脂血症。长期吸烟史定义为平均抽烟10支/d以上,连续5年以上。长期饮酒史定义为平均每天饮白酒100 mL以上,连续5年以上。
1.3 随访方法 常规随访时间为术后 3、6、9、12 个月,如果患者在随访中出现新发症状或者再狭窄趋势,随访间隔依具体情况缩短。按照原治疗血管与支架远端变化比较,术后血管再狭窄程度>50%定义为再狭窄,10%~49%为异常血管[2]。随访时间的计算方法是:再狭窄病例以检测到再狭窄的时间为准。发现再狭窄均行脑血管造影证实。
1.4 检测方法 CT机采用PhilipsBrillance 64排螺旋CT扫描仪,全部病例头颈CT血管造影前行常规头颅CT轴位扫描。定位像上确定头颈血管造影扫描范围由主动脉弓至头顶,采用高压注射器经肘静脉以5 mL/s的注射速率,注射非离子型对比剂碘海醇370 mg(I),60~70 mL,选主动脉弓层面,使用智能触发技术,当CT值超过180 HU时,自动启动头颈扫描。扫描参数:管电压120 kV,管电流250 mA,重建层厚0.67 mm,重建间隔0.3 mm,床速47.5 cm/s,螺距0.891,旋转时间0.75 s,总扫描时间6.8~8.9 s。在Philips公司extended BrillianceTM工作站,应用release 2.1软件对头颈动脉CT图像进行最大密度投影(MlP)、多平面重组(MPR)、曲面重组(cPR)、容积再现(VR)重建后处理。病变分析:研究椎动脉系统CTA图像。图像显示动脉狭窄程度参照据北美症状性颈动脉内膜切除术实验组标准:轻度狭窄为0%~29%;中度狭窄为30%~69%;重度狭窄为70%~99%;闭塞为100%,并在多平面重组和曲面重组图像上显示局部斑块形成者,根据斑块CT值确定斑快性质:CTI>200 HU为钙化斑块,CTI<200 HU为软斑块,2种成分同时存在定义为混合性斑块。
2 结果
2.1 患者基线特征及危险因素情况 共入选54例患者,男 38例(70.4%),女 16例(29.6%),年龄 44~84岁,平均(65±10)岁。参考血管直径(4.0±1.7)mm,最小管腔直径(3.5±0.5)mm,平均病变的狭窄长度(8.7±3.2)mm,平均狭窄率(72.0±8.8)%。共植入62枚支架,平均支架的长度(11.9±4.2)mm。共放置62枚支架,其中右椎动脉置人支架21枚,左椎动脉41枚。手术成功率100%,经治疗的血管狭窄程度均降至20%以下。其中高血压47例,糖尿病12例,高血脂18例,心脏病5例,吸烟史27例,高同型半胱氨酸15例。
2.2 椎动脉起始部支架置入术后管径变化。见表1。
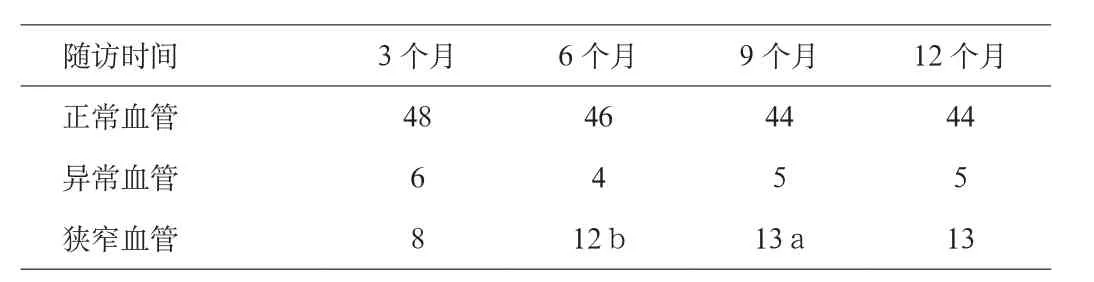
表1 与支架远端正常血管管径比较(根)
2.3 斑块性质变化。见表2。

表2 斑块性质变化(块)
2.4 血管再狭窄 发现血管再狭窄(13根)均行血管造影检查,再狭窄血管CTA与脑血管造影符合率为92.3%,仅1例(单支架置入)右椎动脉起始部支架患者与造影不符,为假阳性。
3 讨论
3.1 椎动脉狭窄是由于动脉粥硬样化斑块引起,好发于椎动脉起始段,是后循环缺血症状的常见病因[3]。由于血管内治疗技术的成熟,对于椎动脉开口狭窄程度大于50%并有临床症状或狭窄程度大于70%的患者,采用血管内支架成形术治疗,有满意的疗效[4],明显改善后循环的血供,缓解临床症状。同时支架的覆盖还能有效地预防粥样斑块的脱落,降低因斑块脱落引起的卒中的风险。然而治疗后支架内再狭窄导致远期疗效欠佳。支架再狭窄是椎动脉狭窄支架成形术最常见的并发症,文献报道再狭窄率为10%~43%[5],国内外报道率再狭窄差别较(0.06%~43.00%)[6-8]。SSYLVIA研究报道:在接受椎动脉颅外段支架成形术的18例患者中,14例有术后1年的临床随访和6个月的造影随访,6例(43%)发生再狭窄[9]。支架内再狭窄的发生是动脉内膜损伤后修复过程,支架长期压迫血管壁导致血管局部或广泛性内皮细胞过度增生,是支架植入后再狭窄的主要机制,病理基础是血管平滑肌细胞增生而非复发动脉粥样硬化[10]。从本研究血管斑块性质分析,再狭窄血管处斑块多为低密度,亦可证实。患者自身因素亦与支架内再狭窄相关,包括高龄、吸烟、糖尿病、高血压、高血脂等,本研究中患者在支架置入术前、术后均对血压、血糖、血脂、吸烟、饮酒、规律抗血小板进行了控制,从一定程度上减少了危险因素对再狭窄发生的影响。再狭窄仍有较高的发生率,可能与椎动脉的解剖特点,支架大小,露于锁骨下动脉长度有关,但有研究显示,再狭窄率与支架直径和长度无关[11],与血管管径有关,越大越不易发生再狭窄[12]。本研究能通过CT血管成像观察血管管径大小及支架长度,因无相关标准,无法作出统计分析,但个人经验倾向于此目标血管越大,支架与血管贴壁良好,支架覆盖狭窄斑块程度良好,越不易术后再狭窄。
3.2 诊断支架内再狭窄的方法主要为创伤性的血管造影。它是支架置入术后随访的主要手段。但是,其创伤性及并发症限制其在临床的应用。如何及时随访发现血管再狭窄,给下一步血管内治疗提供时机成为术后病人随访的问题。64排螺旋CT空间分辨率明显提高,扫描速度明显加快,几乎克服了运动伪影,可获得清晰的接近血管造影图像的体部动脉图像。64-MDCTA通过轴位扫描、三维采集数据,实现了各向同性(指在轴位三维采集数据后,重建出的轴位像、冠状切面、矢状切面都具有一致的空间分辨率),所以在任意方向重建出的图像质量均良好。有扫描速度更快、空间分辨率更高,扫描范围更大、重建图像更清晰等优点[13-15]。64排螺旋CTA检查相对为无创性检查,可以较好地识别病变部位及其程度,具有较高的特异度,能可靠地排除显著狭窄的存在,并能对动脉支架术后管腔做出准确评价。MSCTA在扫描时间和空间的不断进步[16]使MSCTA的应用范围不断扩大。在我们的观察中,仅1例CTA假阳性。完全可以行CTA检查,发现支架血管再狭窄后行血管造影及血管内治疗。见图 1、图 2。
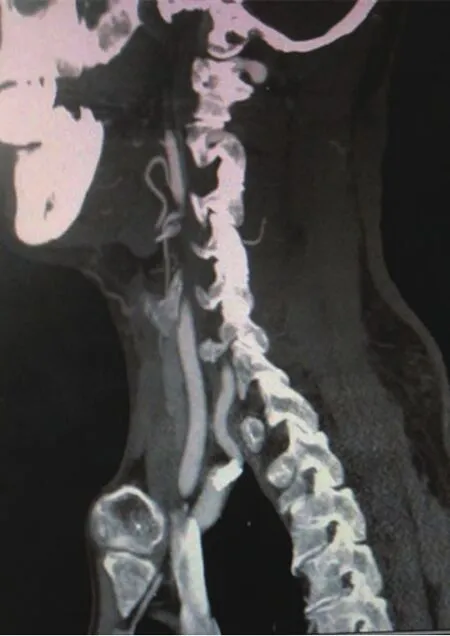
图1 支架术后3个月,支架及血管内血流清晰可见,无明显血管狭窄(侧位)
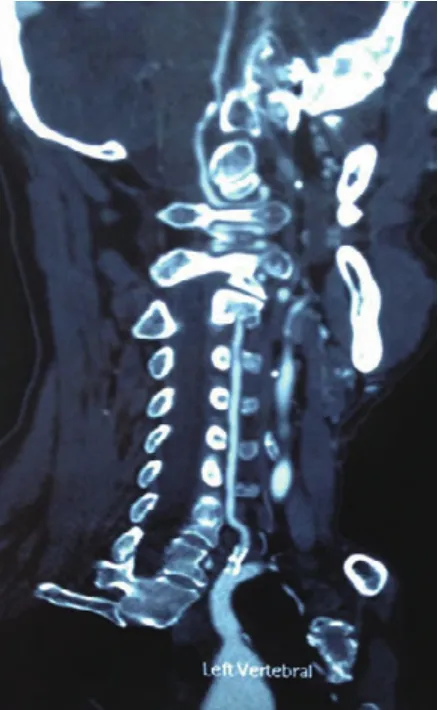
图2 支架术后3个月,支架及血管内血流清晰可见,无明显血管狭窄(正位)
3.3 椎动脉支架是二级预防的较好选择。从本组试验临床观察看,短期疗效满意,术后3个月内发生再狭窄的几率较高,中期(3个月~1年)继续再狭窄的比率不高,远期疗效尚无大样本统计学资料的结论,有待进一步深入研究。
[1] Coward LJ,Featherstone RL,BrownMM.Percutaneous transluminal angioplasty and stenting for vertebral artery stenosis[J],Cochrane Database Syst Rev,2005,18(2):CD 000516.
[2] 贾志豪.冠脉支架内再狭窄发生机制及防治研究进展[J].现代生物医学进展,2008,8(7):1346-1349.
[3] Savitz SI,Caplan LR.Vertebrobasilar disease[J].N Engl J Med,2005,352(25):2618-2626.
[4] 徐晓彤,姜卫剑,杜彬,等.颅内椎一基底动脉狭窄支架成形术后的远期疗效[J].中国卒中杂志,2008,3(7):798-802.
[5] Wehman JC,Hanel RA,Guidot CA,et al.Atherosclerotie occlusive extracranial vertebral anery disease:indications for intervention,endovascular techniques,short—term and long—term results[J].J Interv Cardiol,2004,17(4):219-232.
[6] 田朝晖,唐文雄,张志勇,等.280例颅外脑血管狭窄的血管内支架成形术的疗效观察[J].中日友好医院学报,2012,26(3):131,137.
[7] Dabus G,Gerstle RJ,Derdeyn CP,et al.Endovascular treatment of the vertebral artery origin in patients with symptoms of vertebrobasilarischemia[J].Neuroradiology,2006,48(12):917-923.
[8] Weber W,Mayer TE,Henkes H,et al.Efficacy of stent angioplasty for symptomatic stenoses of the proximal vertebral artery[J].Eur J Radiol,2005,56(2):240-247.
[9] Ssylvia Study Investigators.Stenting of symptomatic Atherosc 1erotic Lesions in the Vertebral or intraeranial Arteries(SSYLVIA):study results[J].Stroke,2004,35(6):1388-1392.
[10] Wehman JC,Hanel RA ,Guidot CA,et al.Atherosclerotic occlusive extracranial vertebral artery disease:indications for intervention,endovascular techniques,short-term and long-term results[J].J Interv Cardiol,2004,17(4),219-232.
[11] 赵慧砒,李慎茂.椎动脉起始部支架置入术后再狭窄的发生情况及影响因素[J].中华放射学杂志,2013,1(12):73-76.
[12] Lederman Pd,Mendelsohn FO,Santos R,et a1.Primary renal artery stenting:Characteristics and outcomes after 363 procedures[J].Am Heart J,2001,142(2):314,323.
[13] 齐滋华,崔凤玉,王青,等.16层螺旋CT在血管病变诊断中的临床应用[J].实用放射学杂志,2006,22(4):453-456.
[14] Ofer A,Nitecki Ss,Linn S,et al.Multidetector C angiography of peripheral vascular dlsea:a prospeetive eomparin with intrrterial digital subtraction angiography [J].AJR,2003,180(13):719-724.
[15] Ruhin GD,Sehnddt AJ,Logan U,el aI.Multi-dettor CT angiogrzphy ot lower extremity arterial inflow and runoff*initial experience[J].Radiology,2001,221(1):146-158.
[16] Seifarth H,Ozgün M,Raupach R,et al.64-Versus 16-slice CT angiography for coronary artery stent assessment:in vitro experience[J].Invest Radiol,2006,41(1):22-27.

