调强放疗同期顺铂或奈达铂化疗对局部晚期宫颈癌疗效影响
罗文苹 莫玉珍 李桂生
宫颈癌在发展中国家妇女是最常见的恶性肿瘤,荟萃分析已证实中晚期宫颈同步放化疗优于单纯放疗,提高了生存率、降低了30%~50%的死亡风险,确立了以顺铂为基础的同步放化疗成为中晚期宫颈癌标准治疗模式[1]。化疗药物美国国立综合癌症网络指南推荐顺铂单药,但由于顺铂的胃肠道反应及肾毒性,本研究尝试使用奈达铂代替顺铂用于宫颈癌的同期化疗,现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析广西医科大学第四附属医院柳州市工人医院2010年1月~2012年1月收治的203例采用调强放疗联合同期化疗的局部晚期宫颈鳞状细胞癌患者,根据2009年修订后FIGO宫颈癌分期标准,为ⅠB 2~IVa期。所有患者ECOG评分0~1,治疗前所有患者血常规、肝肾功能等相关检查均正常,无放化疗禁忌证。2组患者基线情况差异无统计学意义。见表1。
1.2 放疗设计 患者CT模拟定位前1 h排空膀胱,分2次口服20%泛影葡胺20 mL加500 mL水,使小肠显影并充盈膀胱。以后每次放疗前均按同样方法充盈膀胱。热塑体膜外固定,按照头尾方向进行CT增强扫描,范围为第3腰椎上缘水平至坐骨结节下3 cm,层厚5 mm。扫描结束后将图像经网络传送至Oncentra放疗计划系统。按照ICRU报告相关要求勾画靶区。大体肿瘤靶区(gross target volume,GTV)包括宫颈原发病灶和盆腔短径≥1.0 cm淋巴结(GTVnd),临床肿瘤靶区(clinical target volume,CTV)包括 GTV 和宫颈、宫体、宫旁、阴道、骼总、骼内、骼外、骶前淋巴引流区。在CTV的基础上外扩5 mm为计划靶区(planning target volume,PTV)。同时分别勾画直肠、膀胱和股骨头、小肠等周围正常危及器官。所有计划均采用Oncentra计划系统进行逆向调强放疗计划,外照射总处方剂量:PGTVnd 60.2 Gy/28次,2.15 Gy/次;PGTV 54.04 Gy/28次,1.93 Gy/次;PTV 50.12 Gy/28次,1.79 Gy/次;每天 1次,每周5次。危及器官剂量限定为:直肠V 40≤45%、膀胱V 40≤50%、小肠V 40≤30%、股骨头V 45≤5%[2]。在外照射15次后开始行腔内后装治疗,“A”点剂量36 Gy/6次,6.0 Gy/次,外照射期间每周1次,外照射结束后每周2次。
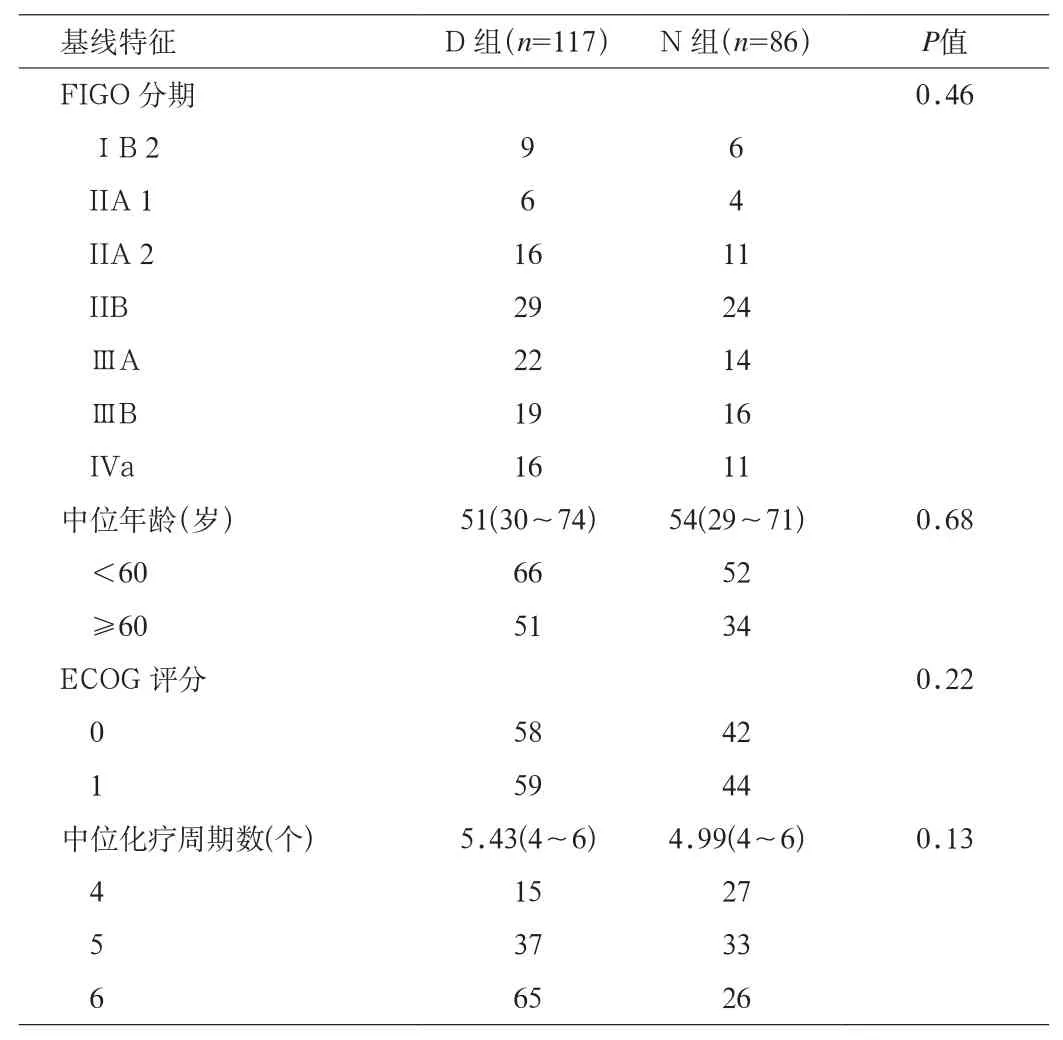
表1 2组患者基线情况比较
1.3 同期化疗方案 放疗期间予顺铂单药(30~40 mg/m2·周)或奈达铂单药[30~40 mg/(m2·周)]静脉滴注,化疗时间选择在周六进行,所有患者放疗期间共化疗4~6次。
1.4 疗效评价标准 所有患者治疗前、治疗结束时及治疗结束3、6、12个月进行腹盆腔CT、MR或PET/CT检查进行疗效评价;颈部、锁骨上区常规行彩超检查,胸部行胸片或CT检查,发生放射性直肠炎或膀胱出血患者行肠镜、膀胱镜检查。近期疗效采用REIST实体瘤客观疗效评价标准,分为完全缓解(CR)、部分缓解(PR)、病灶稳定(SD)、疾病进展(PD)。急性放射性反应评价标准采用RTOG急性放射反应分级标准,晚期放射性损伤评价标准采用RTOG/EORTC晚期放射损伤分级标准。放疗期间和结束6个月以内发生的直肠、膀胱反应定义为急性放射反应。放疗结束6~12个月以后持续存在的直肠、膀胱损伤定义为晚期放射损伤。
1.5 统计学方法 对本组研究的数据采用SPSS 13.0统计软件进行分析。生存资料用Kaplan-Meier法,其显著性检验用Logrank检验,计量资料采用“±s”表示,组间比较采用t检验;计数资料用例数(n)表示,计数资料组间率(%)的比较采用χ2检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 所有患者均完成放化疗计划和随访,中位随访时间为13.3个月(12~14个月)。有14例患者调整放疗计划时肿瘤体积缩小超过50%。所有患者均按计划完成随访,无失访患者。
2.2 肿瘤控制情况 放化疗结束时2组患者CR+PR均为100%。随访2年D组有6例(5.1%)出现肿瘤局部复发,N组有7例(8.1%)出现肿瘤局部复发,2组差异无统计学意义。D组有17例(14.5%)出现肿瘤远处转移(其中4例合并肿瘤局部复发),转移部位分别为肺8例,骨2例,腹膜后淋巴结多发转移2例,锁骨上淋巴结1例,全身多发转移4例;N组有15例(17.4%)出现肿瘤远处转移(其中2例合并肿瘤局部复发),转移部位分别为肺6例,骨1例,腹膜后淋巴结转移2例,锁骨上区、纵隔和腹膜后多发淋巴结转移1例,全身多发转移5例,2组差异无统计学意义。D组2年生存率90.6%(106/117),N组2年生存率88.4%(76/86),2组比较差异无统计学意义。
2.3 毒副反应 放疗期间D组因毒副反应导致放疗中断≥7 d的患者有3例(2.6%),原因为粒细胞减少性发热;另有10例患者因出现严重胃肠道反应导致放疗中断3~5 d;有9例患者出现暂时性肾功能损害,经对症治疗后未影响放疗。N组患者有11例(12.8%)患者因毒副反应导致放疗中断≥7 d,其中1例为严重胃肠道反应,8例为严重骨髓抑制和/或粒细胞减少性发热导致放疗中断1周以上,2例为尿路感染导致放疗中断7~14 d,1例为肺部感染导致放疗中断9 d;另有3例出现肾功能异常,但未导致放疗中断。因骨髓抑制和骨髓抑制相关性感染导致放疗中断超过7 d以上2组患者差异有统计学意义(P=0.041)。因胃肠道反应和肾功能损害导致放疗中断超过1周以上2组无差异。放疗期间2组患者各有2例患者发生2级放射性直肠炎,经治疗后症状缓解。放疗后2年D组有5例(4.3%)出现晚期放射损伤,均为放射性直肠炎,其中1级3例,2级1例,3级1例;N组有6例(7.0%)出现出现晚期放射损伤,其中4例为放射性直肠炎(1级2例,2级1例,3级1例),2例为放射性膀胱炎(1、2级各1例),差异无统计学意义。2组均无治疗相关死亡。
3 讨论
Green等[3]荟萃分析显示,同步放化疗可明显提高宫颈癌总生存率和肿瘤无进展生存率,且显著降低局部和远处复发风险。相关Meta分析显示顺铂、奈达铂及紫杉醇药物疗效相当[4]。近年的美国国立综合癌症网络指南均将顺铂作为局部晚期宫颈癌同步放化疗的1类证据予以推荐。在临床上,由于顺铂的胃肠道反应和肾毒性发生率较高,曾有学者尝试使用奈达铂替代顺铂用于同步放化治疗宫颈癌,并且取得了一定的疗效[5-7]。奈达铂是第二代铂类抗肿瘤药物,它水溶性高,对各种动物肿瘤都显示了较好的效果,动物的肾毒性、消化器官毒性较低[8]。本研究中,虽然2组局部控制率及2年生存率均无差别,但奈达铂组严重骨髓抑制发生率显著高于顺铂组(P<0.05),奈达铂组患者平均评化疗周期数少于顺铂组,其主要原因是骨髓抑制及相关并发症导致奈达铂化疗无法按计划进行,提示骨髓抑制为奈达铂主要限制性毒性。而顺铂组虽然胃肠道反应及肾损害发生病例数高于奈达铂组,但因胃肠道反应和肾功能损害导致放疗中断超过1周以上2组无差别。同样,远处转移率和晚期放射性直肠炎和放射性膀胱炎2组亦无差异。虽然奈达铂用于局部晚期宫颈癌同步放化疗其胃肠道反应和肾损害发生率低于顺铂,但其血液学毒性明显高于顺铂。提示在临床上调强放射治疗同期化疗治疗局部晚期宫颈癌时,顺铂仍是较佳选择,对于奈达铂则应是选择性地应用,并且需严密检测血象,提防严重骨髓功能抑制和相关并发症的发生,保障放化疗的顺利实施。
[1] Wang N,Guan QL,Wang K,et al.Radiochemotherapy versus radiotherapy in locally advanced cervical cancer:a meta-analysis[J].Arch Gynecol Obstet,2011,283(1):103-108.
[2] 谷铣之,殷蔚伯,余子豪,等.肿瘤放射治疗学[M].北京:中国协和医科大出版社,2008:1007-1050.
[3] Green JA,Kirwan JM,Tierney JF,et al.Survival and recurrence after concomitant chemotherapy and radiotherapy for cancer of the uterine cervix:a systematic review and meta-analysis[J].Lancet,2001,358(9284):781-786.
[4] 金凤岚,马宁,杨雷,等.宫颈癌同步放化疗不同单药化疗方案疗效的Meta分析[J].中国妇幼保健,2012,12(12):1191-1203.
[5] Kodama J,Takemoto M,Seki N,et al.Phase I study of weekly nedaplatin and concurrent pelvic radiotherapy as adjuvant therapy after radical surgery for cervical cancer[J].Int J Gynecol Cancer,2008,18(5):1037-1041.
[6] 王海荣,于长华,朱卫国,等.奈达铂与顺铂在宫颈癌同步放化疗中的应用[J].实用妇产科杂志,2011,27(10):771-774.
[7] 赵庆,权容.单药铂类化疗同步放疗治疗宫颈癌临床疗效分析[J].现代医药卫生,2014,11(11):1608-1609.
[8] Shimada M,Itamochi H,Kigawa J.Nedaplatin:a cisplatin derivative in cancer chemotherapy[J].Cancer Manag Res,2013,5(1):67-76.
——再论奈达对翻译本质属性的认知

