肝癌合并糖尿病患者术后的进食水方案
陆丽华,陈萃,付立,纪丹妮,王葵,施乐华,叶志霞
(1.第二军医大学东方肝胆外科医院 肝外四科,上海 200433;2.第二军医大学东方肝胆外科医院 护理部)
肝癌合并糖尿病患者术后的进食水方案
陆丽华1,陈萃1,付立2,纪丹妮1,王葵1,施乐华1,叶志霞2
(1.第二军医大学东方肝胆外科医院 肝外四科,上海 200433;2.第二军医大学东方肝胆外科医院 护理部)
目的 探讨适合肝癌合并糖尿病患者术后进食水方案。方法2011年8月至2013年7月,便利抽样法选取某医院住院治疗的120例肝癌合并糖尿病患者为研究对象,按随机数字表法将其分为观察组和对照组,每组60名。观察组患者术后4~6 h夹闭胃管,分次饮温水,于术后12 h鼓励患者进流质、术后24 h拔除胃管进半流质;对照组患者术后常规留置胃管,待肛门恢复排气后进流质,逐步过渡。比较两组患者围术期糖代谢、应激及肝功能指标变化等。结果观察组患者术后首次排气、排便时间均早于对照组(均P<0.01)。且术后6 h饥饿感、术后12 h口渴感和食欲情况,术后24 h口渴、焦虑感、食欲情况,术后48 h口渴、饥饿、焦虑感、腹部不适情况、食欲情况较对照组均有改善(P<0.05或P<0.01)。两组患者不同时间点的各项指标比较,时间因素对血清胰岛素、IR指标、C反应蛋白、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸转移酶(aspartate aminotransferase,AST)、前白蛋白(prealbumin,Pre-Alb)均存在主效应(P<0.05或P<0.01);干预因素对C反应蛋白、IR指标、血清C肽存在主效应(P<0.05);干预因素和时间因素对IR指标及C反应蛋白存在交互作用(P<0.05)。结论术后早期进食可改善患者主观感受。
肝癌;糖尿病;围术期;早期进食
[Nurs J Chin PLA,2015,32(21):6-10]
术后早期进食已成为快速康复外科(fast track surgery,FTS)治疗的一项重要措施。大量研究[1-4]证明,术后早期恢复经口饮食可减轻患者口渴、饥饿、焦虑感,促进胃肠道功能恢复,降低分解代谢和并发症发生率。由于我国慢性肝病、糖尿病发病率较高,肝癌合并糖尿病患者在临床上较常见。此类患者常存在肝糖原储备不足、糖代谢紊乱,加之手术应激、胃肠减压、术后长期禁食等因素,易导致血糖剧烈波动和胰岛素抵抗(insulin resistance,IR),影响肝功能恢复及预后。本研究旨在探讨肝癌合并糖尿病患者术后早期恢复经口饮食的安全性及对主观感受、糖代谢、肝功能、预后的影响。
1 对象与方法
1.1 对象与分组 2011年8月至2013年7月,采用便利抽样法选取第二军医大学东方肝胆医院肝外三科、肝外四科、肝外六科符合标准的患者120例为研究对象。入选标准:(1)肝癌合并2型糖尿病的首次手术患者;(2)年龄18~70岁;(3)签署知情同意书。排除及中止标准:(1)转移性肝癌患者;(2)手术涉及胃肠道患者;(3)有脑部、心肺疾病等合并症;(4)术后神志、意识不清患者;(5)出现严重并发症(大出血、胆瘘、肝功能衰竭等)。按随机数字表法将患者分为观察组和对照组,每组60例。两组患者的一般资料及术中资料的差异均无统计学意义(均P>0.05,表1),具有可比性。
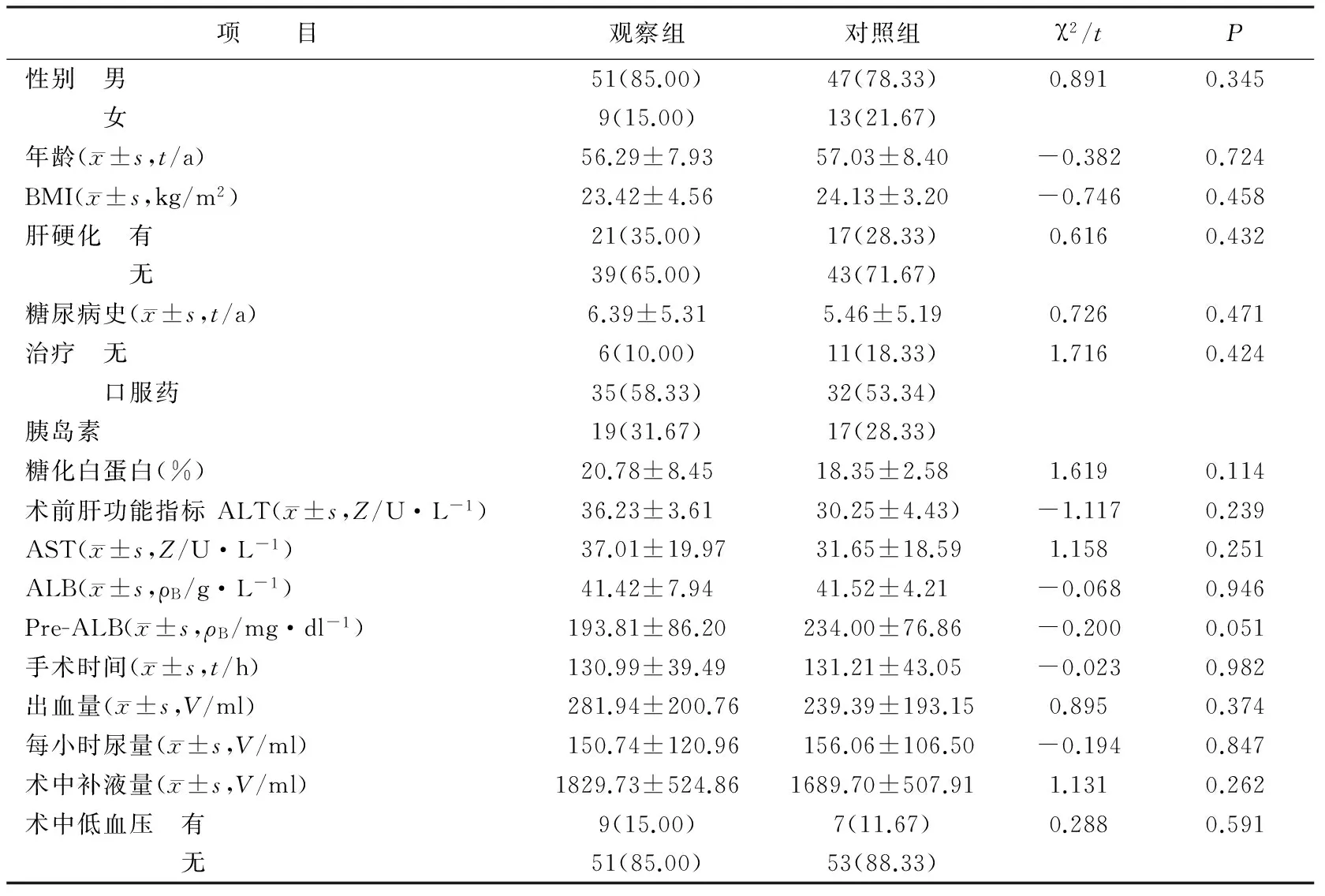
表1 两组患者一般资料及术中资料比较[N=60,n(%)]
注:丙氨酸氨基转移酶(alanine aminotransferase,ALT);天门冬氨酸转移酶(aspartate aminotransferase,AST);白蛋白(albumin,ALB);前白蛋白(prealbumin,Pre-Alb)
1.2 方法 观察组患者术后4~6 h夹闭胃管,分次饮温水,1次/2 h,20 ml/次。观察患者有无恶心、呕吐、腹胀、腹痛等不适,根据评估情况,于术后12 h鼓励患者进食米汤、果汁等流质,30 ml/次,1次/3~4 h。术后24 h拔除胃管后进食稀饭等半流质,根据胃肠道功能恢复情况逐步过渡到普食(糖尿病饮食)。对照组患者术后常规留置胃管,待肛门恢复排气后进食流质,逐步过渡到半流质、普食(糖尿病饮食)。
1.3 观测指标及判断标准 (1)两组患者术后一般情况观察指标,主要包括首次进水时间、首次进流质时间、肠鸣音恢复时间、首次排气时间、首次排便时间、相关并发症发生情况、术后住院天数等。两组患者术后均进行听诊肠鸣音恢复情况,1次/6 h。(2)两组患者术后主观指标,主要包括恶心、呕吐、腹部不适、食欲情况、口渴、饥饿、焦虑等。其中恶心、呕吐、腹部不适均以“有”或“无”来表示。腹部不适是指患者出现腹部不适空虚疼痛感[5]。食欲情况为分为“好”、“一般”、“差”3个等次。口渴、饥饿、焦虑评估均采用0~3分计分法。口渴:0分,无口渴;1分,稍有口渴;2分,口渴明显但可忍受;3分,非常口渴,要求喝水并有口唇干燥体征。饥饿: 0分,无饥饿;1分,稍有饥饿;2分,饥饿明显但可忍受;3分,非常饥饿,不能忍受或出现头晕,出冷汗等症状。焦虑:0分,无焦虑;1分,稍有焦虑;2分,焦虑明显;3分,非常焦虑,需予镇静剂。上述指标在两组患者术后的术后6、12、24、48 h分别测得,以患者的主观感受为准。(3)围术期糖代谢、应激及肝功能指标变化。主要包括血清C肽、血清胰岛素、C反应蛋白(C reactive protein,CRP)、ALT、AST、ALB、Pre-ALB、胰岛素抵抗指标(insulin resistance index,IR)[6]、血胰岛素(fasting insulin,FINS)等。
2 结果
2.1 两组患者术后一般情况观察指标的比较 两组患者术后开始进水时间分别为术后(6.34±0.88)h、(57.73±17.70)h,差异有统计学意义(P<0.01);进流质时间分别为(13.18±3.20)、(77.88±17.74)h,差异有统计学意义(P<0.01)。观察组患者术后肠鸣音恢复时间、首次排气时间、首次排便时间均小于对照组,差异均有统计学意义(均P<0.01)。观察组患者术后并发胸腔积液3例、腹腔积液5例、切口裂开1例;对照组患者术后并发胸腔积液4例,腹腔积液5例,切口裂开、切口脂肪液化、切口感染、急性肾功能衰竭、肺部感染各1例。两组患者并发症发生及术后住院天数的差异无统计学意义(均P>0.05,表2)。
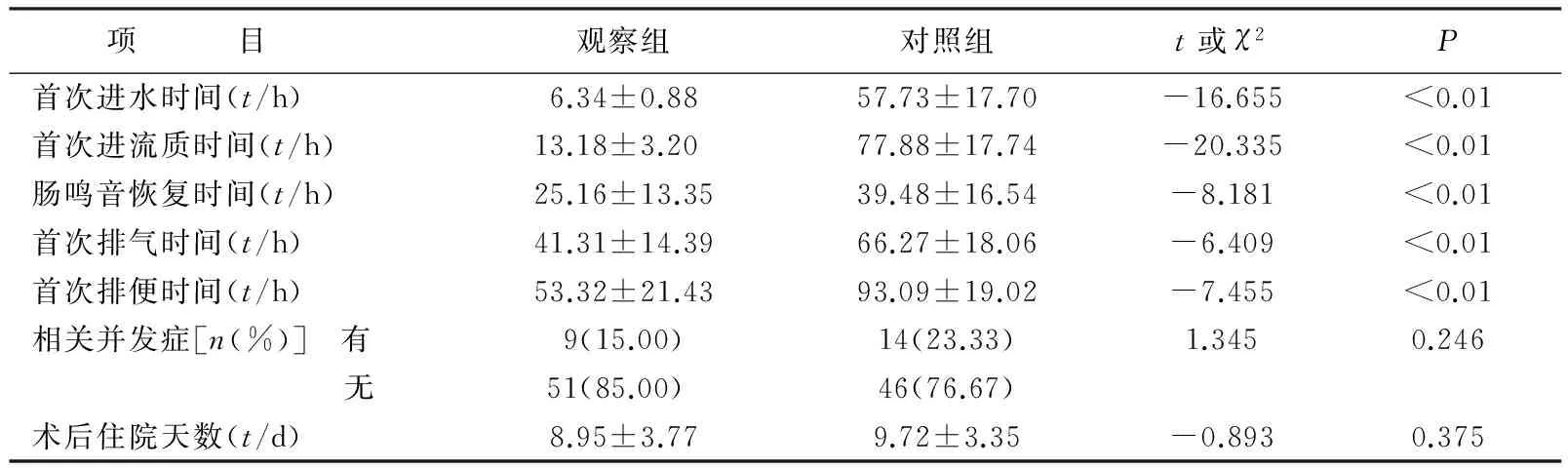
表2 两组患者术后一般情况观察指标的比较(N=60,x±s)
2.2 患者术后主观指标的比较 术后6 h,两组患者在饥饿感方面的差异有统计学意义(P=0.009);术后12 h,两组患者在口渴感和食欲情况方面的差异均有统计学意义(均P<0.05);术后24 h,两组患者在口渴、焦虑感、食欲情况等方面的差异均有统计学意义(均P<0.01);术后48 h,两组患者在口渴、饥饿、焦虑感、腹部不适情况、食欲情况等方面的差异均有统计学意义(P<0.01或P<0.05,表3)。
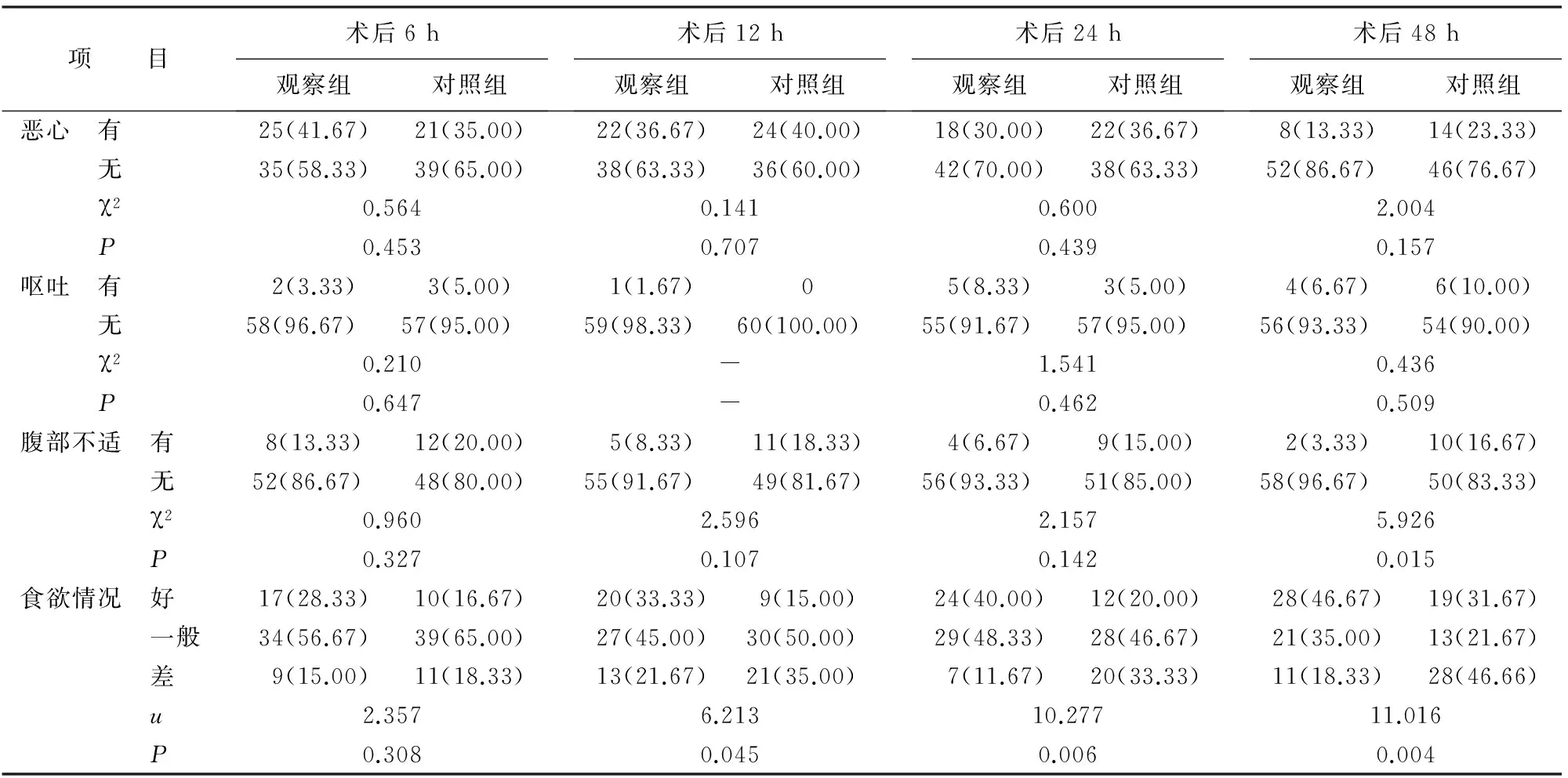
表3 两组患者术后主观指标比较[n(%)]
续表3
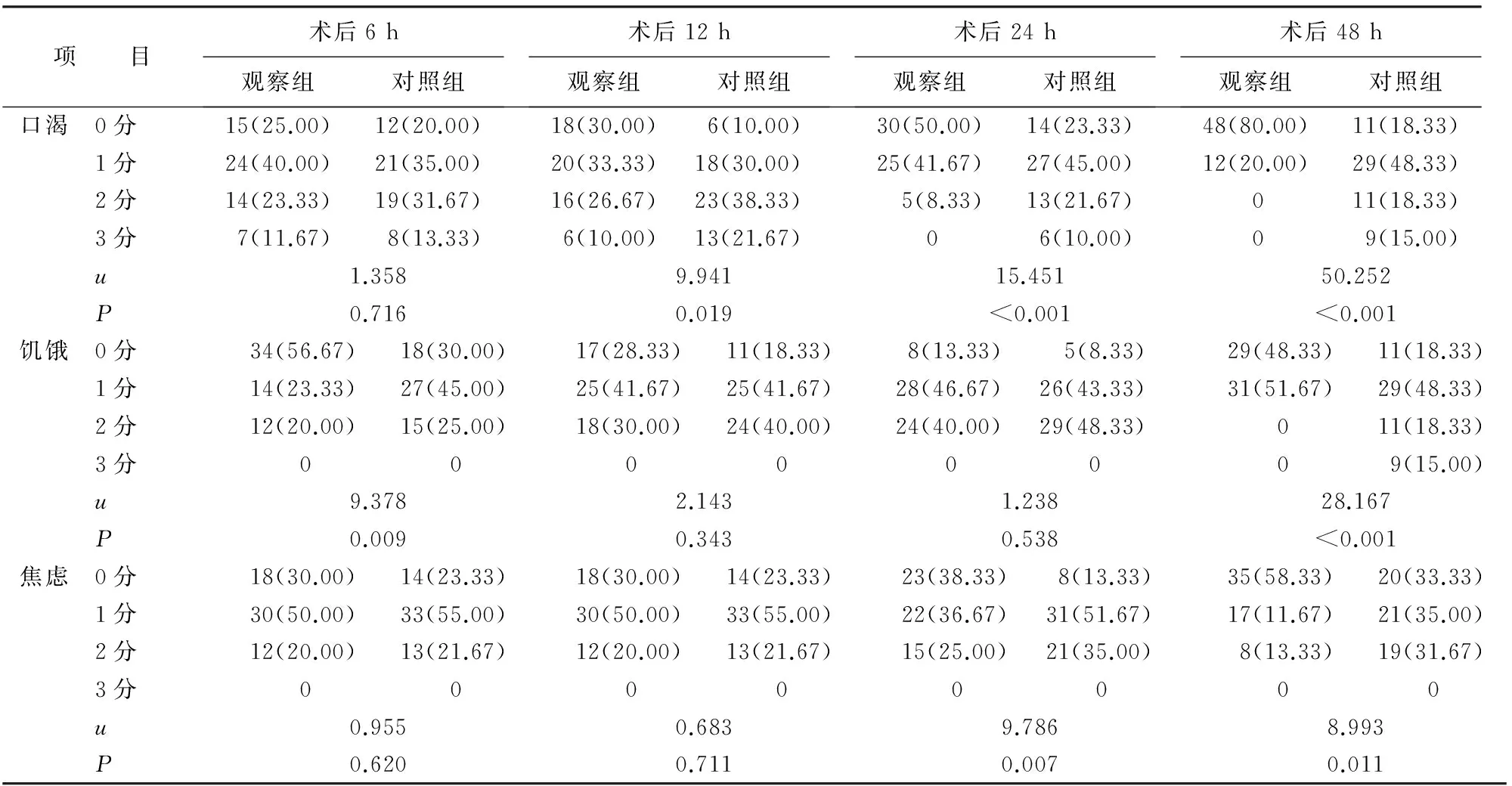
项 目术后6h观察组对照组术后12h观察组对照组术后24h观察组对照组术后48h观察组对照组口渴 0分15(25.00)12(20.00)18(30.00)6(10.00)30(50.00)14(23.33)48(80.00)11(18.33) 1分24(40.00)21(35.00)20(33.33)18(30.00)25(41.67)27(45.00)12(20.00)29(48.33) 2分14(23.33)19(31.67)16(26.67)23(38.33)5(8.33)13(21.67)011(18.33) 3分7(11.67)8(13.33)6(10.00)13(21.67)06(10.00)09(15.00) u1.3589.94115.45150.252 P0.7160.019<0.001<0.001饥饿 0分34(56.67)18(30.00)17(28.33)11(18.33)8(13.33)5(8.33)29(48.33)11(18.33) 1分14(23.33)27(45.00)25(41.67)25(41.67)28(46.67)26(43.33)31(51.67)29(48.33) 2分12(20.00)15(25.00)18(30.00)24(40.00)24(40.00)29(48.33)011(18.33) 3分00000009(15.00) u9.3782.1431.23828.167 P0.0090.3430.538<0.001焦虑 0分18(30.00)14(23.33)18(30.00)14(23.33)23(38.33)8(13.33)35(58.33)20(33.33) 1分30(50.00)33(55.00)30(50.00)33(55.00)22(36.67)31(51.67)17(11.67)21(35.00) 2分12(20.00)13(21.67)12(20.00)13(21.67)15(25.00)21(35.00)8(13.33)19(31.67) 3分00000000 u0.9550.6839.7868.993 P0.6200.7110.0070.011
2.3 围术期糖代谢、应激及肝功能指标变化的比较 采用重复测量方差分析对两组患者不同时间点的各项指标进行比较。结果显示,时间因素对血清胰岛素、IR指标、C反应蛋白、ALT、AST、Pre-ALB均存在主效应(P<0.05,P<0.01);干预因素对C反应蛋白、IR指标、血清C肽存在主效应(P<0.05),干预因素和时间因素对IR指标及C反应蛋白存在交互作用(P<0.05)。具体情况见表4。
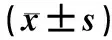
表4 围术期糖代谢、应激及肝功能指标变化的比较
a:P<0.05,各项目组内不同时间点比较;b:P<0.05,各项目同一时间点组间比较;c:P<0.05,干预因素和时间因素存在交互作用
3 讨论
肝脏是维持体内血糖平衡的重要器官,肝功能受损严重时易导致糖代谢紊乱。据报道[5,7],肝炎患者合并糖尿病发生率达10.9%~21.2%;肝硬化合并糖尿病发生率是正常人的2~4倍。此类患者围术期长时间禁食水不仅会导致口渴,饥饿、焦虑、烦躁等主观感受,还易使血糖水平剧烈波动,造成微血管、神经、肾脏等组织器官的损伤,各种急慢性并发症的发生[8]。近年来,FTS理念已推广应用于肝胆外科领域。肝癌手术不损害胃肠道结构与功能,患者术后早期经口进食不仅可为机体补充营养,还可促进胃肠道蠕动。此外,早期进食可加速门静脉系统的血液循环,使营养因子直接进入肝脏,利于肝功能修复。同时,胃肠道激素的分泌也可促肝脏再生,维持与促进肝功能恢复[3]。相关研究[3]指出,肝癌术后早期进食是安全可行的,对促进术后康复有重要意义。
3.1 早期进食水对术后应激、糖代谢的影响 CRP是评价创伤应激反应、炎症反应的敏感指标[9]。IR指组织细胞对胰岛素的敏感性和反应性降低,其典型表现是高血糖和高胰岛素血症并存。术后IR可增加菌血症、感染等并发症发生率和病死率[4]。C肽是胰岛B细胞分泌的多肽,在血中清除速度相对较慢,不受肝脏酶灭活及外源性胰岛素影响,对已使用胰岛素治疗或已产生胰岛素抗体的糖尿病患者,C肽的测定对评价内源性胰岛素的分泌能力更有意义。较高的C肽水平对2型糖尿病周围神经病变有保护作用[10]。本研究结果显示,观察组C肽、IR指标及C反应蛋白较对照组明显改善,提示术后早期进食水可减轻术后应激及IR,并且维持较高的C肽水平,预防患者术后内环境紊乱。
3.2 早期进食水的安全性及对主观感受的影响 本研究中观察组有3例(5%)患者因术后12 h进食米汤后发生恶心、腹胀,给予开放胃管后症状缓解,24 h 拔除胃管进食米汤后无恶心、腹胀等情况。观察组无一例患者因早期进水进食而发生相关并发症;且两组患者恶心、呕吐的发生率差异无统计学意义(P>0.05),故术后早期进食水对肝外科合并糖尿病患者是安全的。随着禁食、禁水时间的延长,对照组患者多数出现明显的口渴、饥饿、焦虑、腹部不适等感受。经比较,观察组患者术后6 h饥饿感,术后12 h口渴、食欲情况,术后24 h口渴、焦虑、食欲情况,术后48 h口渴、饥饿、焦虑、腹部不适情况、食欲情况较对照组改善,提示早期进食对患者的主观感受有明显的改善作用。
3.3 早期进食水对术后肝功能及预后的影响 有研究[11]表明,术后6 h小肠即可恢复正常蠕动,术后早期小肠内液体就开始被重吸收,术后24 h胃蠕动恢复正常。研究[12]提出,胃肠道手术可不常规使用留置胃肠减压管(除非术前有胃肠道梗阻)并支持术后早期进食,这是安全、可行的,在一定程度上有利于患者术后快速康复。本研究结果显示,观察组患者术后肠鸣音恢复时间、排气和排便时间较对照组明显提前,证实术后早期进食水可促进胃肠蠕动恢复,加速患者术后康复进程。观察组患者术后并发症率、住院天数较对照组减少,但差异无统计学意义。另外,也未发现早期进食水对术后ALT、AST、ALB、Pre-ALB变化的影响,可能与本研究样本量较小有关。对于预后的影响效果仍需更大样本量的研究进一步证实。
4 小结
本研究显示,肝癌合并糖尿病患者术后早期进食水是安全可行的。应遵循小剂量开始、少量多餐的原则,初期以改善患者口渴、饥饿、焦虑等主观感受,促进胃肠蠕动为主要目的,逐步提供营养,减轻术后应激及IR,促进机体代谢和肝功能的恢复。
[1] Varadhan K K,Neal K R,Dejong C H,et al.The enhanced recovery after surgery (ERAS) pathway for patients undergoing major elective opencolorectal surgery:A meta-analysis of randomized controlled trials[J].Clin Nutr,2010,29(4):434-440.
[2] Veenhof A A,Vlug M S,van der Pas M H,et al.Surgical stress response and postoperative immune function after laparoscopy or open surgery with fast track orstandard perioperative care:A randomized trial[J].Ann Surg,2012,255(2):216-221.
[3] 石泽亚,刘小明,袁艳萍,等.早期进食对加速肝癌手术患者康复的影响[J].护士进修杂志,2009,24(4):300-302.
[4] Ni C Y,Yang Y,Chang Y Q,et al.Fast-track surgery improves postoperative recovery in patients undergoing partial hepatectomy for primary liver cancer:A prospective randomized controlled trial[J].EJSO,2013,39(6):542-547.
[5] 邵清,陈国凤,李梵.慢性丙型肝炎病毒感染者2型糖尿病流行病学调查[J].肝脏,2007,12(5):366-367.
[6] Wallace T M,Levy J C,Matthews D R.Use and abuse of HOMA modeling[J].Diabetes Care,2004,27(6):1487-1495.
[7] Kuriyama S,Miwa Y,Fukushima H,et a1.Prevalence of diabetes and incidence of angiopathy in patients with chronic viral liver disease[J].J Clin Biochem Nutr,2007,40(2):l16-122.
[8] Shamsuddin A,Paul G B,Silvio E I.Scientific principles and clinical implications of perioperative glucose regulation and control[J].Anesth Analg,2010,11(2):478-497.
[9] Miller R J,Sutherland A G,Hutchison J D,et al.C-reactive protein and interleukin 6 receptor in post-traumatic stress disorder:A pilot study[J].Cytokine,2001,13(4):253-255.
[10]吕坤,范立新.岳枫.电化学发光免疫分析测定胰岛素C肽在2型糖尿病诊断中的应用[J].中国实用医药,2013,8(14):122-123.
[11]Nelson R,Tase B,Edwas S.Systematic review of prophylactic nasogastric decompression after abdominal operations[J].Br J Surg,2005,92(6):673-680.
[12]Gralla O,Haas F,Knoll N,et al.Fast track surgery in laparoscopic radical prostatectomy:Basic principles[J].World J Urol,2007,25(2):185-191.
(本文编辑:郁晓路)
Postoperative Drinking and Eating Program for Patients with Liver Cancer Combined Diabetes
Lu Lihua1,Chen Cui1,Fu Li2,Ji Danni1,Wang Kui1,Shi Lehua1,Ye Zhixia2(1.Department of Hepatic Surgery Ⅳ,Eastern Hepatobiliary Surgery Hospital Affiliated to Second Military Medical School,Shanghai 200433,China; 2.Nursing Department,Eastern Hepatobiliary Surgery Hospital Affiliated to Second Military Medical School)
Ye Zhixia,E-mail:ehbhhlb@163.com
Objective To explore a suitable drinking and eating program for patients with liver cancer combined with diabetes.Methods By convenience sampling,120 patients were selected and equally divided into observation group and control group.Patients in observation group had clip gastric tube after 4h to 6h in postoperative period,and drank warm water,given liquid diet after 12h,removed gastric tube after 24h. Patients in control group had conventional gastric intubation,and then gradually transition to full diet.Compare two groups of patients with postoperative metabolism,stress and changes of liver function indexes.Results The observation group patients’ first flatus and defecation time after operation was earlier than the control group (allP<0.01).The hunger in 6 h after operation,thirst and appetite in 12h,thirst,anxiety and appetite in 24 h,thirst,hunger,anxiety,abdominal discomfort feelings and appetite in 48 h in postoperative period of observation group were improved compared with which in control group (P<0.05 orP<0.01).The comparison of each index in different time point between two groups,of which the time factor had main effect in serum insulin,IR index,C-reactive protein values,alanine aminotransferase,aspartate aminotransferase and prealbumin (P<0.05 orP<0.01).Intervention factor had main effect in C-reactive protein values,IR index and serum C-peptide values (P<0.05).The intervention factor and time factor had interactive effect in IR index and C-reactive protein values(P<0.05).Conclusion Early drinking and eating program in postoperative period can help to improve the objective feeling of patients.
liver cancer; diabetes; perioperative; early diet
2015-01-19
2015-07-10
第二军医大学青年启动基金资助项目
陆丽华,本科,主管护师,研究方向为肝胆外科临床护理及护理管理
叶志霞,E-mail:ehbhhlb@163.com
10.3969/j.issn.1008-9993.2015.21.002
R735.7
A
1008-9993(2015)21-0006-05
(2011QN21)

