聚肌胞免疫刺激下仔猪外周血单核细胞的基因表达分析
王彦平,王怀中,郭建凤,王海飞,刘剑锋,王继英. 山东省农业科学院畜牧兽医研究所,山东省畜禽疫病防治与繁育重点实验室,济南 5000;. 中国农业大学动物科技学院,农业部畜禽遗传育种与繁殖重点实验室,北京 0093
聚肌胞免疫刺激下仔猪外周血单核细胞的基因表达分析
王彦平1,王怀中1,郭建凤1,王海飞2,刘剑锋2,王继英1
1. 山东省农业科学院畜牧兽医研究所,山东省畜禽疫病防治与繁育重点实验室,济南 250100;2. 中国农业大学动物科技学院,农业部畜禽遗传育种与繁殖重点实验室,北京 100193
聚肌胞(Poly I:C)是一种天然双链RNA(Double strand RNA, dsRNA)的拟似物,能够模拟病毒感染后所形成的 dsRNA及刺激机体产生抗病毒免疫反应。文章以抗病力存在差异的大蒲莲和长白仔猪为研究对象,分离外周血单核细胞(Peripheral blood mononuclear cell, PBMC),在20 μg/mL的Poly I:C的免疫刺激下体外培养24 h,对影响免疫应答过程中的7个细胞因子(IRF3、IL6、IL8、IL10、TNFα、IFNγ和IFNα)和3个模式识别受体(TLR3、TLR4和RIG1)利用实时荧光定量PCR检测Poly I:C免疫刺激组相对于对照组的基因表达变化倍数。结果表明:检测的大部分细胞因子和受体(6个)表达量变化倍数很大,其中3种白细胞介素IL6、IL8和IL10免疫刺激变化倍数最大,平均变化倍数分别为 20.71、10.87和5.18倍。对不同个体和品种间的比较发现,不仅大蒲莲和长白两品种间(大蒲莲猪的变化倍数平均高于长白猪)而且同品种的3头全同胞仔猪间对Poly I:C免疫刺激的应答也存在较大的变化。文章利用Poly I:C体外模拟dsRNA对PBMC的感染,为下一步筛选仔猪对Poly I:C刺激的免疫应答基因及鉴定大蒲莲猪特殊的抗性基因奠定了基础。
聚肌胞;外周血单核细胞;细胞因子;模式识别受体
动物的血液由血浆和有形细胞两大部分组成,不停地流动于动物机体的循环系统中,参与机体的代谢和免疫活动,与机体的免疫功能密切相关。而且因其采集方法简单,对机体的损伤小,是开展研究的重要组织材料。医学研究表明,血液的表达谱比皮肤、肌肉、肝、肾和脑等组织的表达谱能更好地反映免疫系统的状态[1,2]。其中,外周血单核细胞(Peripheral blood mononuclear cell,PBMC)主要指血液淋巴细胞和单核细胞,是血液细胞中转录最活跃的细胞。PBMC 可以体外培养并在免疫刺激的作用下,发生和体内相似的免疫应答,从而广泛应用于免疫学、传染病和心血管病、癌症和生物标志物的研究中[3,4]。
抗病力包括机体对病原体的防御能力和病原体入侵后的免疫应答能力,在正常的情况下表现不出来。利用活病原微生物作为免疫刺激源开展研究具有传播疾病的风险,受到较大限制,故在实际研究中一般选用和病原微生物作用机理相似的免疫刺激剂来替代。Poly I:C是聚肌苷酸和聚胞苷酸的共聚物,是一种人工合成的双链 RNA(Double strand RNA, dsRNA),作为天然 dsRNA的拟似物,能够模拟病毒感染后所形成的dsRNA,刺激机体产生抗病毒免疫反应和炎症反应[5,6]。Poly I:C在人和模式生物上的免疫作用机理已经比较清楚,它作为病原体模式分子被细胞上的模式识别受体识别后,通过衔接蛋白TICAM-1传导信号,从而激活干扰素调节因子3、NF-κB和AP-1的转录,诱导I型干扰素和促炎症细胞因子产生,激活自然杀伤性细胞和细胞毒性T淋巴细胞[7,8]。近年来,为研究蓝耳病、猪瘟和口蹄疫等传染病的发病机制和防治措施,Poly I:C逐渐作为天然dsRNA的拟似物模拟RNA病毒感染猪的致病机制研究[9~12]。但是,目前仅利用 Poly I:C 模拟dsRNA对猪PBMC的感染,免疫刺激对细胞因子和受体基因的表达变化的研究还未见报道。
我国大多数地方猪种在抗病性和免疫力方面明显优于国外猪种[13,14],但是人们对中外猪种抗病力差异的遗传基础和免疫机理却了解甚少。本研究以抗病力强的大蒲莲仔猪和抗病力弱的长白仔猪为研究对象,分离PBMC,利用Poly I:C免疫刺激,根据以往的研究报道,选择了Poly I:C免疫刺激下机体激活或者诱导表达的细胞因子,如促炎症细胞因子(IL6、IL8、TNFα)、抗炎症细胞因子(IL10),干扰素调节因子(IRF3)和干扰素(IFNα 和IFNγ),而且还选择了几个具有代表性的模式识别受体(TLR3、TLR4和 RIGI),采用实时荧光定量 PCR技术检测Poly I:C免疫刺激培养的猪PBMC的mRNA表达量,为RNA病毒感染的免疫应答调控机理研究、我国地方猪种高抗病力优异基因资源的挖掘及标记辅助抗病育种提供实验依据。
1 材料和方法
1.1 实验动物与样品采集
选择饲养在相同环境下的分娩日龄相近的大蒲莲和长白母猪各一窝,28日龄时断奶。仔猪达35日龄时,从每窝中分别选取 3头健康仔猪,前腔静脉采血20 mL 注入EDTAK2抗凝管中,颠倒混合均匀。
1.2 PBMC的分离
外周血单个核细胞的体积、形态和比重与外周血中其他细胞不同,利用密度介于1.075~1.090之间的聚蔗糖-泛影葡胺(GE healthcare)分离液,应用水平离心机,1500 r/min的离心速度下常温离心20 min,离心后管内液体分为 3层,在上、中层界面处有一以单个核细胞为主的白色云雾狭窄带,即为要分离的 PBMC。用移液器小心吸取白色雾状层,然后用PBS液洗涤两次以充分去除血小板等杂质。每头仔猪20 mL血液分离出的PBMC中加70 mL含10%胎牛血清的 RPMI-1640液(Hyclone),重新混悬细胞。台盼蓝拒染法进行细胞活力检测,并用细胞计数板进行细胞计数。
1.3 Poly I:C免疫刺激
将Poly I:C干粉(Sigma-Aldrich)溶于PBS中,稀释至浓度为2 mg/mL储存液,保存在-70℃备用。为保证 Poly I:C为双链 RNA结构,稀释液应加热至50℃,随后自然冷却至室温。
每头仔猪分离的70 mL的PBMC悬液平均分成2份,一份为免疫刺激组,添加2 mg/mL 的Poly I:C储存液350 μL,细胞悬液中Poly I:C终浓度为20 μg/mL,然后分装至2个150 cm2培养瓶中;另一份为对照组,35 mL的PBMC悬液直接分装于2个150 cm2培养瓶中。5% CO2浓度和37℃温度下培养24 h。
1.4 总RNA提取及反转录
培养24 h后,分别收集Poly I:C免疫刺激组和对照组的PBMC。利用RNAiso Plus(TaKaRa)提取样品的总RNA,用NanoDrop 2000分光光度计(赛默飞) 和Agilent 2100生物分析仪(安捷伦)检测RNA 的质量和浓度。取1 μg左右的RNA,先利用The Prime-Script RT reagent kit with gDNA Eraser (RR047A,TaKaRa)试剂盒中的gDNA Eraser降解RNA中残留的DNA,以避免RNA中残留的DNA对定量结果的影响,然后再利用该试剂盒中的 PrimeScript RT Enzyme反转录RNA为cDNA。qRT-PCR反应前,用双蒸水对cDNA溶液进行4倍稀释。
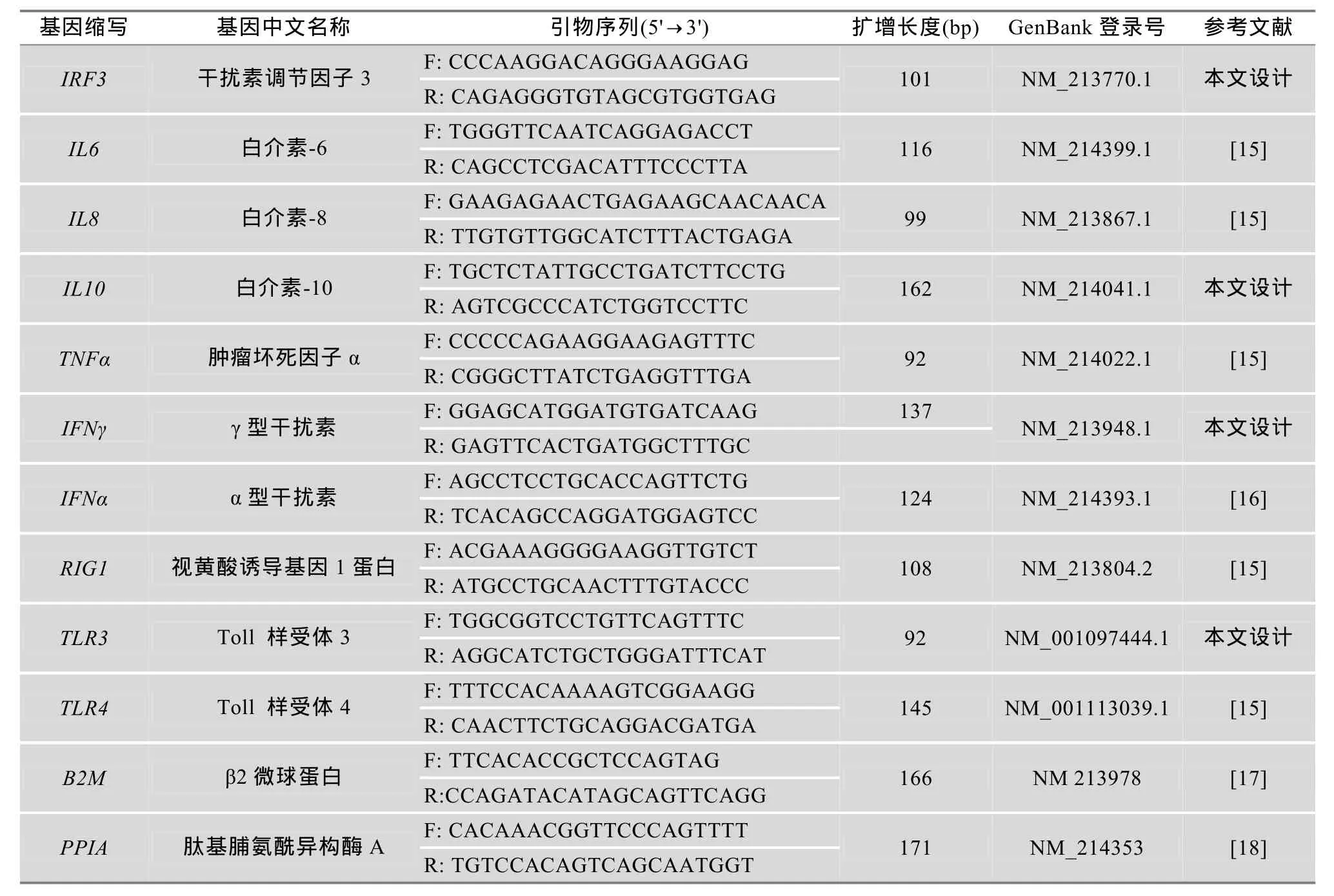
表1 细胞因子、模式识别受体基因和内参基因及其实时荧光定量PCR检测中所用的引物信息
1.5 引物设计合成和实时荧光定量PCR
对于基因IRF3、IL10、IFNγ和TLR3(GenBank登录号见表1),利用Primer Premier 5.0软件设计特异性引物,另外几个基因使用参考文献报道的引物序列[15~18]。内参基因选用 B2M和 PPIA。本课题组前期研究[19]表明,用Poly I:C免疫刺激猪PBMC,联合使用这两个内参基因进行数据的校正和标准化,能获得准确可靠的目的基因表达定量。本研究中所检测的各细胞因子、受体和内参基因信息以及所用的引物信息详见表1。
本研究采用的实时荧光定量试剂盒为 Light-Cycler®480 SYBR Green I Master(Roche公司),实时荧光定量仪器为 Roche公司的 Roche LightCycler®480。反应体系为20 μL,包括:Blue-SYBR-Green mix 10 μL,上、下游引物(10 pmol/L)各1 μL,cDNA 1 μL,双蒸水7 μL。扩增程序为:95℃预变性5 min;95℃变性10 s,60℃复性及延伸20 s,45个循环。每个样品设3个技术重复。
1.6 数据分析
利用 2-ΔΔCt相对定量分析法[20]进行各细胞因子和受体在 Poly I:C免疫刺激下相对表达量分析。2-ΔΔCt计算公式为 2-ΔΔCt=2-[(CT_target-CT_control)]sample A-[(CT_target-CT_control)]sample B。该公式中涉及两个基因的CT值:目的基因的 CT(CT_target)和内参基因的CT(CT_control),其中内参基因的CT采用T2M和PPIA的几何平均数。两个样品Sample A和Sample B分别为同一头仔猪PBMC样品的免疫刺激组和对照组。
2 结果与分析
2.1 PBMC分离与培养
利用密度梯度离心方法,每头仔猪20 mL血液分离出的PBMC重悬于70 mL含10%胎牛血清的RPMI-1640液(Hyclone)中,细胞浓度在2~5×106/mL。经台盼蓝染色后,400倍显微镜下观察,PBMC表面光滑,形态为大小不等的圆形细胞,其中 95%以上的PBMC为活细胞(图1A)。培养24 h后,PBMC沉到底部,但是轻轻晃动细胞瓶,大部分细胞从细胞壁中脱落漂浮。经台盼蓝染色后,免疫刺激组和对照组PBMC在400倍显微镜下均可见细胞内颗粒物质增多,细胞表面有锯齿状突起(图1B),但是Poly I:C免疫刺激组比对照组细胞表面突起和细胞内颗粒物质稍多。细胞形态的变化提示,PBMC在有无刺激剂存在的条件下体外培养24 h细胞的形态均会发生一定的变化,但是在免疫刺激剂的作用下其形态改变更为明显。

图1 Poly I:C免疫刺激前后PBMC的形态(×400倍)
2.2 细胞因子和受体免疫刺激表达变化
分光光度计和生物分析仪检测表明,各样品RNA 的 UV260/280在 2.0左右、UV260/230≥1.5、RIN≥7.0 和28S/18S > 0.7,表明所提取的RNA样品质量非常好,适合进行下一步实验。 而且表1中目标基因和参考基因引物的扩增曲线呈典型的“S”型,融解曲线在 85~90℃之间出现标准的单峰,而在其他位置未有任何峰出现,通过绘制标准曲线,目标基因和参考基因的标准曲线的扩增效率变化范围在 0.95~1.1之间,符合利用 2-ΔΔCt相对定量法进行表达量分析的要求。实时荧光定量PCR后,基于2-ΔΔCt相对定量分析方法,计算猪Poly I:C免疫刺激组相对对照组的相对表达量,具体结果见表2和图2。
从图2中可以看出:在本研究中所采用的免疫刺激浓度(20 μg/mL)和体外培养时间(体外培养24 h)下,除了4个基因(IFNα、RIG1、TLR3和TLR4)外,其他 6个基因均发生了明显表达量变化,但是因为个体间变异较大,差异均没有达到显著水平(t-检验,P>0.05)。总体来说,3种白细胞介素基因(IL6、IL8 和IL10)免疫刺激增加倍数最大,其中IL6最高(平均20.71倍),其次为IL8(平均为10.87),再次为IL10(平均5.18倍)。除了变化倍数较大的3种白细胞介素基因外,IFNγ和TNFα表达也有小量的增加,增加倍数平均分别为1.44和1.61倍。另外,本研究中,IRF3免疫刺激组的表达量为对照组表达量的0.66倍,表明免疫刺激组IRF3表达相比对照组的表达下降了。IFNα、RIG1、TLR3和TLR4这4个基因,虽然个别样本的表达有增加或者下降,但是6个个体的平均而言没有发生变化。
从图2还可以看出,不同个体PBMC对Poly I:C免疫刺激的应答变化很大。本研究中同一品种的 3个样本取自同一窝母猪,全同胞个体间,有的免疫刺激基因表达量变化很大,有的则相对较小。而且对于IL6、IL8和IL10这3种变化倍数很大的白细胞介素基因,大蒲莲猪的变化倍数平均高于长白猪,特别是大蒲莲猪中的DP19个体的表达量变化最大,IL6、IL8和IL10变化倍数分别达68.45,24.54和13.16倍。
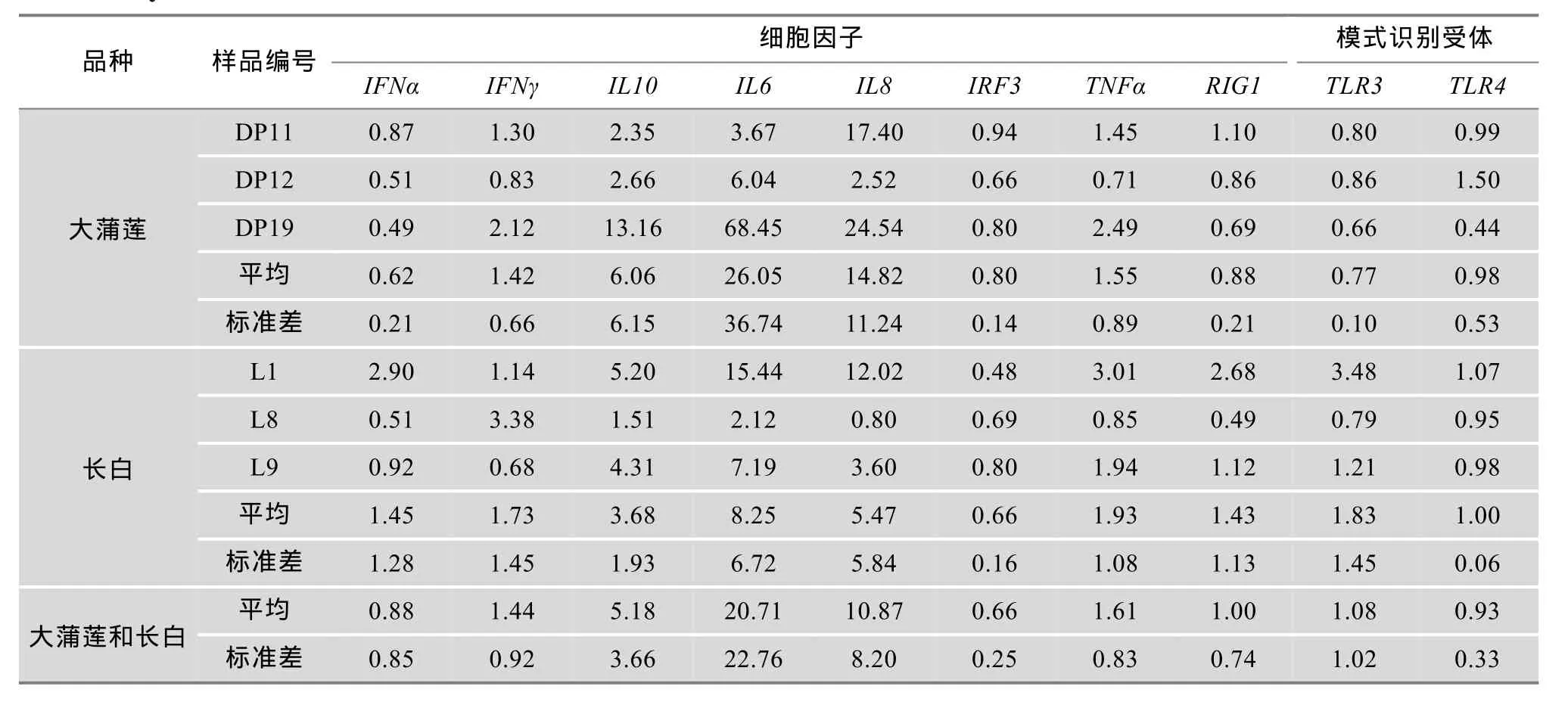
表2 Poly I:C免疫刺激24 h后细胞因子和受体的相对表达量

图2 Poly I:C免疫刺激24 h后细胞因子和受体的相对表达量柱形图
3 讨 论
猪是我国主要的肉食来源,对畜牧业生产和食品行业都尤为重要。此外,家猪在生理结构、行为学、营养需求以及遗传基础等方面比通常使用的其他实验动物(大鼠、小鼠等)更接近于人类,是人类疾病研究的理想模式动物;同时其器官大小和质量等被认为比灵长类动物更适合于异种器官移植。这使家猪在医学研究和药物试验上的具有重要意义,也因此推动了过去几十年内对猪免疫系统的研究。因此,对猪的免疫应答进行详细、全面的研究,不仅寻找有助于提高猪抗病力的基因,而且对提高猪的健康动物福利以及人类的健康都受益匪浅。
细胞因子是由活化的免疫细胞和非免疫细胞(如某些基质细胞)合成和分泌的能调节细胞生理功能,参与免疫应答和介导炎症反应等多种生物学效应的小分子多肽或糖蛋白。人和模式生物中的研究表明Poly I:C与特异性受体结合后,可以激活或者诱导一系列细胞因子的表达,如激活IRF3、NF-KB 和AP-1的转录,诱导I型干扰素和促炎症细胞因子产生,激活自然杀伤性细胞和细胞毒性T淋巴细胞[7,8]。本研究中,聚肌胞免疫刺激24 h后3种白细胞介素基因(IL6、IL8和IL10)表达量大幅度增加(5.18~20.71 倍),TNFα表达也有小量的增加(1.61倍),与以往研究中Poly I:C可以诱导促炎症细胞因子产生的结果相一致。但是,本研究中,除了个别个体外,IFNα没有检测到表达量没有变化,IRF3免疫刺激组测表达量比对照组的表达下降,这和以往报道中Poly I:C可以激活IRF3和诱导I型干扰素的报道不一致。对于本研究中一些细胞因子表达变化和以前人及模式动物中报道不一致的原因,一方面可能是由于免疫刺激试验中Poly I:C的添加浓度和免疫刺激培养时间引起的。以前研究中利用脂多糖(LPS)进行人和猪PBMC免疫刺激研究表明,细胞因子的表达水平受LPS浓度和刺激时间的影响[21,22]。另一方面,猪的PBMC在Poly I:C的免疫刺激下基因的表达变化和人及模式动物可能存在着大的差异。我们计划对本研究中收集的样本进行mRNA测序,一方面验证本研究基于qRT-PCR检测的细胞因子和受体的基因表达结果,另一方面进一步挖掘猪PBMC对Poly I:C免疫刺激的应答基因,特别是大蒲莲猪特异的免疫应答基因。
本研究结果显示对于IL6、IL8和IL10这3种变化倍数很大的白细胞介素基因,大蒲莲猪的变化倍数平均高于长白猪。大蒲莲猪是山东省体型较大的华北型黑猪,具有抗病耐粗、高繁性、肉质好等优良特性,特别是对猪繁殖与呼吸障碍综合症(PRRS) 等 RNA 类型的病原表现出强抗病力[23,24]。大蒲莲仔猪对Poly I:C免疫刺激表现出的大的应答变化可能是其对RNA类病毒高抗病力的原因之一。另外,本研究中同品种的3头全同胞仔猪间对Poly I:C免疫刺激的应答也存在很大变化。Clapperton等[13]对梅山和大白猪的淋巴细胞、中性粒细胞、单核细胞以及急性时相蛋白等免疫指标的检测表明两个品种的猪种间存在显著的差别;Kapetanovic 等[25]利用5个品种 8~12周龄的仔猪巨噬细胞进行LPS刺激试验,研究表明一些免疫相关基因在不同品种猪、同品种内不同的个体间存在显著的表达差异;本课题组以前利用324头38日龄的杜洛克公猪和二花脸母猪构建的F2资源群体,活体肌肉内注射Poly I:C进行免疫刺激,发现免疫刺激前后T淋巴细胞亚群、血常规,IL10和IFNγ等水平在群体内存在很大变化[9]。本研究及上述这些研究均表明不同品种、同品种不同个体之间存在抗病力的遗传差异,由此不少育种学家提出从遗传角度通过育种措施来提高畜禽抗病力[26,27],这一观点被普遍接受。
本研究表明,在20 μg/mL的Poly I:C浓度下体外培养24 h,猪PBMC发生了明显的免疫应答。但是,本研究中所检测的细胞因子和受体只是免疫应答过程基因中的一部分,而且每个猪种只有3个生物学重复,样本数偏少,故本研究只是初步的探索,需要进一步扩大样本量对试验结果进一步验证。
[1]Chaussabel D, Pascual V, Banchereau J. Assessing the human immune system through blood transcriptomics. BMC Biol, 2010, 8(1): 84.
[2]Ramilo O, Allman W, Chung W, Mejias A, Ardura M, Glaser C, Wittkowski KM, Piqueras B, Banchereau J, Palucka AK, Chaussabel D. Gene expression patterns in blood leukocytes discriminate patients with acute infections. Blood, 2007, 109(5): 2066-2077.
[3]Gao Y, Flori L, Lecardonnel J, Esquerré D, Hu ZL, Teillaud A, Lemonnier G, Lefèvre F, Oswald IP, Rogel-Gaillard C. Transcriptome analysis of porcine PBMCs after in vitro stimulation by LPS or PMA/ionomycin using an expression array targeting the pig immune response. BMC Genomics, 2010, 11: 292.
[4]Mian MF, Stämpfli MR, Mossman KL, Ashkar AA. Cigarette smoke attenuation of poly I: C-induced innate antiviral responses in human PBMC is mainly due to inhibition of IFN-βproduction. Mol Immunol, 2009, 46(5): 821-829.
[5]Lion E, Anguille S, Berneman ZN, Smits ELJM, Van Tendeloo VFI. Poly (I: C) enhances the susceptibility of leukemic cells to NK Cell cytotoxicity and phagocytosis by DC. PLoS One, 2011, 6(6): e20952.
[6]Trapp S, Derby NR, Singer R, Shaw A, Williams VG, Turville SG, Bess JW, Lifson JD, Robbiani M. Doublestranded RNA analog poly (I: C) inhibits human immunodeficiency virus amplification in dendritic cells via type I interferon-mediated activation of APOBEC3G. J Virol, 2009, 83(2): 884-895.
[7]Kato H, Takeuchi O, Sato S, Yoneyama M, Yamamoto M, Matsui K, Uematsu S, Jung A, Kawai T, Ishii KJ, Yamaguchi O, Otsu K, Tsujimura T, Koh CS, Reis e Sousa C, Matsuura Y, Fujita T, Akira S. Differential roles of MDA5 and RIG-I helicases in the recognition of RNA viruses. Nature, 2006, 441(7089): 101-105.
[8]Matsumoto M, Seya T. TLR3: interferon induction by double-stranded RNA including poly (I: C). Adv Drug Deliv Rev, 2008, 60(7): 805-812.
[9]王继英. 猪免疫性状的全基因组关联分析及拷贝数变异的检测[学位论文]. 北京: 中国农业大学, 2012.
[10]Cao YM, Lu ZJ, Li YL, Sun P, Li D, Li PH, Bai XW, Fu YF, Bao HF, Zhou CX, Xie BX, Chen YL, Liu ZX. Poly (I: C) combined with multi-epitope protein vaccine completely protects against virulent foot-and-mouth disease virus challenge in pigs. Antiviral Res, 2013, 97(2): 145-153.
[11]Wang XS, Ao H, Zhai LW, Bai LJ, He WY, Yu Y, Wang CD. Genome-wide effects of DNA methyltransferase inhibitor on gene expression in double-stranded RNA trans-fected porcine PK15 cells. Genomics, 2014, 103(5-6): 371-379.
[12]Liu XD, Huang J, Yang SB, Zhao YX, Xiang AJ, Cao JH, Fan B, Wu ZF, Zhao JL, Zhao SH, Zhu MJ. Whole blood transcriptome comparison of pigs with extreme production of in vivo dsRNA-induced serum IFN-a. Dev Comp Immunol, 2014, 44(1): 35-43.
[13]Clapperton M, Bishop SC, Glass E. Innate immune traits differ between Meishan and Large White pigs. Vet Immunol Immunopathol, 2005, 104(3-4): 131-144.
[14]Sutherland MA, Rodriguez-Zas SL, Ellis M, Salak-Johnson JL. Breed and age affect baseline immune traits, cortisol, and performance in growing pigs. J Anim Sci, 2005, 83(9): 2087-2095.
[15]Skovgaard K, Mortensen S, Poulsen KT, Angen Ø, Heegaard PMH. Validation of putative reference genes for qRT-PCR normalization in tissues and blood from pigs infected with Actinobacillus pleuropneumoniae. Vet Immunol Immunopathol, 2007, 118(1-2): 140-146.
[16]Wikström FH, Fossum C, Fuxler L, Kruse R, Lövgren T. Cytokine induction by immunostimulatory DNA in porcine PBMC is impaired by a hairpin forming sequence motif from the genome of Porcine Circovirus type 2 (PCV2). Vet Immunol Immunopathol, 2011, 139(2-4): 156-166.
[17]Martino A, Cabiati M, Campan M, Prescimone T, Minocci D, Caselli C, Rossi AM, Giannessi D, Del Ry S. Selection of reference genes for normalization of real-time PCR data in minipig heart failure model and evaluation of TNF-α mRNA expression. J Biotechnol, 2011, 153(3-4): 92-99.
[18]Cinar MU, Islam MA, Pröll M, Kocamis H, Tholen E, Tesfaye D, Looft C, Schellander K, Uddin MJ. Evaluation of suitable reference genes for gene expression studies in porcine PBMCs in response to LPS and LTA. BMC Res Notes, 2013, 6: 56.
[19]Wang JY, Wang YP, Wang HZ, Hao XJ, Wu Y, Guo JF. Selection of reference genes for gene expression studies in porcine whole blood and peripheral blood mononuclear cells under polyinosinic: polycytidylic acid stimulation. Asian Australas J Anim Sci, 2014, 27(4): 471-478.
[20]Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta (CT)) method. Methods, 2001, 25(4): 402-408.
[21]Sorensen NS, Skovgaard K, Heegaard PM. Porcine blood mononuclear cell cytokine responses to PAMP molecules: comparison of mRNA and protein production. Vet Immunol Immunopathol, 2011, 139(2-4): 296-302.
[22]Uddin MJ, Nuro-Gyina PK, Islam MA, Tesfaye D, Tholen E, Looft C, Schellander K, Cinar MU. Expression dynamics of Toll-like receptors mRNA and cytokines in porcine peripheral blood mononuclear cells stimulated by bacterial lipopolysaccharide. Vet Immunol Immunopathol, 2012, 147(3-4): 211-222.
[23]Jiang CL, Xing F, Xing JY, Jiang YL, Zhou E. Different expression patterns of PRRSV mediator genes in the lung tissues of PRRSV resistant and susceptible pigs. Dev Comp Immunol, 2013, 39(1-2): 127-131.
[24]Xing JY, Xing F, Zhang CH, Zhang YJ, Wang N, Li YP, Yang LJ, Jiang CL, Zhang CY, Wen CH, Jiang YL. Genome-Wide gene expression profiles in lung tissues of pig breeds differing in resistance to porcine reproductive and respiratory syndrome virus. PloS One, 2014, 9(1): e86101.
[25]Kapetanovic R, Fairbairn L, Downing A, Beraldi D, Sester DP, Freeman TC, Tuggle CK, Archibald AL, Hume DA. The impact of breed and tissue compartment on the response of pig macrophages to lipopolysaccharide. BMC Genomics, 2013, 14(1):581.
[26]Stear MJ, Bishop SC, Mallard BA, Raadsma H. The sustainability, feasibility and desirability of breeding livestock for disease resistance. Res Vet Sci, 2001, 71(1): 1-7.
[27]Clapperton M, Diack AB, Matika O, Glass EJ, Gladney CD, Mellencamp MA, Hoste A, Bishop SC. Traits associated with innate and adaptive immunity in pigs: heritability and associations with performance under different health status conditions. Genet Sel Evol, 2009, 41: 54.
(责任编委: 任 军)
Gene expression analysis of porcine peripheral blood mononuclear cell in response to immune stimulation of Poly I:C
Yanping Wang1, Huaizhong Wang1, Jianfeng Guo1, Haifei Wang2, Jianfeng Liu2, Jiying Wang1
1. Shandong Key Laboratory of Animal Disease Control and Breeding, Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences, Jinan 250100, China; 2. Key Laboratory of Animal Genetics, Breeding and Reproduction, Ministry of Agriculture, College of Animal Science and Technology, China Agricultural University, Beijing 100193, China
Polyinosinic-polycytidylic acid (Poly I:C) is an analogue of natural double strand RNA (dsRNA), which can simulate the viral dsRNA and stimulate the immune response. In the present study, peripheral blood mononuclear cells (PBMC) were isolated from piglets of Dapulian and Landrace with different disease resistance, and stimulated with 20 μg/mL Poly I:C for 24 hours in vitro culture. The expression of several cytokines (IL6, IL8, TNFα, IL10, IRF3, IFNα and IFNγ) and three pattern recognition receptors (TLR3, TLR4 and RIG1) was determined by qRT-PCR. The results showed that, most of the cyto-kines or receptors had obvious expression change compared with the control (without Poly I:C stimulation), especially the three cytokine genes IL6, IL8 and IL10, whose average expression change times were 20.71, 10.87 and 5.18, respectively. Expression comparison between breeds and among individuals of the same breed indicated that there was obvious difference not only between Dapulain and Landrace (Dapulain higher than Landrace) but also among the three individuals of the same breed. Our study simulated the infection of dsRNA to host cells using Poly I:C, and provided experimental foundation for further study on selecting the immune genes in response to Poly I:C stimulation and identifying the unique disease-resistance genes of Dapulian.
Polyinosinic-polycytidylic acid (Poly I:C); peripheral blood mononuclear cell (PBMC); cytokine; pattern recognition receptors
2014-03-10;
2014-05-05
国家自然科学基金项目(编号:31201779),山东省农业良种工程项目(编号:2011LZ13-01, 02),山东省优秀中青年科学家科研奖励
基金项目(编号:BS2013SW026)和山东省农业产业技术体系生猪创新团队建设项目(编号:SDAIT-06-011-03)资助
王彦平,硕士,助理研究员,研究方向:猪的遗传育种。E-mail: wangyanping03@163.com
王继英,博士,副研究员,研究方向:猪的遗传育种。E-mail: jnwangjiying@163.com
10.16288/j.yczz.2015.01.009
时间: 2014-9-24 10:33:30
URL: http://www.cnki.net/kcms/detail/11.1913.R.20140924.1056.005.html

