小鼠孤雌胚、体外培养胚与体内胚H3K9乙酰化模式的比较
陈利,丁芳,刘勇,吴风瑞,丁彪,王荣,李文雍
1. 安徽大学生命科学学院,合肥 230039;2. 胚胎发育与生殖调节安徽省重点实验室,阜阳 236041;3. 阜阳师范学院生物与食品工程学院,阜阳 236041
小鼠孤雌胚、体外培养胚与体内胚H3K9乙酰化模式的比较
陈利1,丁芳1,刘勇2,3,吴风瑞2,3,丁彪2,3,王荣2,3,李文雍2
1. 安徽大学生命科学学院,合肥 230039;2. 胚胎发育与生殖调节安徽省重点实验室,阜阳 236041;3. 阜阳师范学院生物与食品工程学院,阜阳 236041
孤雌胚胎的发育率比体内体外生成胚胎的发育率要慢,为研究小鼠孤雌胚、体外培养胚 H3K9乙酰化(H3K9ac)模式与体内自然胚之间的差异、曲古抑菌素 A(Trichostatin,TSA)对孤雌胚 H3K9乙酰化模式的影响及表观遗传模式对孤雌胚、体外培养胚发育的影响,文章采用间接免疫荧光法对小鼠植入前各时期孤雌胚、体外培养胚及体内自然胚基因组组蛋白的H3K9乙酰化水平进行检测。结果显示,植入前各时期孤雌胚H3K9乙酰化模式与体内组变化趋势基本一致,但平均荧光强度较体内组普遍偏高;经TSA处理后孤雌胚 H3K9乙酰化水平有所提高,原核期至8-细胞期差异显著(P<0.05)。体外培养胚H3K9乙酰化荧光强度与体内组变化趋势也基本一致,但平均荧光强度较体内组普遍偏低。以上结果表明,小鼠孤雌胚 H3K9乙酰化水平高于体内胚,使植入前胚胎发育过程中本应沉默的基因启动子发生超乙酰化,进而抑制胚胎发育,这可能是造成孤雌胚胎发育能力较差的重要原因之一;TSA处理可以部分弥补体外培养环境对胚胎发育带来的伤害,但TSA提高孤雌胚的发育能力可能并不完全是通过改变H3K9乙酰化水平来实现的。
表观遗传修饰;孤雌胚胎;H3K9乙酰化;曲古抑菌素A;小鼠
研究表明,受精后植入前胚胎的表观遗传修饰在个体发育进程中扮演着重要角色[1]。表观遗传修饰主要包括全基因组DNA甲基化、组蛋白修饰、染色质重塑等,这种修饰的研究主要集中于通过改变非基因序列进而影响调控基因表达水平变化的因素,难点之一是组蛋白修饰。组蛋白乙酰化和去乙酰化作为组蛋白修饰中的重要形式,可影响和改变染色质的结构,而染色质的结构又与生命活动密切相关,其在DNA复制、基因转录及细胞周期调控等方面起重要作用[2]。在基因转录水平上,组蛋白乙酰化(Acetylation, ac)可促进基因转录,去乙酰化(Deacetylation, dac)则抑制基因转录[3]。组蛋白乙酰化和去乙酰化分别由组蛋白乙酰化转移酶(Histone acetyltransferase, HAT)和组蛋白去乙酰化酶(Histone deacetylase, HDAC)催化[4],通过HAT与HDAC调控它们的动态平衡以控制染色质的结构,进而影响基因表达,若两种酶的功能发生紊乱或平衡失调将会影响个体后期的正常发育[5],甚至可引发某些疾病的发生[6]。组蛋白H3赖氨酸残基上K4、K9、K14、K16、K23、K27和K36等位点均可表现出乙酰化修饰,而第9位点的乙酰化(H3K9ac)在激活转录基因位点中起重要作用,该位点可以通过募集或者激活相关染色体修饰的复合体而达到激发另一位点乙酰化修饰的目的;其异常表达会使染色质结构发生改变, 进一步影响基因转录调控[7],同时H3K9ac表达异常与疾病发生也密切相关[8]。研究表明,H3K9ac大量存在于一些大的启动子附近[9]。
孤雌激活胚不仅可以作为核移植供体细胞的一种,也是胚胎干细胞中的一个重要来源[10]。孤雌胚胎干细胞(Pharthenotic embryonic stem cell, pESC)与正常胚胎干细胞一样,具有自我更新和多向分化的潜能。与自然胚相比,孤雌激活胚组蛋白乙酰化修饰出现异常。近年来,由于孤雌胚胎干细胞可以摆脱人胚胎干细胞面临的各种伦理问题,正渐渐成为研究热点[11]。而获得高质量的孤雌胚是成功分离、培养孤雌胚胎干细胞的前提。研究表明,体外培养小鼠原核胚会出现发育阻滞现象,以2~4细胞尤为显著[12]。与体内自然胚相比,体外培养胚的染色质乙酰化水平表现异常,胚胎发育率也较低,可能是其培养体系不完善导致表观遗传修饰发生改变所致[13]。通过在培养体系中添加组蛋白去乙酰化酶抑制剂曲古抑菌素A(TSA)可使发育能力有所改变,本课题组在前期研究过程中也得到类似结果[14]。
鉴于此,本研究分析了孤雌胚和体外培养胚H3K9ac水平,比较TSA处理前后该位点乙酰化水平变化规律,探讨了人为改变培养环境能否修正表观遗传修饰异常,本研究结果将为提高胚胎发育能力提供重要的实验依据。
1 材料和方法
1.1 实验动物
雌性昆明白小鼠(安徽医科大学实验动物中心),4~5周龄,饲养温度24±1℃,湿度50%~60%,光照14 h/d(8:00~22:00),自由采食,饮水。小鼠适应两周后投入实验。实验分为 3组:体内组、孤雌组和体外培养组。体内组和体外培养组中每组共雌鼠18只,重复3次,每次6只,每只小鼠平均可以取30枚MⅡ期卵母细胞,从原核期至囊胚期,每个时期30枚左右的胚胎。孤雌组中(分3小组)共使用54只雌鼠。
1.2 方法
1.2.1 体内组各时期胚胎的收集
6~8周龄雌鼠于当天17:00腹腔注射PMSG(孕马血清激素,宁波第二激素厂)10 IU,48 h后注射HCG(人绒毛膜促性腺激素,宁波第二激素厂)10 IU后,与健康雄鼠 1:1合笼。次日早上检查见栓,若见栓则假定该鼠受孕。于胚胎不同发育时期分别收集受精卵至囊胚的各期胚胎。
1.2.2 取体内原核胚胎的体外培养组
从激素注射至取受精卵步骤与1.2.1相同。将受精卵置于无糖CZB微滴中于培养箱中培养,胚胎发育至4-细胞移入含糖CZB(即CZBG)中,继续培养,于胚胎不同发育时期分别收集受精卵至囊胚的各期胚胎。
1.2. 3 孤雌激活组各时期胚胎的收集
激素注射步骤与1.2.1相同,不与雄鼠合笼。次日早上,在超净台中进行激活微滴(450 µL无钙CZB+0.25 µL (Cytochalasin B, CB)(Sigma公司),培养箱中平衡20~30 min;再加入50 µL的SrCl2),培养箱中平衡2 h。脱颈处死雌鼠,取卵母细胞移入培养皿(Corning公司)中激活微滴中培养;6 h后观察激活情况,记录原核率后,移入无糖CZB培养基中继续培养。1-细胞胚胎在激活后换液时收集,其他胚胎则继续培养至各期胚胎再收集。
1.2.4 TSA处理孤雌激活胚胎和体外培养胚胎
TSA 溶于二甲基亚砜(Dimethyl sulfoxide, DMSO),加入无糖CZB,终浓度为50 nmol/L,放置4 h后使用;体内原核胚胎和激活后的原核胚移入含有TSA的无糖CZB中培养20 h后,再移入正常的无糖CZB培养基中继续培养;DMSO组则是将体外培养胚和孤雌激活胚胎置于0.05% DMSO的CZB培养基中培养20 h后,再移入正常的无糖CZB培养基中继续培养。
1.2.5 间接免疫荧光检测各期各类胚胎 H3K9乙酰化模式
4%多聚甲醛固定各类胚胎,4℃过夜;0.1% PVA清洗胚胎,移至0.2% 的TritonX-100中,在培养箱(3111,Thermo)中通透1.5 h;1%BSA清洗胚胎,移至1%BSA溶液中,培养箱封闭1 h;接着将胚胎直接转移至一抗H3K9ac抗体(Epigentek Group Inc公司)中(1%BSA溶液l:100稀释的),培养箱中孵育过夜;次日早上用0.1% Tween 20和0.01% Triton X-100清洗胚胎,用FITC标记的二抗羊抗兔IgG-FITC(北京博奥森生物科技有限公司)(1:100)避光染色,培养箱孵育3 h;取出胚胎,0.1% PVA清洗,10 μg/mL 的 DAPI染液染色,避光室温 10 min;最后用0.1%PVA洗涤,固定在载玻片上,激光共聚焦显微镜(TCS-SP5, Leica)采集照片。
1.3 统计分析
采用Leica LAS AF Lite软件对所得图片进行转换,Image Pro-Plus 6.0软件对转换后的图片不同区域的荧光强度进行分析及数值转换,GraphPad Prism 5软件对所得数据分别作出对比柱状图、折线图及荧光图。用SPSS Statistics软件ANOVA进行单因素方差分析, 当P<0.05时认为具有显著性差异。
2 结果与分析
2.1 TSA处理前后小鼠孤雌胚胎和体外培养胚胎发育能力的比较
孤雌组 TSA处理前后相比,囊胚率有所提高(72.23±1.236%与57.31±0.5328%);体外培养组TSA处理前后相比,囊胚率也有所提高(89.70±0.529% 与79.26±1.058%),二者均表现出差异显著(P< 0.05)。孤雌胚的激活率为:正常组为 85.02%,TSA组为83.17%,DMSO组为89.01%。研究表明,该孤雌胚激活率处于正常发育水平,因此实验结果是可信的[15](表1)。

表1 小鼠植入前孤雌胚胎和体外培养胚胎经TSA处理前后2-、4-细胞和囊胚的发育率
2.2 植入前各时期孤雌激活胚胎、体外培养胚胎和体内胚胎H3K9乙酰化模式
孤雌组、体外培养组与体内组相比,孤雌组从原核期到囊胚阶段荧光强度始终高于体内组,体外培养组与体内组仅在原核期荧光强度值差异显著(P<0.05)。在体内组(图 1A)中,荧光强度总体趋势是先降低后升高,原核期荧光强度最大(0.12±0.018);仅在原核期与其它各期胚胎均表现出差异显著(P<0.05),而2-细胞、4-细胞、8-细胞、桑椹胚及囊胚各期之间差异均不显著。体外培养组(图 1B)荧光强度总体趋势是先降低后升高,桑椹胚时期达到最大荧光强度(0.06 ±0.004),桑椹胚与原核期、2-细胞、4-细胞、8-细胞差异显著(P<0.05),囊胚期与原核期及 4-细胞差异显著(P<0.05)。孤雌组(图 1C)中,原核期到 8-细胞时期荧光强度逐渐降低,桑椹胚期升高,这和体内胚总体趋势是一致的;原核期、2-细胞、4-细胞、8-细胞及囊胚期差异显著(P<0.05),而4-细胞、8-细胞与桑椹胚差异显著(P<0.05);结果表明(图1D),孤雌组和体外培养组胚胎与体内组总体趋势大致相同,但是植入前孤雌激活胚胎中 H3K9乙酰化模式和体内正常胚在 2-细胞和桑椹胚期存在着差异(P<0.05),体外培养胚胎中H3K9乙酰化模式和体内正常胚在原核期存在着差异(P<0.05)(图 2,绿色为组蛋白 H3K9乙酰化特异性表达位点,蓝色为DAPI复染的细胞核位置)。

图1 小鼠植入前孤雌胚、体外培养胚和体内胚组内及组间H3K9ac水平的半定量分析
2.3 植入前各时期孤雌激活胚胎H3K9乙酰化模式
孤雌DMSO组与孤雌组相比,两组总体趋势一致,从原核期至囊胚期阶段,两组乙酰化水平相当,药物DMSO对孤雌胚影响不大,因此TSA处理孤雌胚是有意义的。在孤雌组中,荧光强度大致呈先降低后升高的趋势。结果表明,孤雌DMSO组与孤雌组总体趋势相同,植入前各时期孤雌激活胚胎中H3K9乙酰化模式和孤雌组之间不存在着差异(P>0.05)。孤雌 TSA组与孤雌组相比,H3K9乙酰化程度总体趋势大致相同,但在原核期、4-细胞、8-细胞阶段TSA组H3K9乙酰化的程度高于孤雌组,差异显著(P>0.05),尤其是原核期(0.19±0.025与0.10±0.013)和8-细胞(0.10±0.012与0.06±0.005)阶段。在孤雌TSA组中,荧光强度总体趋势是先降低后升高,原核期达到最大荧光强度(0.19±0.025)。孤雌TSA组与孤雌 DMSO组相比,在原核期、4-细胞、8-细胞阶段TSA组H3K9乙酰化的程度高于DMSO组,差异显著(P>0.05),2-细胞期低于 DMSO组,到桑椹胚、囊胚阶段H3K9乙酰化的程度两组相当,差异不显著(P<0.05)。在孤雌DMSO组中,由原核期到 8-细胞时期荧光强度呈降低趋势,桑椹胚期升高。结果表明,虽然孤雌TSA组与孤雌DMSO组总体趋势大致相同,但是植入前原核期、2-细胞、4-细胞、8-细胞时期TSA组的胚胎中H3K9乙酰化模式和DMSO组之间存在着差异(P<0.05)(图3,图4)。
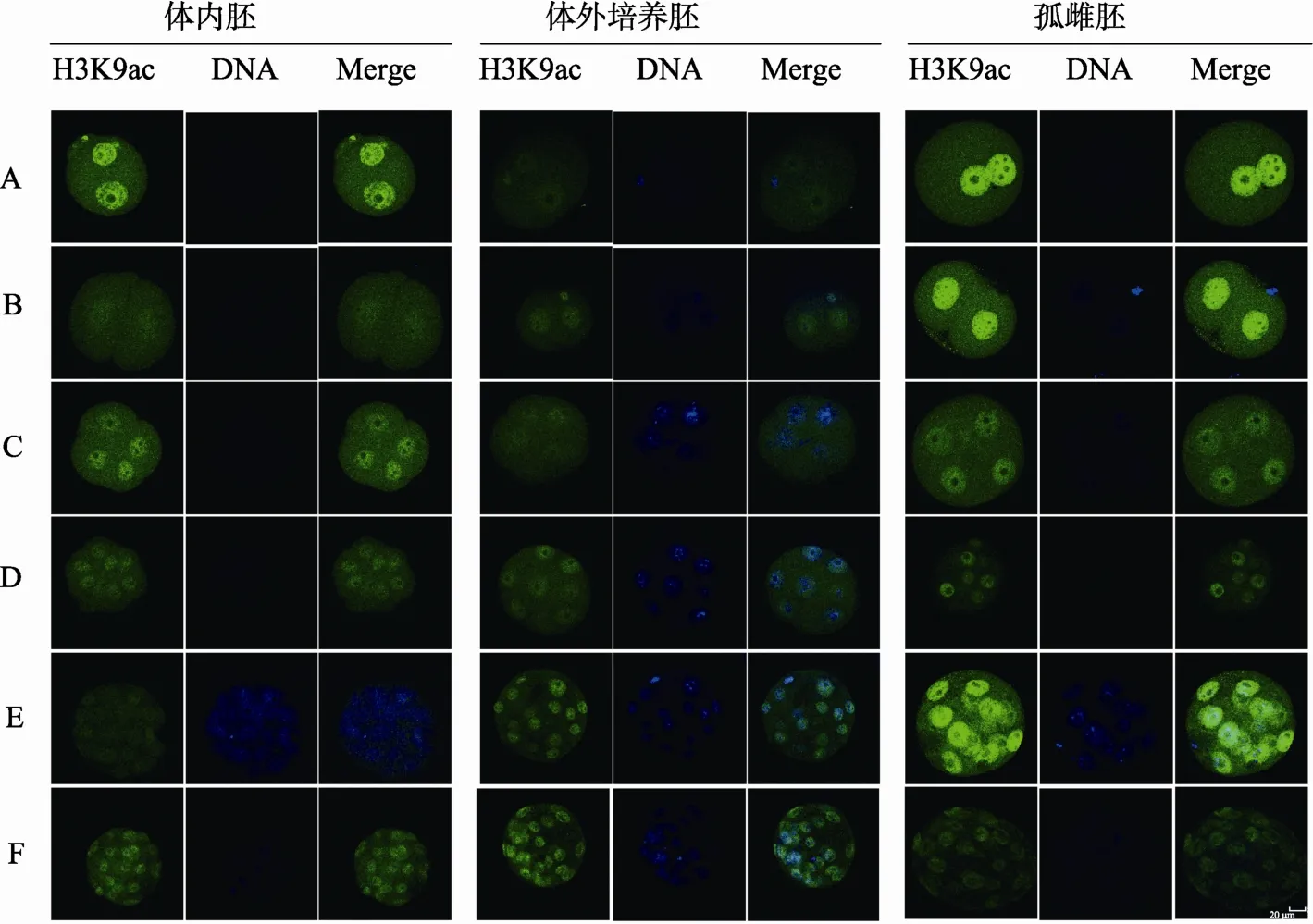
图2 小鼠体内胚、体外培养胚和孤雌胚各时期H3K9ac模式

图3 小鼠体内孤雌胚、DMSO处理孤雌胚和TSA处理孤雌胚各时期H3K9ac模式
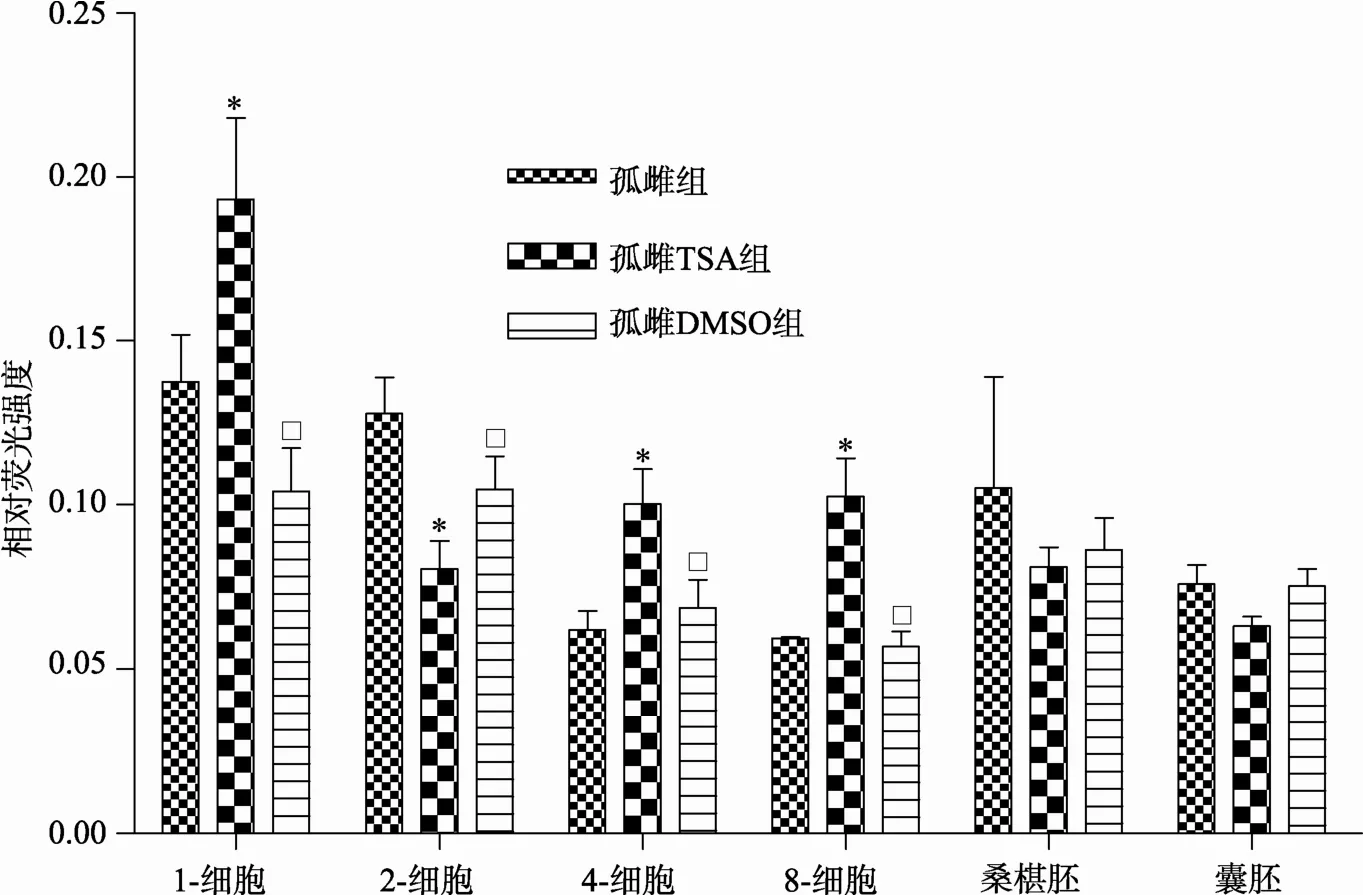
图4 TSA处理后小鼠植入前各期孤雌胚胎H3K9ac水平相对荧光强度半定量分析
3 讨 论
本文主要研究了小鼠孤雌胚、体外培养胚的H3K9ac模式与体内正常胚之间的差异,及TSA对孤雌胚 H3K9ac模式的影响。对上述胚胎及体内胚的 H3K9ac模式进行检测,结果发现,体内的荧光强度总体趋势是先降低后升高,原核期荧光强度最大(0.12±0.018)。这可能是由于母源基因在基因表达中处于优势地位所致。研究表明[16,17],HDAC家族中的HDAC1在正常胚胎的2-细胞时期开始表达,4-细胞时期表达也较活跃,因而组蛋白去乙酰化水平开始渐升,而组蛋白去乙酰化又抑制基因转录,可以推测正常胚在 2-细胞、4-细胞时期组蛋白乙酰化程度可能处于较低水平。越来越多的研究表明[18],在正常胚胎 4-细胞、8-细胞时期的细胞核中,可以检测到 HDAC1的表达,表明小鼠在植入前各时期体内胚的 H3K9ac模式是先降低后升高,与本文的研究结果一致。由于孤雌胚 H3K9ac的趋势和体内胚总体趋势基本一致,所以本文推测孤雌胚胎的H3K9ac模式也可能遵循此趋势。本课题组前期研究表明,孤雌胚的H3K27ac模式亦是如此[19]。通过实验发现,经TSA处理的孤雌胚,其H3K9乙酰化总体水平有所升高,与孤雌正常胚相比,在原核期至8-细胞阶段表现出差异显著(P<0.05)。由于孤雌胚H3K9ac水平高于体内胚,使植入前胚胎发育过程中应沉默的基因启动子发生超乙酰化,进而抑制胚胎发育;而经TSA处理的孤雌胚,其H3K9乙酰化被提高到一个更高的水平,理论上这不利于孤雌胚的正常发育,然而实验结果表明其发育率有所提高,表明TSA提高孤雌胚的发育能力可能并不完全是通过改变H3K9乙酰化水平来实现的(图3,图4)。体外培养组的总体趋势和体内组一致,仅在原核期两组之间差异显著(P<0.05),造成此结果的原因可能是由于体外组比体内组的原核胚在培养液中多放置了5 h后才固定,这期间不可控的体外培养环境可能对胚胎正常发育造成了一定的影响。
本研究结果表明,植入前小鼠各时期体外培养胚胎 H3K9ac模式与体内胚差异不显著,但孤雌激活胚 H3K9ac模式与体内胚胎存在着差异,这可能是造成孤雌胚发育能力较差的原因之一。TSA处理在一定程度上提高了胚胎发育率,但可能并不完全是通过改变 H3K9乙酰化水平来实现的,进一步地深入开展相关研究将对纠正小鼠孤雌胚胎异常的乙酰化模式以及提高孤雌胚发育能力具有重要的意义。
[1]Palini S, De Stefani S, Scala V, Dusi L, Bulletti C. Epigenetic regulatory mechanisms during preimplantation embryo development. Ann NY Acad Sci, 2011, 1221: 54-60.
[2]Gray SG, Teh BT. Histone acetylation/deacetylation and cancer: an “open“ and “shut“ case? Curr Mol Med, 2001, 1(4): 401-429.
[3]林洁, 来茂德. DNA甲基化、组蛋白去乙酰化与基因表达抑制. 临床与实验病理学杂志, 2006, 22(3): 353-357.
[4]李保华, 张卫林. 组蛋白乙酰化/去乙酰化与基因表达调控研究进展. 安徽农业科学, 2007, 35(18): 5364-5365.
[5]Cress DW, Seto E. Histone deacetylase, transcriptional control, and cancer. J Cell Physiol, 2000, 184(1): 1-16.
[6]Roth SY, Denu JM, Allis CD. Histone acetyltransferases. Annu Rev Biochem, 2001, 70: 81-120.
[7]Lachner M, Jenuwein T. The many faces of histone lysine methylation. Curr Poin Cell Biol, 2002,14(3): 286-298.
[8]Mosashvilli D, Kahl P, Mertens C, Holzapfel S, Rogenhofer S, Hauser S, Büttner R, Von Ruecker A, Müller SC, Ellinger J. Global histone acetylation levels: Prognostic relevance in patients with renal cell carcinoma. Cancer Sci, 2010, 101(12): 2664-2669.
[9]Kratz A, Arner E, Saito R, Kubosaki A, Kawai J, Suzuki H, Carninci P, Arakawa T, Tomita M, Hayashizaki Y, Daub CO. Core promoter structure and genomic context reflect histone 3 lysine 9 acetylation patterns. BMC Genomics, 2010, 11: 257.
[10]孙博文. 小鼠孤雌胚胎干细胞建系和鉴定[学位论文].上海: 上海第二医科大学, 2004.
[11]王振东, 薛媛, 单智焱, 郑重, 李雪, 吴嫣爽, 孙瑞珍,石健, 李明杰, 刘忠华, 雷蕾. 小鼠孤雌胚胎干细胞的建立及其向运动神经元分化的初探. 遗传, 2011, 33(11): 1231-1238.
[12]尹海林, 陈秀兰. 小鼠卵母细胞体外培养成熟及“试管小鼠”的研究. 遗传, 1989, 11(3): 18-22.
[13]Pomar FJR, Teerds KJ, Kidson A, Colenbrander B, Tharasanit T, Aguilar B, Roelen BAJ. Differences in the incidence of apoptosis between in vivo and in vitro produced blastocysts of farm animal species: a comparative study. Theriogenology, 2005, 63(8): 2254-2268.
[14]王彩红, 黄继昌, 刘勇, 吴风瑞, 丁彪, 王荣, 张远, 李文雍. 小鼠孤雌胚与体内正常胚 H3K27三甲基化模式的差异. 动物学杂志, 2014, 49(1): 103-109.
[15]Ma SF, Liu XY, Miao DQ, Han ZB, Zhang X, Miao YL, Yanagimachi R, Tan JH. Parthenogenetic activation of mouse oocytes by strontium chloride: a search for the best conditions. Theriogenology, 2005, 64(5): 1142-1157.
[16]Ma J, Svoboda P, Schultz RM, Stein P. Regulation of zygotic gene activation in the preimplantation mouse embryo: global activation and repression of gene expression. Biol Reprod, 2001, 64(6): 1713-1721.
[17]Ma P, Schultz RM. Histone deacetylase 1 (HDAC1) regulates histone acetylation, development, and gene expression in preimplantation mouse embryos. Dev Biol, 2008, 319(1): 110-120.
[18]Zhao DM, Xu CM, Huang HF, Qian YL, Jin F. Expression patterns of GCN5 and HDAC1 in preimplantational mouse embryos and effects of in-vitro cultures on their expressions. Acta Biolog Experiment Sin, 2005, 38(6): 513-519.
[19]王彩红, 刘勇, 黄继昌, 吴风瑞, 丁彪, 王荣, 张远, 李文雍. H3K27乙酰化模式在孤雌胚与正常胚中的差异及其对胚胎发育的影响. 四川动物, 2013, 32(5): 684-688.
(责任编委: 吴强)
Comparative analysis of H3K9 acetylation level in parthenogenetic, and in vitro and in vivo developed mouse embryos
Li Chen1, Fang Ding1, Yong Liu2,3, Fengrui Wu2,3, Biao Ding2,3, Rong Wang2,3, Wenyong Li2
1. College of Life Science, Anhui University, Hefei 230039, China; 2. Key Laboratory of Embryo Development and Reproductive Regulation of Anhui Province, Fuyang 236041, China; 3. College of Life Science, Fuyang Normal University, Fuyang 236041, China
The developmental rate of parthenogenetic embryos is slower than that of embryos generated in vitro and in vivo. To detect the effects of epigenetic modification on embryo development, we compared the H3K9 acetylation level in these three types of embryos as well as parthenogenetic embryos treated with a histone deacetylase in-hibitor trichostatin (TSA) by indirect immunofluorescence. Our results showed that fluctuations in the level of acetylated H3K9 detected during embryo development are similar among different types of mouse embryos. However, the level of H3K9 acetylation in parthenogenetic embryos is significantly higher while the level in embryos generated in vitro is lower when compared with that in embryos derived from in vivo. Treatment of parthenogenetic embryos with TSA increases the developmental rate but further elevates the level of H3K9 acetylation, especially from pronuclear to 8-cell stages. These results suggest that the promoters of genes that should be silenced during pre-implantation embryo development may be hyperacetylated in parthenogenetic embryos which inhibit normal embryo development. However, the positive effect of TSA on embryo development is not through altering the H3K9 acetylation level.
epigenetic modification; parthenogenetic embryos; H3K9 acetylation; trichostatin A (TSA); mouse
2014-06-18;
2014-10-01
国家自然科学基金项目(编号:31372273,31201789),安徽省省级学科建设重大项目(编号:皖教秘科[2014]28号),安徽大学学术创新研究项目(编号:yqh100130),安徽省教育厅自然科学基金项目(编号:KJ2013A202)和安徽省自然科学基金项目(编号:1408085MC44, 1408085QC65)资助
陈利,硕士研究生,专业方向:发育分子生物学。E-mail:chenli3096@163.com
李文雍,教授,硕士生导师,研究方向:胚胎发育分子生物学。E-mail: liwenyong@aliyun.com
10.16288/j.yczz.2015.01.011
时间: 2014-11-24 17:57:46
URL: http://www.cnki.net/kcms/detail/11.1913.R.20141124.1757.002.html

