辣椒素促进大肠癌细胞凋亡作用机制的研究
张志宏,韩盛玺,邱春华,李良平
四川省人民医院消化内科,四川 成都610072
大肠癌的形成过程涉及了多个基因和多个事件,这一观点已基本达成共识,而Wnt 细胞信号通路在大肠癌发展过程中的作用也不容忽视。目前认为Wnt作用机制分为:经典和非经典途径。所谓的经典途径,即Wnt-β-catenin 信号通路;非经典途径,则指Wnt 只与Wnt 受体复合体亚基Frz 作用,而不需要LRP5/6 参与,其主要分支为:(1)Wnt/Ca2+信号通路,JAK-PI3/Akt-STAT3;(2)Wnt/Jnk 信号通路,通过Dsh 激活Jnk-AP-1。
近年来研究认为,辣椒素对于皮肤癌、肺癌、前列腺癌等多种肿瘤具有抗肿瘤的作用,其机制涉及了包括上述可能的多种途径,但对于大肠肿瘤的作用及机制的研究报道目前尚不多见。本研究旨在观察辣椒素对大肠癌细胞的作用,同时探讨其作用机制,寻求新的抗癌靶点。
1 材料与方法
1.1 材料
1.1.1 主要仪器:倒置显微镜和照相系统(Olympus公司,IX50 型),荧光定量PCR 仪(上海枫岭生物技术FTC-2000),流式细胞仪(美国Coulter 公司,ELITE ESP 型)。
1.1.2 主要制剂:1640 培养液,PCR 试剂盒,鼠抗βcatenin,STAT3,COX-2,AP-1(CST Co.),羊抗兔(Santa Cruz Co.)PCR 反应引物见表1。

表1 PCR 引物序列Tab 1 The primer sequences for PCR
1.1.3 标本来源:大肠癌细胞株购于四川大学华西医院消化外科实验室。
1.2 方法
1.2.1 细胞复苏及传代:Ls174 细胞株用1640 培养基加10%胎牛血清,37 ℃CO2孵箱培养。
1.2.2 免疫组化:将2%明胶预处理过的无菌盖片放入6 孔板内,将细胞接种生长。40 g/L 多聚甲醛固定30 min。0.1% Triton-X100 5 min 打孔。室温避光10 min。羊血清封闭切片,37 ℃约20 min。相应的一抗(1∶100),37 ℃孵育1 h,4 ℃过夜。二抗羊抗鼠抗体(1∶200),37 ℃40 min。加过氧化物酶标记的链酶卵白素抗体(1∶200),37 ℃孵育30 min。DAB 显色,苏木素复染,脱水透明,封片。
1.2.3 RT-PCR:Trizol reagent 提取细胞总RNA,参照说明书逆转录后做PCR 扩增,参照Gene Bank 序列设计引物。PCR 反应条件:94 ℃2 min 1 个循环,以后94 ℃20 s,54 ℃20 s,70 ℃30 s,80 ℃20 s,共40 个循环。增益率为1.5。PCR 产物用琼脂糖凝胶电泳鉴定。
1.2.4 噻唑蓝(MTT)比色试验:2 ×103个细胞/孔接种于96 孔板。终止前加MTT 20 μl/孔,弃上清,加DMSO 150 μl/孔,选择570 nm 波长,测定各孔光吸收值。抑制率(%)=(1 -试验组光吸收值/对照组光吸收值)×100%。
1.2.5 流式细胞仪检测细胞周期及凋亡的影响:按2×105/ml 密度接种作用后,将收集的细胞悬于4 ℃预冷PBS 中,缓缓倒入-20 ℃预冷乙醇,4 ℃过夜。离心后将等体积的细胞悬液和PI 染液混合,4 ℃放置20~30 min,过滤后检测。
1.3 统计学方法 采用SPSS 12.0 软件包进行分析。细胞增殖抑制结果采用方差分析(F 检验)。药物对细胞凋亡的作用采用χ2检验。相关性用r 检验。P <0.05 为差异有统计学意义。
2 结果
2.1 免疫组化检测大肠癌细胞COX-2、β-catenin、STAT3、AP-1 的表达 免疫组化染色显示COX-2、βcatenin、STAT3、AP-1 的表达于胞浆中呈棕色颗粒阳性表达,胞核呈蓝色复染状(见图1 ~3)。
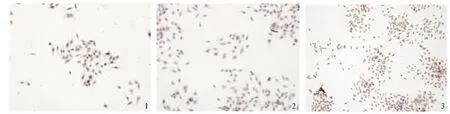
图1 细胞174-COX-2 阳性表达(400 ×);图2 细胞174-STAT3 阳性表达(400 ×);图3 细胞174-β-catenin 强阳性表达(200 ×)Fig 1 COX-2 positive expression (400 ×);Fig 2 STAT3 positive expression (400 ×);Fig 3 β-catenin strongly positive expression(200×)
2.2 辣椒素对COX-2、β-catenin、STAT3 mRNA 表达的影响 辣椒素下调细胞中COX-2 和β-catenin mRNA 的表达。200 ~400 μmol/L 辣椒素作用24 ~48 h后,COX-2 mRNA 表达下调为对照组的18.0% ~89.0%;β-catenin mRNA 的 表 达 下 调 为21.6% ~81.9%,且下调幅度随浓度的加大及作用时间的延长而增强。STAT3 的表达在24 ~48 h 内则增加了20.0% ~100%,与既往研究中检测磷酸化p-STAT3 蛋白表达下调相反。而AP-1 的表达则无明显变 化(见表2)。
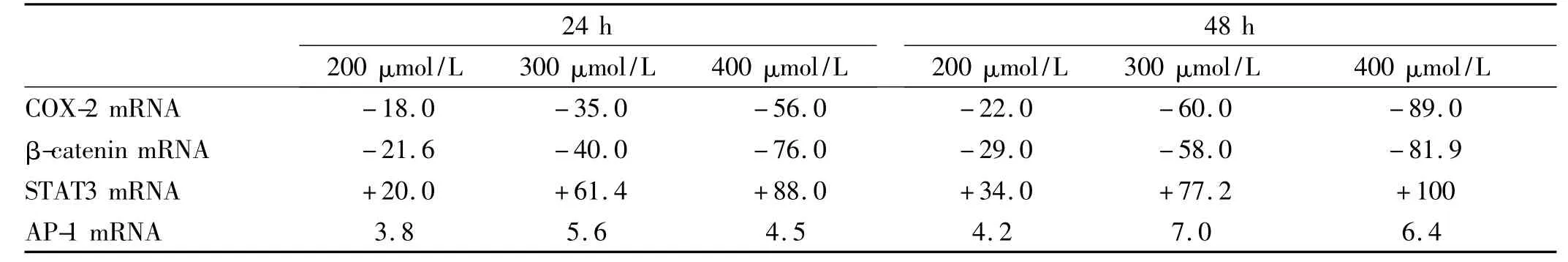
表2 不同浓度辣椒素作用24 ~48 h 后各基因mRNA 表达变化(%)Tab 2 The regulated mRNA expression with different concentrations of capsaicin during 24 ~48 h(%)
2.3 辣椒素对细胞增殖的影响 MTT 法检测其对细胞增殖的影响呈现出时间和浓度依赖。100 ~400 μmol/L 作用24 h 后,细胞增殖的抑制率由4.5%增至59.0%;作用延长至48 h 后抑制率增为65. 0% ~87.0%,与对照组相比,差异有统计学意义(P <0.05),且各时间点之间比较,差异也有统计学意义(P<0.05,见表3)。
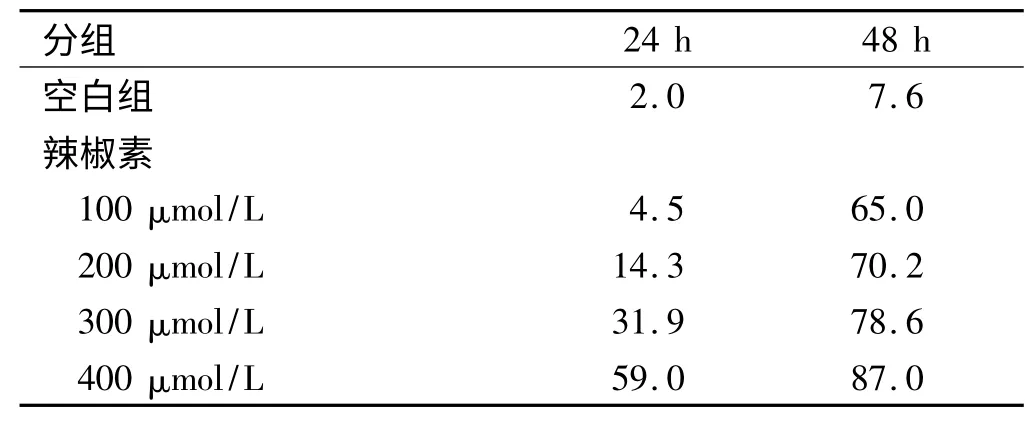
表3 MTT 法检测辣椒素在不同时间点作用于大肠癌细胞的抑制率(%)Tab 3 The inhibition ratio measured by MTT with different concentrations of capsaicin in different time points(%)
2.4 辣椒素对大肠癌细胞Ls174 凋亡的影响
2.4.1 对细胞形态的影响:辣椒素在作用于大肠癌细胞后,癌细胞变形增大,胞浆中粗细不均的颗粒增多,细胞逐渐从培养瓶壁上脱落下来,脱落率随时间增加而增加,培养瓶中的培养液随之变浑浊。
2.4.2 流式细胞仪检测细胞的凋亡率:细胞凋亡率随着辣椒素作用时间的延长而增加,在选定的时间终点达到高峰,呈时间依赖性(见表4)。
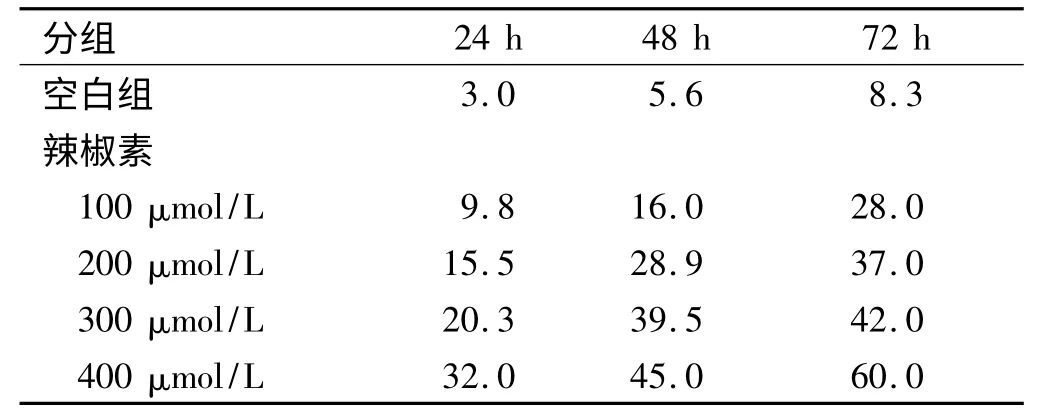
表4 流式法检测不同浓度在不同时间点的细胞凋亡率(%)Tab 4 The apoptosis ratio measured by flow cytometry in the different time points(%)
2.4.3 对细胞生长周期的影响:辣椒素可使细胞G1期由20.0%上调至46.0%,而S 期则由58.0%下调至36.0%,与对照组相比,差异有统计学意义(P <0.05)。
3 讨论
目前,Wnt 细胞信号通路在大肠癌的发生发展中的重要作用基本得到公认。其机制分为经典和非经典两条途径。经典途径,即Wnt-β-catenin 信号通路。非经典途径的分支主要有:(1)Wnt/Ca2+信号通路,通过JAK-PI3/Akt-STAT3 发挥作用;(2)Wnt/Jnk 信号通路,通过Dsh 激活Jun-N 末端激酶(Jnk)迁入核,即Jnk-AP-1 通路而发挥作用。
研究发现,辣椒素可抑制多种肿瘤细胞包括胃癌[1]、肝癌[2]、前列腺癌[3]、白血病细胞[4]的生长,其机制涉及了包括上述可能的多种途径。然而其对大肠癌细胞的作用及其机制的研究目前报道尚不多见。本实验观察了辣椒素在作用于大肠癌细胞后,经典途径中COX-2、β-catenin 及非经典途径中STAT3 和AP-1的变化,以期了解辣椒素对于大肠癌细胞是否有抑制作用及其作用的机制。
根据本实验的研究结果,辣椒素可使大肠癌细胞的增殖明显受到抑制,同时可使该细胞的凋亡率增加,其作用呈现出时间和浓度依赖。该结果提示,辣椒素对大肠癌细胞的抑制作用与之前其对于类似肿瘤的研究结果相一致。此外,本实验结果还显示,辣椒素可使经典途径中相关的COX-2 及β-catenin mRNA 的表达明显下调。其中,COX-2 是作为抑癌基因APC[5]的一个修饰基因而发挥作用。β-catenin 的复合体则在APC 发生突变后[6],出现解体游离,导致其在胞质内积累,而后转移至细胞核结合于转录因子TCF/LEF[7],刺激Wnt 信号靶基因cyclinD1、c-myc[8]等的转录,并最终对细胞增殖等过程加以调控[9-10]。由于COX-2 和β-catenin 均与APC 相关,推测两者均处于经典Wnt 信号通路中的相对上游。同时,辣椒素对于COX-2 和β-catenin 均呈抑制性的结果提示,Wnt 经典途径在辣椒素对大肠癌细胞的生长抑制作用占据着重要地位。
另一方面,为了解辣椒素在非经典Wnt 途径中的作用,本实验选取了STAT3 和AP-1 作为代表加以观察。其中,STAT 家族参与了细胞增殖、血管生成等多个环节,在细胞的生长凋亡过程中的地位举足轻重[11]。作为STAT 家族成员之一的STAT3(DNA 结合的转录因子)的异常激活,可促进肿瘤细胞的生长和存活[12]。因此,阻断JAK-STAT3 通路被认为是一个潜在的抗肿瘤方式[13-14]。STAT3 有固有和磷酸化的两种蛋白表达方式。有研究显示,辣椒素对于骨髓瘤细胞的固有STAT3 蛋白的活化有抑制作用,且呈浓度和时间依赖;同时其还可以抑制STAT3 的相关调节蛋白,如Survivin、cyclin D1、VEGF 等的表达[15]。
本研究中辣椒素在作用于大肠癌细胞后,STAT-3 mRNA 的表达呈上升趋势。分析可能的原因:(1)非经典Wnt 途径中的分支JAK-PI3/Akt-STAT3 通路可能不参与辣椒素对大肠癌细胞的抑制;(2)辣椒素不影响STAT3 的转录阶段,从而造成已合成的STAT3 mRNA 在核内异常堆积,而是仅对STAT3 蛋白的磷酸化过程发挥抑制作用。既往研究发现STAT3 的磷酸化在肿瘤细胞的转化和增殖中发挥关键性的作用[16]。中-重度不典型增生的唇炎组织中,部分上皮细胞缺乏STAT3 磷酸化(p-STAT3)的阳性表达[17],提示p-STAT3 可能有着较STAT3 更为重要的临床意义。STAT3 在磷酸化后可上调组织的金属蛋白酶抑制剂(tissue inhibitors of metalloproteinase,TIMP-1),阻断金属蛋白酶的活性,从而下调血管和淋巴组织的侵袭性,导致乳腺癌的生物和临床行为发生改变[18]。由于本实验仅对辣椒素在STAT3 mRNA 表达方面做了研究,而尚未对活化的STAT3 磷酸化蛋白表达做进一步的研究,因此,在判断辣椒素对STAT3 作用的方面,可能会有一定的偏颇之处,有待进一步的研究加以明确。
另外,本研究还发现辣椒素对AP-1 mRNA 表达的作用不明显。该结果提示,辣椒素对于大肠癌细胞的作用中,非经典途径中的JNK-AP-1 通路可能不参与其中。该结果与另一研究[19]所示大肠癌细胞增殖受抑时,AP-1 表达增强的结论不完全一致。AP-1 在大肠癌增殖过程中的作用,尚需更多实验加以证实。
综上,本研究针对辣椒素在作用于大肠癌细胞后,不同信号通路中各基因表达的变化,进一步明确了经典和非经典Wnt 途径在其作用中的机制,为进一步明确辣椒素的作用机制奠定一定的理论基础,但仍然有很多机制不明确,有待进一步的研究证实。
[1] Kim JD,Kim JM,Pyo JO,et al. Capsaicin can alter the expression of tumor forming-related genes which might be followed by induction of apoptosis of a Korean stomach cancer cell line,SNU-1 [J]. Cancer Lett,1997,120(2):235-241.
[2] Jung MY,Kang HJ,Moon A. Capsaicin-induced apoptosis in SK-Hep-1 hepatocarcinoma cells involves Bcl-2 downregulation and caspase-3 activation[J]. Cancer Lett,2001,165(2):139-145.
[3] Mori A,Lehmann S,O'Kelly J,et al. Capsaicin,a component of red peppers,inhibits the growth of androgen-independent,p53 mutant prostate cancer cells[J]. Cancer Res,2006,66(6):3222-3229.
[4] Ito K,Nakazato T,Yamato K,et al. Induction of apoptosis in leukemic cells by homovanillic acid derivative,capsaicin,through oxidative stress:implication of phosphorylation of p53 at Ser-15 residue by reactive oxygen species[J]. Cancer Res,2004,64(3):1071-1078.
[5] Zeineldin M,Cunningham J,McGuinness W,et al. A knock-in mouse model reveals roles for nuclear Apc in cell proliferation,Wnt signal inhibition and tumor suppression[J]. Oncogene,2012,31(19):2423-2437.
[6] Kohler EM,Brauburger K,Behrens J,et al. Contribution of the 15 amino acid repeats of truncated APC to beta-catenin degradation and selection of APC mutations in colorectal tumours from FAP patients[J].Oncogene,2010,29(11):1663-1671.
[7] Morin PJ,Sparks AB,Korinek V,et al. Activation of beta-catenin-Tcf signaling in colon cancer by mutation in beta-catenin or APC[J]. Science,1997,275(5307):1787-1790.
[8] He TC,Spark AB,Roga C,et al. Identification of c-MYC as a target of the APC pathway[J]. Science,1998,218(5382):1509-1512.
[9] Cadigan KM,Liu YI. Wnt signaling:complexity at the surface[J]. J Cell Sci,2006,119(Pt 3):395-402.
[10] Takahashi M,Tsunoda T,Seiki M,et al. Identification of membranetype matrix metalloproteinase-1 as a target of the beta-catenin/Tcf4 complex in human colorectal cancers [J]. Oncogene,2002,21(38):5861-5867.
[11] Darnell JE Jr. Transcription factors as targets for cancer therapy[J].Nat Rev Cancer,2002,2(10):740-749.
[12] Nguyen AV,Wu YY,Liu Q,et al. STAT3 in epithelial cells regulates inflammation and tumor progression to malignant state in colon[J]. Neoplasia,2013,15(9):998-1008.
[13] Duan Z,Bradner J,Greenberg E,et al. 8-benzyl-4-oxo-8-azabicyclo[3.2.1]oct-2-ene-6,7-dicarboxylic acid (SD-1008),a novel janus kinase 2 inhibitor,increases chemotherapy sensivity in human ovarian cancer cells[J]. Mol Pharmacol,2007,72(5):1137-1145.
[14] Oh JH,Cho MC,Kim JH,et al. IL-32γ inhibits cancer cell growth through inactivation of NF-κB and STAT3 signals[J]. Oncogene,2011,30(30):3345-3359.
[15] Bhutani M,Pathak AK,Nair AS,et al. Capsaicin is a novel blocker of constitutive and interleukin-6-inducible STAT3 activation[J]. Clin Cancer Res,2007,13(10):3024-3032.
[16] Yu H,Jove R. The STATs of cancer-new molecular targets come of age[J]. Nat Rev Cancer,2004,4(2):97-105.
[17] Cury PR,Furuse C,de Araújo NS,et al. Signal transducer and activator of transcription-3 expression and activation is dysregulated in actinic cheilitis[J]. J Cutan Pathol,2007,34(8):606-611.
[18] Dien J,Amin HM,Chiu N,et al. Signal transducers and activators of transcription-3 up-regulates tissue inhibitor of metalloproteinase-1 expression and decreases invasiveness of breast cancer [J]. Am J Pathol,2006,169(2):633-642.
[19] Lin CM,Chen YH,Ma HP,et al. Silibinin inhibits the invasion of IL-6-stimulated colon cancer cells via selective JNK/AP-1/MMP-2 modulation in vitro[J]. J Agric Food Chem,2012,60(51):12451-12457.

