原发性十二指肠胃反流程度与胃部炎性反应关系的研究
高金保,韩 文
1.陕西省榆林市第一医院消化内科,陕西 榆林719000;2.延安大学附属医院消化内科
原发性十二指肠胃反流是临床常见的一种食管运动障碍性疾病,其典型特征为十二指肠内容物胆汁、胰酶及碱性肠内容物反流入胃内,造成患者贫血、体质量减轻、慢性腹泻和失眠多梦、心悸等神经功能异常,体征常表现为上腹压痛,大幅降低患者的生活质量,影响患者的预后[1-3]。在原发性十二指肠胃反流进展过程中,可造成机体胃黏膜损伤,而诱发不同程度的胃部炎性反应[4-6]。为了探讨原发性十二指肠胃反流程度与胃部炎性反应的关系,榆林市第一医院选取2010 年11 月-2012 年12 月收治的原发性十二指肠胃反流患者95 例与同期健康体检人员94 名行血清与胃液中的炎性因子(IL-1、IL-6、IL-8、IL-10)、肿瘤坏死因子α(TNF-α)检测,分析原发性十二指肠胃反流程度与胃部炎性反应的关系,现报道如下。
1 资料与方法
1.1 一般资料 选取2010 年11 月-2012 年12 月收治的原发性十二指肠胃反流患者95 例为观察组,年龄26 ~71 岁,平均年龄(45.8 ±13.1)岁,病程1 ~13 年,平均病程(3.9 ±1.0)年,男58 例,女37 例。患者均符合原发性十二指肠胃反流的临床诊断标准。排除患有其他心肺疾病、肝肾疾病、血液病、免疫性疾病、精神疾病、肿瘤疾病的患者。根据患者的胃反流程度分为两亚组,低反流患者43 例为A 组,年龄26 ~70 岁,平均年龄(46.1 ±12.5)岁,病程1 ~11 年,平均病程(3.8±1.1)年,男27 例,女16 例;高反流患者52 例为B组,年龄28 ~71 岁,平均年龄(45.6 ±10.8)岁,病程2~13 年,平均病程(3.9 ±1.3)年,男31 例,女21 例。选取同期健康体检人员94 名为对照组,年龄25 ~73岁,平均年龄(45.9 ±14.3)岁,男56 例,女38 例。两组基础资料(性别、年龄等)相比,差异均无统计学意义(P >0.05),具有可比性。此次研究已取得患者及家属的同意,且经医院伦理委员会通过。
1.2 方法 给予患者24 h 胃内胆红素监测,在治疗前1 周指导患者停用抑酸药物,禁止服用胃肠动力药物,且行监测前要禁食8 h,记录患者胃内的胆红素吸收值,胆红素吸收值≥0.25 U 可定性为胆汁反流阳性,胆红素吸收值<0.25 U 可定性为胆汁反流阴性。计算患者胃反流时间的百分比,将反流时间百分比的中位数作为此次研究的分界值,反流时间百分比<23%可定性为低反流组,反流时间百分比≥23%可定性为高反流组。抽取被检人员的空腹静脉血10 ml,分离血清后待检。在无菌状态下操作,通过胃镜检查抽吸被检人员的胃液10 ml 待检。使用Millipore Corporation 公司生产的Luminex 试剂盒检测炎性因子(IL-1、IL-6、IL-8、IL-10)和TNF-α,严格按照操作说明进行。
1.3 观察指标 血清炎性因子(IL-1、IL-6、IL-8、IL-10)、血清TNF-α、胃液炎性因子(IL-1、IL-6、IL-8、IL-10)、胃液TNF-α。
1.4 统计学处理 采用SPSS 16.0 统计学软件进行处理和分析,计量资料用x±s 表示,计量资料采用t 检验,相关性用Pearson 相关性分析,P <0.05 为差异有统计学意义。
2 结果
2.1 对照组与观察组血清中炎性因子和TNF-α 比较
对照组与观察组血清中炎性因子和TNF-α 比较结果显示,观察组患者血清中IL-1、IL-6、IL-8、IL-10、TNF-α 均明显高于对照组,差异均有统计学意义(P <0.05,见表1)。
2.2 对照组与观察组胃液中炎性因子和TNF-α 比较
对照组与观察组胃液中炎性因子和TNF-α 比较结果显示,观察组患者胃液中IL-1、IL-6、IL-8、IL-10、TNF-α 均明显高于对照组,差异均有统计学意义(P <0.05,见表2)。
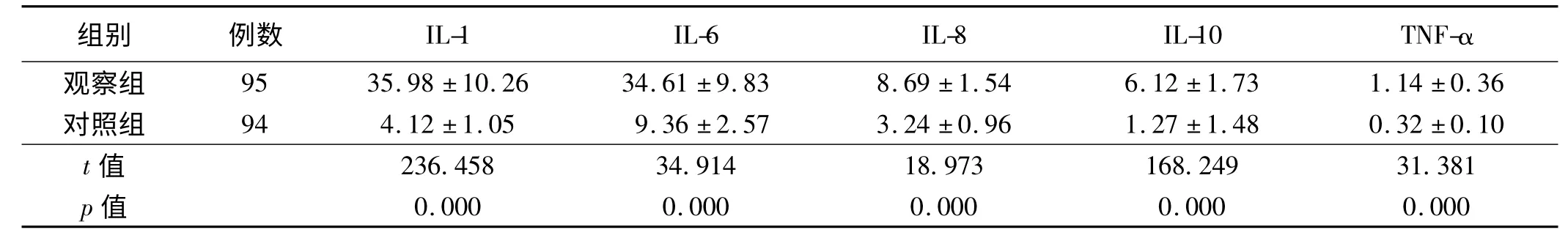
表1 对照组与观察组血清中炎性因子和TNF-α 比较(x±s,pg/ml)Tab 1 Comparison of serum inflammatory factors and TNF-α between control group and observation group (x±s,pg/ml)

表2 对照组与观察组人员胃液中炎性因子和TNF-α 比较(x±s,pg/ml)Tab 2 Comparison of gastric inflammatory factors and TNF-α between control group and observation group (x±s,pg/ml)
2.3 A 组与B 组患者血清中炎性因子和TNF-α 比较
A 组与B 组患者血清中炎性因子和TNF-α 比较结果显示,B 组患者血清中IL-1、IL-6、IL-8、IL-10、TNF-α均明显高于A 组,差异均有统计学意义(P <0.05,见表3)。
2.4 A 组与B 组患者胃液中炎性因子和TNF-α 比较
A 组与B 组患者胃液中炎性因子和TNF-α 比较结果显示,B 组患者胃液中IL-1、IL-6、IL-8、IL-10、TNF-α均明显高于A 组,差异均有统计学意义(P <0.05,见表4)。

表3 A 组与B 组患者血清中炎性因子和TNF-α 比较(x±s,pg/ml)Tab 3 Comparison of serum inflammatory factors and TNF-α between A group and B group (x±s,pg/ml)
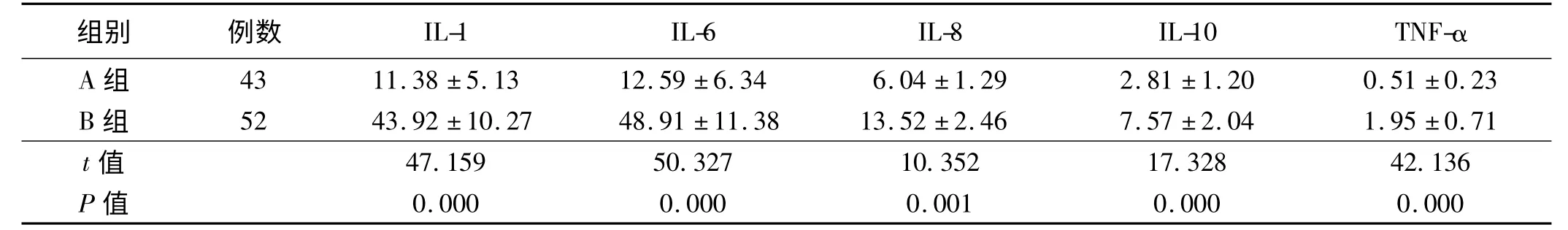
表4 A 组与B 组患者胃液中炎性因子和TNF-α 比较(x±s,pg/ml)Tab 4 Comparison of gastric inflammatory factors and TNF-α between A group and B group (x±s,pg/ml)
2.5 原发性十二指肠胃反流程度与胃部炎性反应的关系分析 经Pearson 相关性分析,原发性十二指肠胃反流程度与胃部炎性反应的相关系数为r =0.795,P=0.000,表明原发性十二指肠胃反流程度与胃部炎性反应存在明显的正相关性。
3 讨论
十二指肠胃反流是以食管动力异常-症状性高动力性食管蠕动为主要特点的独立性疾病,属于原发性食管运动障碍性疾病之一[7-9],可发生于任何年龄,40~50 岁以后发病率较高。在正常情况下,机体内也存在十二指肠胃反流现象,但十二指肠内容物反流到胃部的时间较短,且胃部会很快将其清除,不会引发临床病症。只有机体十二指肠胃反流时间明显延长或者反流量明显加大的情况下,十二指肠内容物反流到胃部后才会造成胃黏膜损伤的发生[10-12]。此时,患者胃窦幽门十二指肠的运动功能失调,幽门括约肌发生了功能障碍,使得幽门的张力明显降低,可持续开放或关闭不全,才会导致十二指肠内容物反流到胃内,进而诱发早饱、腹胀、恶心、呕吐、暖气、腹痛、食欲不振等病症。
十二指肠胃反流的发生、发展过程中,机体胃黏膜会出现不同程度的损伤,容易诱发炎症反应的发生,使得多种炎症因子发生明显改变。IL-1 全名为白细胞介素-1,是由活化的巨噬细胞所产生一种细胞因子,属于白细胞介素的一种,可有效刺激并参与机体的免疫反应,加快细胞增殖、分化,并提高其功能,具有显著的生物学效应,是炎症反应中必不可少的关键因子。十二指肠反流属于一种局部病变,且胃液受到全身状况的影响,其反应要比血液轻微,可反映出局部的异常表达,因而在检查血清中IL-1 的同时,还要同时检测胃液中IL-1 的含量。
IL-6 全名为白细胞介素-6,是一种活化的T 细胞和成纤维细胞产生的淋巴因子,可诱发B 细胞前体成为产生抗体的细胞,具有集落刺激因子协同作用,还可促进原始骨髓源细胞的生长和分化,有效增强自然杀伤细胞的裂解功能,同样具有广泛的生物学活性,可释放出大量的应急期反应蛋白,通过免疫功能与细胞因子的分化作用对其进行有效调节,诱发炎症的进一步反应,可参与机体多种生理反应和病理过程。因而在机体胃黏膜发生损伤时,IL-6 呈现高表达。
IL-8 全名为白细胞介素-8,是由单核巨噬细胞和中性粒细胞生成的,主要生物学功能是在炎症反应中趋化中性粒细胞、T 淋巴细胞以及嗜碱粒细胞至病灶部位,且趋化性对不同细胞有差异,可诱导中性粒细胞与IL-8 接触后发生形态变化,定向游走到反应部位并释放一系列活性产物。这些作用可导致机体局部的炎症反应,达到杀菌和细胞损伤的目的。IL-8 可以使中性粒细胞表达表面黏附分子,释放贮存酶,引起呼吸爆发,生成活性氧代谢物以致引起组织浸润等一系列反应,可加速IL-1 与IL-6 的释放,进而加剧炎症反应。
IL-10 全名为白细胞介素-10,可由Th2 细胞、单核细胞、角质细胞及活化的B 细胞产生,可抑制活化的T细胞产生细胞因子,可降低单核-巨噬细胞表面特异分子的表达,能抑制NK 细胞活性,干扰NK 细胞和巨噬细胞产生细胞因子,还可刺激B 细胞分化增殖,促进抗体生成,是一种典型的抗炎性细胞因子,具有更好的生物学活性,可加快炎性细胞因子的生成。
可见,在十二指肠胃反流患者体内这些因子均会出现显著改变。本次研究结果表明,无论是血清还是胃液,观察组患者IL-1、IL-6、IL-8、IL-10、TNF-α 均明显高于对照组,说明发生炎性反应后,机体内的炎症因子和肿瘤坏死因子α 显著升高。无论是血清还是胃液,B 组患者IL-1、IL-6、IL-8、IL-10、TNF-α 均明显高于A组,说明患者的病症越严重,机体内的炎症因子和肿瘤坏死因子α 的异常表达就越明显。原发性十二指肠胃反流程度与胃部炎性反应存在明显的正相关性。可将这些指标作为患者疾病评价的有效指标。
[1] Xu L,Deng XP,Yao SK,et al. The relationship of gastric mucosa of Helicobacter pylori infection and bile pigment dyeing with twelve duodenogastric reflux patients[J]. Shandong Medical Journal,2012,52(13):57-59.许琳,邓现培,姚树坤,等. 十二指肠胃反流患者胃黏膜幽门螺杆菌感染与胆色素染色关系[J]. 山东医药,2012,52(13):57-59.
[2] Du C. Endoscopy diagnosis and influence factors analysis of bile reflux gastritis[J]. Chin J Gastroenterol Hepatol,2012,21(9):813-815.杜春. 十二指肠胃反流性疾病内镜诊断及相关因素分析[J]. 胃肠病学和肝病学杂志,2012,21(9):813-815.
[3] Ma XY,Wu ZJ,Deng XP,et al. Significance of gastrointestinal transit time and anorectal motility spectrum detection in patients with primary pathology duodenogastric reflux [J]. Chin J Gastroenterol Hepatol,2013,22(1):53-56.马晓莹,吴振军,邓现培,等. 十二指肠胃反流患者检测胃肠传输时间和肛门直肠动力学特征的意义[J]. 胃肠病学和肝病学杂志,2013,22(1):53-56.
[4] Zhang XX,Wang ZM. Relationship between stomach inflammation and gastric mucosal lesions caused by primary pathology duodenogastric reflux[J]. Chin J Gastroenterol Hepatol,2013,22(7):664-666.张新宪,汪枝梅. 原发性十二指肠胃反流程度与胃部炎性反应关系的研究[J]. 胃肠病学和肝病学杂志,2013,22(7):664-666.
[5] Wang F,Han JL,Han Y,et al. Study on the expression of TNF-α,COX-2 and the relation with apoptosis of gastric mucosal cells in primary pathological duodenogastric reflux[J]. Journal of Logistics University of Capf,2011,20(12):940-943.王放,韩俊岭,韩莹,等. 原发性病理性十二指肠胃反流患者胃黏膜TNF-α 和COX-2 的表达及其与细胞凋亡的关系[J]. 武警医学院学报,2011,20(12):940-943.
[6] Zhang YL,Yao SK,Liu JB. Experimental study on the relationship between cell apoptosis and the expression of the related cytokines in rats with duodenogastric reflux [J]. Chin J Gastroenterol Hepatol,2012,21(6):533-535,540.张艳丽,姚树坤,刘俊宝. 十二指肠胃反流对大鼠胃黏膜细胞凋亡及相关细胞因子表达的影响[J]. 胃肠病学和肝病学杂志,2012,21(6):533-535,540.
[7] Li XH,Dong LP,Xu L,et al. Clinical observation of mosapride in 40 patients with twelve duodenogastric reflux and type 2 diabetes mellitus[J].Shandong Medical Journal,2012,52(39):96-97.李晓红,董利平,许琳,等. 莫沙必利用于2 型糖尿病合并十二指肠胃反流40 例临床观察[J]. 山东医药,2012,52(39):96-97.
[8] Wan JJ,Chen SJ,Wang JL,et al. The study on effect of robeprazole and trimebutine maleate on DGR of GERD patients[J]. J Henan Univ Sci Tech (Med Sci),2012,30(1):23-25.弯晶晶,陈胜江,王金梁,等. 雷贝拉唑与马来酸曲美布汀对胃食管反流病患者十二指肠胃反流的影响研究[J]. 河南科技大学学报(医学版),2012,30(1):23-25.
[9] Yoshio A,Kenichi M,Kunitsugu K,et al. Mo1078 rikkunshito exhibits high bile acid absorbance capacity and improves refractory gastroesophageal reflux disease associated with duodenogastric reflux in animal models[J]. Gastroenterology,2012,142(5):589.
[10] Zhang YL,Yao SK,Liu JB. Study on the patheogenesis of gastric mucosal injury in rats with duodenogastric reflux[J]. Journal of China-Japan Friendship Hospital,2012,26(3):172-175.张艳丽,姚树坤,刘俊宝. 十二指肠胃反流对大鼠胃黏膜损伤机制的研究[J]. 中日友好医院学报,2012,26(3):172-175.
[11] Xu L,Yao SK,Zhan SH,et al. Relationship between primary pathological duodenogastric reflux and chronic inflammation of gastric mucosa[J]. Chin J Dig,2008,28(11):755-758.许琳,姚树坤,战淑慧,等. 原发性十二指肠胃反流程度与胃黏膜炎性反应关系的研究[J]. 中华消化杂志,2008,28(11):755-758.
[12] Han JL,Yang YH,Ren FJ,et al. Apoptosis and proliferation of gastric mucosal cells in patients with primary pathological duodenogastric reflux[J]. Academic Journal of Second Military Medical University,2008,29(11):1412-1414.韩俊岭,杨艳红,任凤杰,等. 原发性病理性十二指肠胃反流患者胃黏膜细胞增殖与凋亡的研究[J]. 第二军医大学学报,2008,29(11):1412-1414.

