CT 对胃间质瘤恶性潜能高低判断的价值
何仁政,谢宝君
1.湖北省谷城县人民医院放射科,湖北 谷城441700;2.武汉大学人民医院放射科
胃间质瘤(gastric stromal tumor,GST)是一种具有恶性潜能的非定向分化的间叶肿瘤,临床上并不少见,在胃肠道肿瘤中约占2% ~3%,其诊断主要依靠术后肿瘤组织免疫组织化学检测。目前,CT 检测已经成为诊断GST 的主要方法。本文回顾分析武汉大学人民医院2010 年1 月-2013 年1 月经手术病理确诊的38例GST 患者的CT 表现,并与术后病理对照,探讨CT判断对GST 的诊断及其良恶性判断的价值。
1 资料与方法
1.1 一般资料 武汉大学人民医院2010 年1 月-2013 年1 月经术中病理或术后病理及免疫组织化学检测证实为GST 患者38 例,男20 例,女18 例,年龄24 ~76 岁,平均年龄(53.4 ±2.7)岁。所有患者均术前进行CT 检查。临床表现有上腹部胀痛不适、黑便、呕血、腹部包块、进食哽咽感、反酸呃气或无症状等。
1.2 检测方法 38 例患者均接受上腹部或全腹部CT 平扫,其中18 例接受增强扫描。术前准备:禁食至少8 h,CT 检查前15 min 口服温开水800 ml 以充盈胃腔。仪器采用美国GE 公司Light Speed VCT 64 排螺旋CT 机,管电压120 kv,管电流250 mA,螺距0.6,层厚5 mm;重建层厚5 mm。使用高压注射器经右前臂静脉以3.0 ml/s 的流速注入总量约75 ml 的对比剂优维显(370 mg/ml),进行三期增强扫描。观察CT 片中肿瘤的大小、形态、与周围组织关系、有无坏死或液化、有无转移、浸润等情况。
1.3 病理学良恶性判断标准 有学者认为,GST 没有真正良性,用低度恶性和高度恶性代替良性和恶性在GST 描述中可能更确切[1]。根据WHO 在2000 年制定的消化系统肿瘤病理学分类,恶性程度的组织性评估必须要基于病变的大小及核分裂的数量,按照广泛应用的软组织肉瘤分级系统来进行组织学分级,标准如表1 所示[2]。

表1 GST 的生物学行为判断标准Tab 1 Risk stratification of GST
1.4 统计学方法 采用SPSS 17.0 统计学软件,计数资料采用Fisher 精确概率法,计量资料采用x ± s 表示,两组间比较采用t 检验,P <0.05 为差异有统计学意义。
2 结果
2.1 临床表现 38 例GST 患者中,最常见临床主要表现为上腹部胀痛不适(24 例,63.16%),其次为上消化道出血(18 例,47.37%),其中以黑便为主,呕血5例,均伴有中-重度贫血;吞咽梗阻感3 例;1 例有上腹部包块;2 例表现为反酸、嗳气、恶心;无症状体检发现1 例。
2.2 病理学结果 本组患者经病理学检测,病理大体标本切面为灰色或淡红色,无包膜,部分肿瘤可见坏死、囊变及出血。光镜下以梭形细胞为主,伴或不伴上皮样细胞,部分标本可见核分裂象增多。本组38 例患者中,经免疫组织化学法检查CD117 阳性35 例(92.11%);CD34 阳性32 例(84. 21%);同时表达CD34 和CD117 共29 例(76.32%);SMA 检测38 例,其中10 例阳性(26.32%);S-100 检测33 例,阳性4 例(12.12%);Desmin 检测18 例,阳性3 例(16. 67%)。病理结果显示低度恶性17 例,高度恶性21 例。
2.3 CT 检查结果 GST 的CT 表现与其病理学恶性程度的对照分析见表2,低度恶性潜能的GST 最小约1.0 cm×1.0 cm,最大5.5 cm ×6.0 cm,平均(2.9 ±0.8)cm,高度恶性潜能的GST 最小约2.0 cm ×3.5 cm,最大则为15.0 cm ×18.0 cm,平均(9.4 ±2.6)cm,肿瘤大小与恶性潜能密切相关(P <0.01);病灶多呈圆形或椭圆形,少数呈不规则或分叶状,肿瘤形态与恶性潜能无明显相关性(P =0.070);低度恶性潜能GST 密度多均匀,少见坏死或液化,高度恶性潜能GST可见坏死、液化,胃间质瘤恶性潜能与肿瘤密度具有明显相关性(P=0.025);肿瘤边界清晰24 例,其中低度恶性潜能14 例,高度恶性潜能10 例,边界模糊14 例,其中低度恶性潜能3 例,高度恶性潜能11 例,GST 恶性潜能与肿瘤边界具有明显相关性(P =0.043)。此外,2 例有肝脏转移或腹膜后转移,CT 诊断为胃癌,而术后病理显示均为高度恶性潜能GST(见表2)。
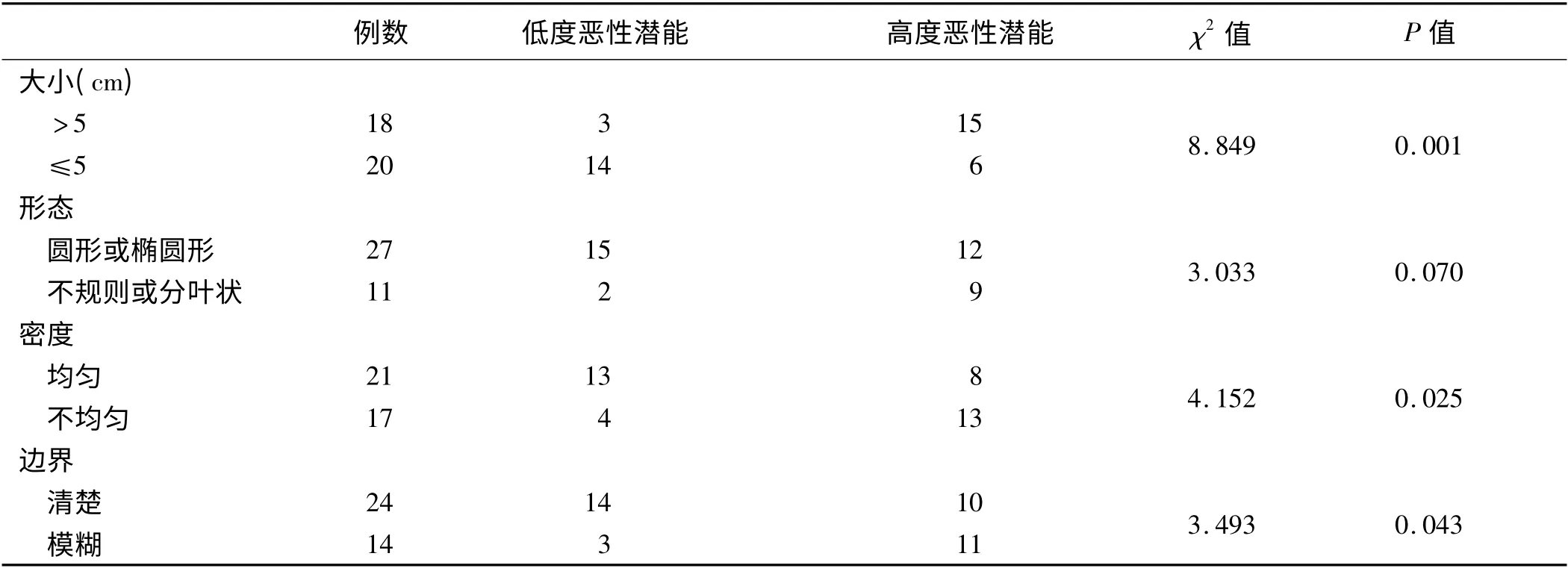
表2 CT 图像表现与病理结果对照Tab 2 The findings of CT images compared with the pathological results
3 讨论
GST 是最常见的消化道间叶源性肿瘤,过去常误诊为胃平滑肌瘤或神经源性肿瘤,随着电镜和免疫组化技术的广泛应用,发现该类肿瘤是一种不成熟的梭形细胞或上皮样细胞增殖,具有独特的形态学、免疫表型及生物学行为[3]。GST 多见于中老年患者,男性较多见。患者常无特异性临床表现,主要表现为上腹部胀痛不适、黑便、呕血、腹部包块、进食哽咽感、反酸呃气或无症状等,临床表现与肿瘤大小、部位、供血情况等相关,本组患者临床表现最多见的是上腹部胀痛不适及消化道出血。
诊断GST 的金标准是病理学检查,GST 具有独特的病理学形态及免疫组化表型,光镜下可见主要由梭形细胞组成,伴或不伴少量上皮样细胞,以往常诊断为胃平滑肌瘤或神经源性肿瘤。CD34 与CD117 对GST的诊断具有较好的特异性及敏感性,CD117 几乎在所有的GST 中表达,CD34 阳性表示起源于间叶细胞,在GST 中具有较高的表达率(50% ~80%),但特异性较CD117 稍差,因此,临床上常将两者联合应用,以与其他间叶组织肿瘤包括平滑肌瘤或肉瘤、神经纤维瘤等鉴别。但是绝大多数GST 手术前获得病理诊断较为困难,普通内镜下活检常难以取到病变组织,根据2009 年中国胃肠道间质瘤专家组诊断治疗共识意见,不适当的术前活检会导致肿瘤种植播散和出血,且大多数GST 能完整切除,因此不推荐术前常规活检[4]。因此,术前的各种影像学检查对于明确GST 的诊断及恶性潜能判断具有重要意义,胃镜及超声内镜(EUS)、CT 等是最常用的影像学检查方法。
胃镜检查通常是患者就诊后首先接受的常规检查。胃镜能观察到黏膜下肿物及肿物表面黏膜完整与否或有无溃疡,并能取活检行病理检查,胃镜仅对胃腔黏膜内的病变能显示清楚,然而GST 倾向于胃腔外生长,因此,胃镜容易漏诊,且难以了解肿瘤全貌,对肿瘤的大小和形态较难做出正确评估,对于恶性潜能评估则更困难。EUS 可清晰显示胃壁的各层结构,图像清晰度高,并可显示病变与胃壁的关系,有利于判断肿瘤的来源,定位较准确。EUS 显示较大范围的肿瘤能力有限,对于远处淋巴结转移和远处脏器转移显示较困难。CT 具有密度分辨力高、组织对比好的优势,可通过对肿瘤大小、形态、密度及与周围组织关系判断GST恶性潜能。本文通过与术后病理对比,探讨CT 影像学改变与恶性潜能的关系。本组资料共38 例患者,术后病理显示低度恶性17 例,高度恶性21 例。CT 影像资料与病理资料对比发现,肿瘤大小与恶性潜能高低关系密切,肿瘤≤5 cm 者低度恶性潜能可能性大,而>5 cm 者则高度恶性潜能可能性大(P =0.001);GST多呈圆形或椭圆形生长,少数呈分叶状或不规则,本研究发现,肿瘤形态与GST 恶性潜能高低无明显相关性(P=0.070);本组资料中,21 例肿瘤密度均匀,其中13 例为低度恶性潜能,8 例为高度恶性潜能,另外17例肿瘤密度不均匀,内部或边缘有坏死或液化,其中4例为低度恶性潜能,13 例为高度恶性潜能,结果显示肿瘤密度与GST 恶性潜能高低有明显相关性(P =0.025);本组病例中,肿瘤边界清晰24 例,其中低度恶性潜能14 例,高度恶性潜能10 例,边界模糊14 例,其中低度恶性潜能3 例,高度恶性潜能11 例,GST 恶性潜能高低与肿瘤密度具有明显相关性(P =0.043)。此外,2 例有肝脏转移或腹膜后转移,CT 诊断为胃癌,而术后病理显示均为高度恶性潜能GST。
综上所述,CT 表现中肿瘤大小、密度、与周围组织关系及有无转移等对GST 恶性潜能高低的评估具有一定的意义,当然,不能忽略其他检查手段,与EUS 等手段相互配合,充分发挥各自优势并相互弥补不足,提高术前诊断GST 并判断其恶性潜能高低,对于临床制定治疗方案及预后评估具有指导意义。
[1] Zhu WM,Li ZY,Liu H. The review of gastrio intestinal stromal tumor[J].Chinese Jounal Clinical Medicine,2007,6(8):44-46.朱为梅,李正勇,刘海. 胃肠间质瘤综述[J]. 中国现代临床医学杂志,2007,6(8):44-46.
[2] Yu JY,Ning HY. The eaming experience of world Health Organization classfication of tumor of digestive system (2000)[J]. Chinese Journal of Diagnosis Pathology,2004,11(1):1-3.虞积耀,宁浩勇.WHO(2000)消化系统肿瘤分类的学习心得[J].诊断病理学杂志,2004,11(1):1-3.
[3] Parfitt JR,Rodriguez-Justo M,Feakins R,et al. Gastrointestinal Kaposi's sarcoma:CD117 expression and the potential for misdiagnosis as gastrointestinal stromal tumour[J]. Histopathology,2008,52(7):816-823.
[4] Chinese Diagnosis and Treatment Experts Group for Gastrointestinal Stromal Tumors. Chinese consensus in diagnosis and treatment of gastriointestinal stromal tumor[J]. Chin J Pathol,2009,38(10):697-702.中国胃肠道间质瘤专家组. 中国胃肠道间质瘤诊断治疗共识[J].中华病理学杂志,2009,38(10):697-702.

