壳聚糖螯合凝胶层析法纯化血液超氧化物歧化酶
王保全, 平 娟 , 张永州, 黄继海,李昭华, 董先智, 庞晓斌, 李梅基
(1.河南大学 淮河临床学院,河南 开封 475001;2.中国科学院 生物物理研究所,北京 100101;3.河南大学 药学院,河南 开封475001;4.兰州大学 生物工程学院,甘肃 兰州730000)
超氧化物歧化酶简称SOD,是广泛存在于生物体内的一种可防止氧化损伤和缺失的活性酶[1],也是一种应用广泛的药用酶[2],具有抗衰老、预防辐射及治疗炎症等一系列功能[3],已经被广泛应用于食品及医药卫生行业。
1975年proath首次提出固定化金属螯合亲和层析(IMAC),并发展成为一种有效的生化分离技术[4],该方法是利用固定在基质上的过渡态金属离子和蛋白质表面的组氨酸、半胱氨酸、色氨酸等残基的配位作用,来实现对金属离子有亲和力的蛋白质的吸附和分离。其中组氨酸是与金属离子作用较强的氨基酸 ,含有较多组氨酸的蛋白质(如SOD)可以在IMAC介质中有效的保留,故多聚组氨酸已经成为最常用的蛋白质纯化标签[5]。在制备亲和介质时,常用的金属离子有Cu2+,Zn2+和Ni2+等,常用的螯合配基有亚氨基二乙酸 (IDA),三羧基甲基乙二胺(TED),次氨基三乙酸(NTA)等[6-7]。固定化螯合亲和色谱常常以凝胶为载体,如在SephadexG-75或者DEAE-superpose等凝胶上用化学交联方法引入螯合剂IDA,再通过交联固定和亲和配 (Ba2+,Cu2+,Zn2+)。用该方法制备的凝胶介质生产成本很高,软基质很易被压缩,不易被放大生产。近年来,随着基因工程下游技术的发展,基因重组蛋白质的分离纯化技术越来越显示其重要性,金属螯合层析技术(IMAC)分辨率高、选择性好,能在常规的变性条件下及非变性条件下进行蛋白质组分分离纯化。研究表明[8-9],影响金属螯合层析的因素很多,但是决定色谱填料分离效果的主要因素在于填料的性质、基质种类、配基及所螯合的金属离子种类等。国外有报道用硅胶来制备螯合介质[10-11],但硅胶颗粒很难被改性,而且生物相容性和亲水性较差,易于吸附其他杂质,所以不适合工业化大规模生产应用。作者以壳聚糖为原料,以固定相偶联的配基-亚氨基二乙酸(IDA)及金属离子Cu2+发生螯合作用,制得金属亲和层析凝胶,改凝胶化学稳定性好,基质稳定,容易再生,并首次以聚合高分子电解质聚丙烯酸钠对传统血液超氧化物歧化酶提纯工艺进行改进。改进后的新工艺比传统血液提纯工艺大大缩短了分离流程,省去了氯仿、乙醇等有毒易污染的试剂。将金属亲和层析原理引入改进后的新工艺中,用于分离纯化血液SOD,达到了很好的纯化效果,为工业上放大生产提供了参考。
1 材料与方法
1.1 材料和仪器
新鲜猪血,北京市第五肉联厂提供;柠檬酸三钠,氯化铜,丙酮,北京化学试剂厂产品;聚丙烯酸(PAA),上海阿拉丁试剂总厂产品;不同相对分子质量聚丙烯酸钠(PAAS),由北京顺义希涛化学试剂厂合成,固含3.45%(质量分数);壳聚糖,脱乙酰度≥90%,Sigma公司进口分装;SOD活性试剂盒,南京建成生物公司产品;低相对分子质量标准蛋白质,华美生物技术公司产品;SOD标准品,华美生物技术公司产品;临苯三酚,国药集团产品;SephedexG-75,DEAE-sepherose-fast flow4B,瑞典 Pharmacia公司产品;UV-2010型紫外分光光度计,大型离心机,日本岛津公司制造;DYY-6C型电泳仪,北京六一仪器厂制造;超滤杯,FD-IC-50冷冻干燥机,北京博益康实验仪器有限公司制造;HD-5型紫外监测仪,上海沪西分析仪器厂制造;其他试剂均为分析纯。
1.2 试验方法
1.2.1 SOD的制备及PAAS相对分子质量对酶活性的影响 取新鲜抗凝血液,4 000 r/min离心45 min,或新鲜抗凝血静止过夜分层后取下层血球,待用。取8份100 mL血球,加等体积含质量分数0.6%Tritonx-100的蒸馏水,磁力30 min搅拌溶血,然后加溶血体积的20%的固含为3.45%PAAS(相对分子质量分别为 3 000,10 000,50 000,100 000,500 000,1 000 000,2 000 000,4 000 000)在水浴锅中,将加入体积分数20%PAAS后的溶血液加热到60℃。等液体温度达到70℃时再加10%溶血体积的氯化铜(质量分数为 10%)作为激活剂,恒温10 min。将热变后的溶血液用细纱过滤,收集滤液(观察酶液颜色),加入2倍滤液体积预冷-4℃的丙酮,离心收集沉淀,沉淀(约2 mL)用pH为7.6的PBS溶解(加50倍于沉淀体积的PBS)。将上述酶液装入超滤杯中,选用相对分子质量为10 000的超滤膜反复超滤2~3次,收集膜上酶液,即为粗酶液。
1.2.2 壳聚糖自制亲和凝胶的制备 取4 g壳聚糖,加入体积分数1%的CH3COOH溶液,搅拌至完全溶解,滴入戊二醛至一定质量分数(2‰),以质量分数(30%~40%)NaOH溶液调至碱性,磁力搅拌交联6 h,在快速搅拌下加入NaOH溶液,使壳聚糖呈颗粒状沉淀。收集沉淀,水洗至中性。称取2 g NaBH4搅拌还原,水洗至中性,得戊二醛交联湿状壳聚糖。取其悬液调pH到12,取一定量交联壳聚糖悬液滴入一定量的环氧氯丙烷,于恒温振荡器中振荡反应2 h,将其洗涤至中性,抽干。按活化壳聚糖的比例加入2 g亚氨基二乙酸钠在恒温振荡器中,于一定温度(65℃)反应一段时间(24 h)。洗涤至中性,用布氏漏斗抽干,得壳聚糖亲和凝胶。
1.2.3 Cu2+的螯合、平衡和SOD的纯化 取以壳聚糖为载体合成的亲和吸附剂装柱(4 cm×20 cm),用0.1 mol/L的CuSO4灌注至饱和吸Cu2+。螫合柱用含0.5 mol/L 的 NaCI,pH 7.5,0.05 mol/L 的磷酸钾缓冲液进行平衡过夜后,取猪红细胞Cu-Zn SOD粗提液上样。先以上述平衡液进行平衡洗脱,再以含0.5 mol/L NaCl,0.05 mol/L L 咪唑的 pH 7.5,0.05 mol/L 的磷酸钾缓冲液进行洗脱。控制体积流量为15 mL/h,每2 mL收集一管,并以紫外检测仪检测,冷冻干燥。
1.2.4 SOD凝胶过滤层析纯化 预先装好Sepedex G-75 柱(1 cm×60 cm),柱子事先用 0.05 mol/L pH 7.6的PBS平衡过夜,然后把上述酶液上柱,紫外监测仪检测,收集蛋白质活性峰,用恒流泵控制体积流量为1 mL/min,每5 min收集一管,收集上述各个蛋白质峰,经超滤浓缩、透析除盐后,冷冻干燥24 h得到浅蓝色固体粉末。详见文献[12]。
1.2.5 SOD离子交换层析纯化 预先装好的DEAE-superpose-fast flow 4B 柱(2 cm×60 cm)用 0.05 mol/L pH为7.8的PBS平衡过夜,酶液上柱后,用0~2 mol/L的氯化钠溶液进行梯度洗脱,并用紫外监测仪检测,恒流泵控制体积流量为2~3 mL/min,收集蛋白质活性峰 ,收集上述各个蛋白质峰,经超滤浓缩、透析除盐后,冷冻干燥24 h得到浅蓝色固体粉末。详见文献[13]。
1.2.6 蛋白质含量测定 考马斯亮蓝方法测定,以牛血清白蛋白质浓度为横坐标,蛋白质紫外吸收值为纵坐标,绘制蛋白质标准曲线,其线性回归方程为:A=0.102C-0.025 3,R2=0.991 5。
1.2.7 SOD活力的测定 按照SOD试剂盒说明进行。
1.2.8 酶紫外吸收光谱测定 取经纯化的酶,溶于适量的蒸馏水,用UV-2001型紫外分光光度计在200~500 nm范围内进行紫外扫描[14]。
1.2.9 SDS-PAGE聚丙烯酰胺凝胶电泳 测定相对分子质量和纯度分离胶质量分数12%,浓缩胶质量分数5%,电极缓冲液为pH 8.3 Tris-Gly缓冲液;电流条件:12 mA 50 min,50 min 后 24 mA,2~3 h。
2 结果与分析
2.1 壳聚糖螯合金属层析介质的作用机理
壳聚糖螯合金属层析技术是建立在蛋白质表面的氨基酸和固定化金属离子的亲和力的不同来进行蛋白质分离纯化的一项技术,过渡态的金属离子能够与电子供体,如氮,硫,氧等原子以配位键结合,金属离子上剩余的空轨道是电子供体的配位点,当它在溶液中时会被水分子或阴离子占据。然而,当蛋白质表面氨基酸残基与金属离子的结合力较强时,氨基酸残基的供电原子就会与金属离子结合形成复合物,取代原先结合的水分子或阴离子,这样就能使蛋白质分子结合在固体表面。SOD含有相对较多的组氨酸上的咪唑基,可以与螯合柱上的金属离子特异性结合,然后通过特殊质子化洗脱而达到分离纯化,作用机理见图1。
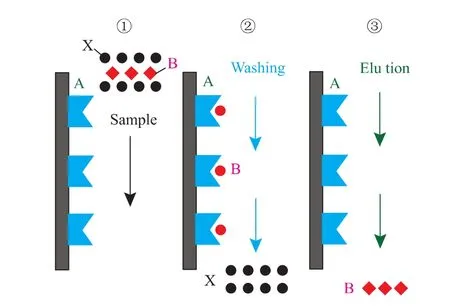
图1 壳聚糖螯合凝胶层析对蛋白质的作用机理Fig.1 Mechanism of the chitosan gel chromatography on the protein
2.2 不同相对分子质量聚丙烯酸钠对SOD酶活性的影响
固定PAAS用量为20%(体积分数),氯化铜用量为10%,另外pH值恒定7.8,考察不同相对分子质量(3 000,10 000,50 000,100 000,500 000,1 000 000,2 000 000,4 000 000)的 PAAS 对酶活性的影响,并从实验现象和酶液颜色来确定最佳相对分子质量,这些相对分子质量涉及了低相对分子质量、中相对分子质量,高相对分子质量3个阶段。实验发现,在相对分子质量大于10 000时,酶液颜色有显著变化。中相对分子质量和高相对分子质量PAAS,由于其黏性很大,导致酶液过滤困难,并且高分子PAAS由于对血液细胞有很强的蓄积作用,导致热变反应很不彻底,所以选用低相对分子质量的PAAS效果较好,见图2。
2.3 纯化各步骤层析谱图
由层析谱图3—5可以知道,超滤浓缩后的粗酶液,经离子交换和凝胶过滤层析,金属亲和凝胶层析纯化后,均出现两个明显的蛋白质活性吸收峰,经活性检测得知,大峰中SOD的活性明显较高,小峰没有明显的蛋白质活性,验证了金属亲和凝胶层析的可靠性和代替传统昂贵填料的可能性。

图2 不同相对分子质量聚丙烯酸钠对SOD酶活性的影响Fig.2 Effect of the molecular weight of PAAS on the enzyme activity

图3 壳聚糖金属亲和层析谱图Fig.3 Chistosan metal affinity chromatography spectra
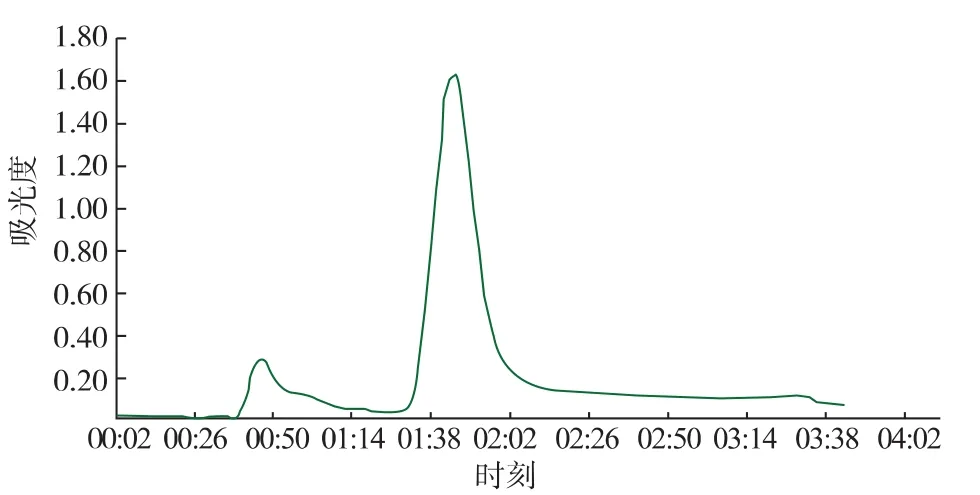
图4 凝胶过滤层析谱图Fig.4 Gel filtration chromatography spectra
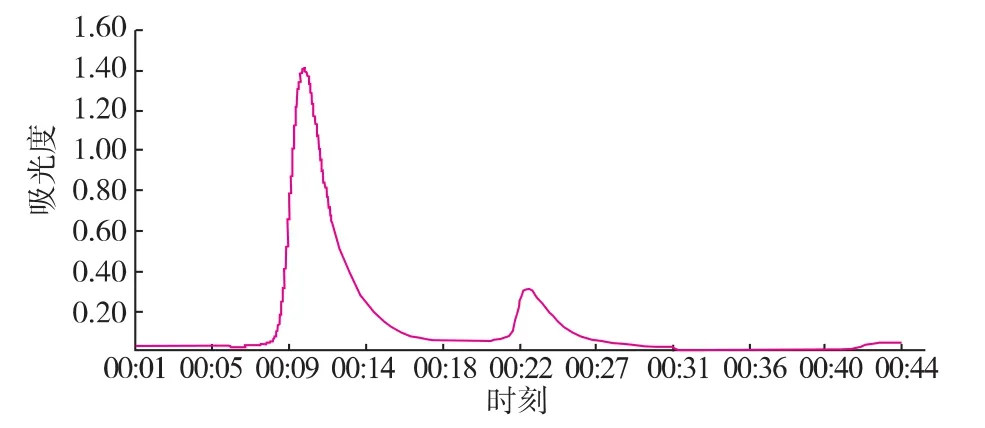
图5 离子交换层析谱图Fig.5 Ion exchange chromatography spectra
2.4 酶紫外吸收特性和酶种类鉴定结果
取金属亲和层析后冷冻干燥的纯化酶在200~550 nm范围内扫描产品,酶的紫外吸收光谱表明最高吸收峰在 259、258 nm 处(UV ABS:0.328),次高峰在 265、266 nm 处 (UV ABS:0.314), 呈典型 Cu Zn-SOD吸收光谱曲线[15]。如图6所示。

图6 纯化后酶的紫外吸收图谱Fig.6 Ultraviolet absorption of the enzyme
2.5 血液SOD纯化后各步骤凝胶电泳图及相对分子质量的鉴定
如图7—9所示。
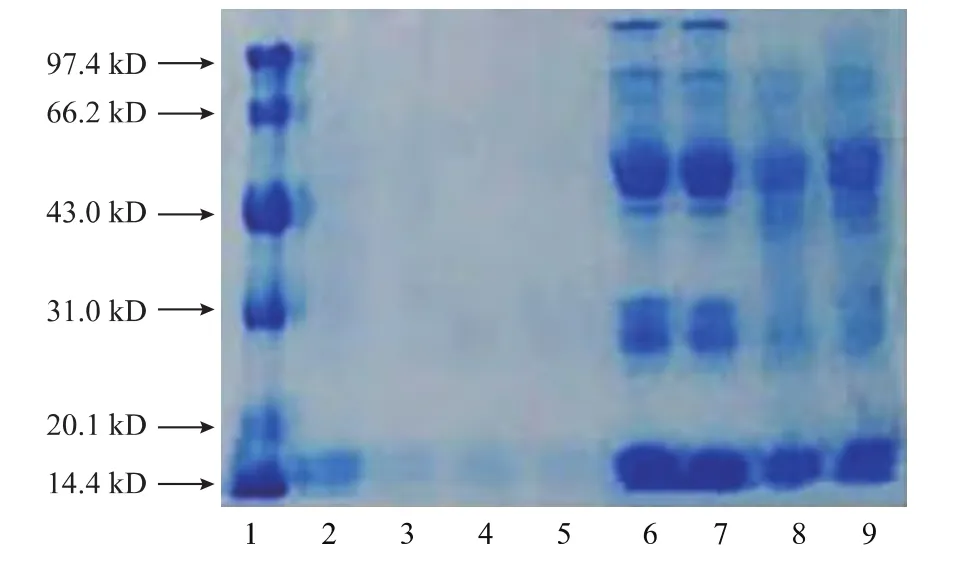
图7 凝胶过滤层析各步电泳图Fig.7 Electrophoretogram of Purification steps by gel filtration chromatography
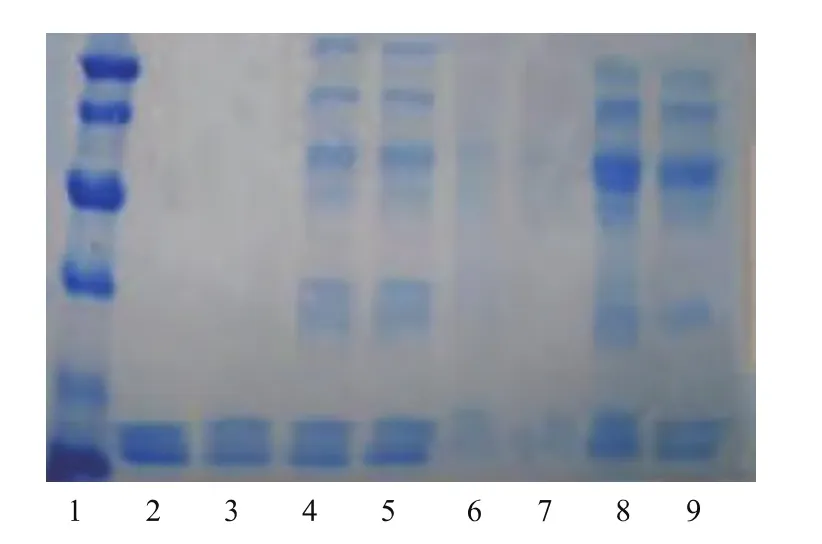
图8 离子交换层析各步层析谱图Fig.8 Electrophoretogram of Purification steps by ion exchange chromatography

图9 壳聚糖金属亲和层析各步纯化谱图Fig.9 Electrophoretogram ofPurification stepsby chitosan affinity chromatography
2.6 血液(取新鲜猪血100 mL)SOD各步纯化结果
100 mL的新鲜血球经金属螯合层析纯化后,虽然酶活性不及传统的离子交换和凝胶过滤层析等方法的,但是酶活性有很大的提高,产品得率和活性回收率分别达到15.5%和42.6%。见表1。

表1 血液SOD提纯各个步骤纯化结果表Table 1 Results of the purification steps of blood SOD
3 结语
层析纯化是获得蛋白质多肽类药物精品最关键的一步,对SOD的酶活性有很大的提高。作者制备了含壳聚糖为基础基质的螯合凝胶,并成功螯合了金属Cu2+,采用增加离子强度或者降低pH值来洗脱纯化蛋白质。国外对层析纯化的多步组合应用研究较为活跃,Cui L Y等[16]依次采用热处理、乙醇氯仿沉淀、冷丙酮沉淀和DEAE离子交换层析方法和羧甲基纤维素阳离子交换层析方法纯化SOD粗品;Cheryl L等[17]人采用肝磷脂琼脂糖凝胶层析柱(2.5 cm×20 cm)层析、Q-琼脂糖凝胶层析、伴刀豆球蛋白质A-琼脂糖凝胶层析、MonoQ-琼脂糖凝胶层析、Mono S-琼脂糖凝胶层析等步骤纯化小鼠肺细胞外液SOD,使酶活力进一步提高。目前国内外SOD的纯化材料多用DEAE或者Sephedex等昂贵填料[18],导致生产纯化过程中纯化成本较高。金属螯合层析和普通的层析方法相比具有一些特殊的优点:如亲和配基Cu2+、Zn2+价廉易得,可以在高盐浓度下操作,稳定,容易再生,介质化学稳定性好,刚性强。制备的新型金属螯合层析介质可用于蛋白质的分离纯化,相比DEAE-52具有吸附容量大、吸附特异性高等优点,但由于金属螯合层析采用剧烈的洗脱条件洗脱,纯化效果略低于离子交换层析和凝胶过滤层析的。
致谢:感谢中科院研究平台为本实验提供了相关设备支持,特别感谢刘翠、李昭华、李梅基等给予的帮助。感谢河南大学药学院相关老师的帮助,特别是中药实验室李勉老师、方明月老师,在此一并感谢。
[1]杜秀敏,殷文璇,张慧,等.超氧化物歧化酶(SOD)的研究进展[J].中国生物工程杂志,2003,23(1):48-50.DU Xiumin,YIN Wenxuan,ZHANG Hui,etal.Theresearchingprogressofsuperoxidedismutase [J].Progressin Biotechnology,2003,23(1):48-50.(in Chinese)
[2]张翊,王军志,吴勇杰.超氧化物歧化酶药用研究进展[J].药学学报,2003,38(1):71-74.ZHANG Yu,WANG Zhijun,WU Yongjie.Progress of pharmaceutical studies on superoxide dismutase[J].Acta Pharmaceutica Sinica,2003,38(1):71-74.(in Chinese)
[3]李东旭,吴蕾,任云霞.超氧化物歧化酶的提取和纯化技术研究进展[J].食品研究与开发,2008,29:183-185.LI Dongxu,WU Lei,REN Yunxia.The progress of extraction and purification technology of superoxide dismutase[J].Food Research and Development,2008,29:183-185.(in Chinese)
[4]魏琪,姚汝华,鲍时翔.固定化金属螯合亲和膜色谱柱的制备及纯化铜锌超氧化物歧化酶的研究[J].中国色谱,2000,18(4):361-365.WEI Qi,YAO Ruhua,BAO Shixiang.Preparation of immobilized metal-chelated affinity membrane and its application to purification of Cu/Zn-Superoxide dismutase[J].Chinese Journal of Chromatography,2000,18(4):361-365.(in Chinese)
[5]李淑娟,孙永亮.金属螯合亲和色谱填料的制备及其在六聚组氨酸融合蛋白分离中的应用[J].中国生物工程学报,2007,23(5):942-946.LI Shujuan,SUN Yongliang.Preparation of metal chelate affinity chromatographic medium and its application in the purification of 6 Histidine-tagged protein[J].Chinese Journal of Biotechnology,2007,23(5):942-946.(in Chinese)
[6]李蓉,陈国亮,赵文明.固定金属离子亲和色谱——蛋白质分离的方法、原理、特性和应用[J].化学通报,2005(5):352-356.LI Rong,CHEN Guoliang,ZHAO Wenming.Immobilized metal ion affinity Chromatography—Methods,Principles,Characteristics and applications for protein separation[J].Chemistry,2005(5):352-356.(in Chinese)
[7]李蓉,邸泽梅,陈国亮.金属螯合亲和色谱中固定金属与蛋白质的作用[J].分析化学杂志,2002,30(5):552-555.LI Rong,DI Zemei,CHEN Guoliang.Interaction between immobilized metal and protein in metal chelate affinity chromatography[J].Chinese Journal of Analytieal Chemistry,2002,30(5):552-555.(in Chinese)
[8]李蓉,邸泽梅,陈国亮.流动相组成、浓度和pH对蛋白质在金属螯合柱上的保留特性的影响[J].中国色谱,2001,19(5):385-389.LI Rong,DI Zemei,CHEN Guoliang.Influences of the mobile phase constitution,salt concentration and pH value on retention characters of proteins on the metal chelate column[J].Chinese Journal of Chromatography,2001,19 (5):385-389.(in Chinese)
[9]Abudiab T,Beitle J R R.Preparation of magneticimmobilized metal affinity separation media and its use in the isolation of proteins[J].Jour nal of Chromatogrphy A,1998,795:211-217.
[10]王晓军,范代娣.金属螯合亲和层析在纯化重组类人胶原蛋白中的应用[J].2005,19(3):410-414.WANG Xiaojun,FAN Daidi.Purification of recombinant Human-like collagen by using metal chelated affinity chromatography[J].2005,19(3):410-414.(in Chinese)
[11]赵辉,沈梦长,钱爱,等.Cu-Zn SOD的硅胶吸附分离法[J].中国生化药物杂志,1995,16(4):151-154.ZHAO Hui,SHEN Mengchang,QIAN Ai,et al.The separation method of Cu,Zn-Superoxide dismutase (SOD) by silica gel absorption[J].Chinese Journal of Biochemical Pharmaceutics,1995,16(4):151-154.(in Chinese)
[12]黄晓佳,袁光谱,王爱勤.模板交联壳聚糖对过渡金属离子吸附性能研究[J].离子交换与吸附,2000,16(3):262-266.HUANG Xiaojia,YUAN Guangpu,WANG Aiqin.Adsorption of the transition metal ions on cross-linked chitosan resin prepared in presence of Zn(Ⅱ) tablate[J].Ion Exchange and Adsorption,2000,16(3):262-266.(in Chinese)
[13]李豪,车振明,周太刚,等.猪血红细胞超氧化物歧化酶的纯化研究[J].化学与生物工程,2005(12):21-25.LI Hao,CHE Zhenming,ZHOU Taigang,et al.Purification of superoxide dismutase from porcine erythrocyte[J].Chemical and Biological Engineering,2005,12(3):21-25.(in Chinese)
[14]赖雅平,王东耀,刘汝锋,等.猪血中超氧化物歧化酶的分离工艺及稳定性研究[J].食品研究与开发,2008,29(4):10-13.LAI Yaping,WANG Dongyao,LIU Rufeng,et al.The extraction thchnies and character of superoxide dismutase from fresh pig blood[J].Food Research and Development,2008,29(4):10-13.(in Chinese)
[15]韩文清,栗淑媛,乔辰.鄂尔多斯高原碱湖钝顶螺旋藻SOD的纯化与性质研究[J].内蒙古师范大学学报,2008,7(6):780-783.HAN Wenqing,LI Shuyuan,QIAO Chen.Purification and properties of SOD in spirulina platensis from erdos plateau alkaline lake[J].Journal of Inner Mongolia Normal University,2008,7(6):780-783.(in Chinese)
[16]CUI L Y,AN L W.Purification and paritial characterization of Cu,Zn superoxide dismutase from haemolymph of oriental river prawn macrobrachium[J].Aquaculture,2007,270(14):559-565.
[17]Chery F,Jan E.Purification and characerization of extracellular superoxide dismutase in mouse lung[J].Biochemical and Biophysical Research Communications,2000,275(2):542-548.
[18]Namir I A,Haddad Q,Yuan S.Purification and some properties of Cu,Zn superoxide dismutase from Radix lethospermi seed kind of Chinese traditional meidicine[J].Journal of Chromatography B,2005,818(2):123-131.

