极低频交变磁场对过氧化氢酶活性的影响
薛丽萍 , 孟亚萍 , 赵娟娟 , 杨 哪 , 徐学明 *,2
(1.江南大学 食品学院,江苏 无锡 214122;2.食品科学与技术国家重点实验室,江苏 无锡 214122)
过氧化氢酶(Catalase,CAT)可以催化 H2O2分解成H2O和O2,广泛存在于动物、植物和微生物体内。该酶结构中特殊的铁卟啉环是其主要的活性中心[1]。过氧化氢酶不仅是生物演化过程中建立起来的生物防御系统的关键酶之一,并在食品、医药、纺织、造纸、环保等行业具有重要的应用[1-2]。对于许多带金属活性中心基团的酶,其运动方向会在磁场作用下发生变化,并且洛仑兹力会使拉默半径发生改变,从而导致大分子构相发生扭曲或变形,最终改变酶的活性,细胞正常的生理活动也会受到影响[3]。Haberditzl W首次报道了在非匀强磁场的作用下,过氧化氢酶的酶活发生可预估的增加,这可能是一种继发效应,即顺磁性氧被加速从反应部位移除[4]。Vainer L M等在1978年报道了静磁场暴露下对过氧化氢酶和[Fe3+(EDTA)]2催化H2O2分解速率的影响,当磁场强度达到0.8 T时,过氧化氢酶和 [Fe3+(EDTA)]2的催化速率分别提高了(20±5)%和(24±5)%[5]。张军等研究了强稳恒磁场对离体牛肝CAT构象的影响,过氧化氢酶经过0.23~0.61 T磁场处理,其紫外光谱和荧光光谱都出现了吸收峰的改变,同时酶活也有一定程度的增加[6]。目前,关于磁场对过氧化氢酶的影响的研究主要集中于脉冲磁场或者静磁场,研究参数主要是磁场强度和脉冲数,而关于极低频交变磁场对过氧化氢酶影响的研究较少。磁场是在一定空间区域内连续分布的矢量场,N、S极不断的交替变化的磁场称为交变磁场。极低频磁场通常是指频率在0~300 Hz之间的磁场[7]。而世界卫生组织(World Health Organization,WHO)则将频率在0~100 kHz之间的磁场统称为极低频磁场[8]。
作者所在课题组采用通电螺线管产生的交变磁场对过氧化氢酶进行处理,考察了不同温度、频率、pH、磁场强度及时间对过氧化氢酶的活性和二级结构的影响,初步探讨极低频交变磁场对过氧化氢酶的作用机理。
1 材料与方法
1.1 主要材料与仪器
过氧化氢酶 2 000~5 000 U/mg Protein,Sigma进口分装;磷酸二氢钾、氢氧化钠、过氧化氢(质量分数30%)、去离子水,国产。
1.2 仪器与设备
螺线管极低频交变磁场处理装置,作者自行研制;TU-1900型双光束紫外可见分光光度计、恒温水浴锅、MOS-450型AF-CD圆二色光谱仪,法国Biologic公司制造;AL204型电子天平、特斯拉计,国产。
1.3 实验方法
1.3.1 极低频交变磁场试验环境 极低频交变磁场采用变频电源生成35~400 Hz、最大功率2 000 W的正弦波,信号电流经限流电阻并激励螺线管,生成低频交变磁场。样品置于双螺线管中心,且温度由恒温循环水浴控制,装置如图1所示。交变磁场强度由HT108型特斯拉计的纵向传感器检测,交变磁场频率分别为 50、100、200、400 Hz; 磁场强度分别为 200、300、400、500 mT。
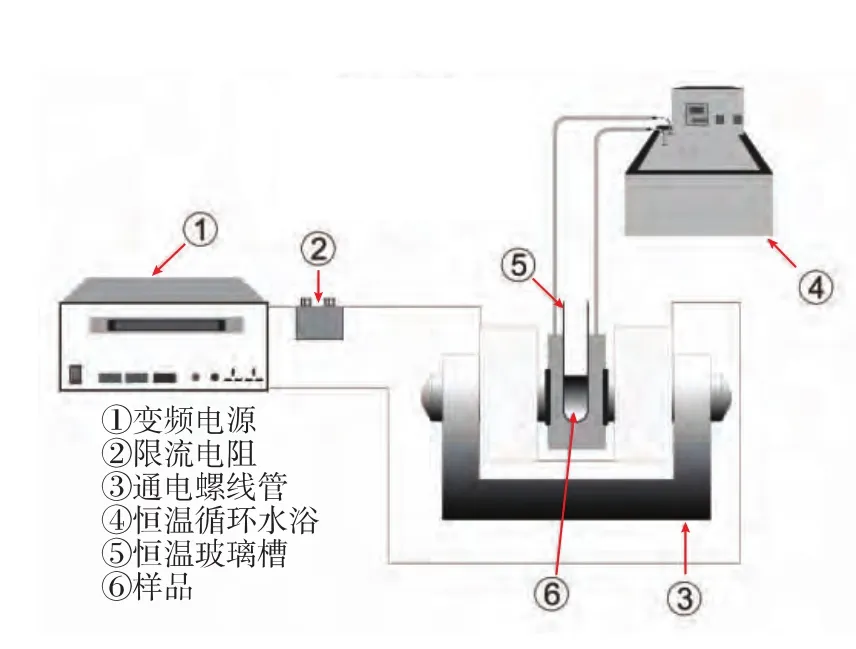
图1 极低频交变磁场装置示意图Fig.1 Extremely low frequency alternating magnetic field devices
1.3.2 酶活测定 将过氧化氢酶液放入极低频磁场中处理一定时间后测定酶活,以相同温度、相同时间且未经过磁场处理的酶液作为对照。酶活测定方法参考Beers and Sizers方法并进行改进[9]。反应池:1 cm石英比色皿,1 mL质量分数0.18%过氧化氢 (溶于0.05 mol/L pH 7.0磷酸盐缓冲液),0.1 mL酶液(溶于0.05 mol/L pH 7.0磷酸盐缓冲液),1 mL去离子水,以去离子水为参比。混合前分别在25℃水浴中保温5 min。底物与酶液混合后立即在240 nm波长下测定吸光度变化,每10 s记录一次吸光度A,根据酶反应动力学曲线最初直线段的斜率(△A/t)计算酶活力。在1 min内引起吸光度增加0.001所需的酶量为一个酶活单位(以U/min表示)。相对酶活的计算如式(1)。

1.3.3 不同磁场条件对过氧化氢酶酶活的影响
1)不同磁场暴露时间:固定温度为25℃,酶液pH 7.0,磁场强度 200 mT,磁场频率 50 Hz,磁化时间分别为 0.5、1、2、4、6、8 h。
2)不同磁场强度:固定温度为25℃,酶液pH 7.0,磁化时间8 h,磁场频率50 Hz,磁场强度分别为200、300、400、500 mT。
3)不同交变频率:固定温度为25℃,酶液pH 7.0,磁场强度200 mT,磁化时间8 h,磁场频率分别为50、100、200、400 Hz。
4)不同温度:固定酶液pH 7.0,磁场强度200 mT,磁化时间8 h,磁场频率50 Hz,温度分别为25、35、45、55 ℃。
5)不同酶液 pH:固定温度为 25℃,时间 8 h,磁场强度200 mT,磁场频率50 Hz,酶液pH分别为5.0、6.0、7.0、8.0。
1.3.4 二级结构测定 将过氧化氢酶溶液在不同的磁场环境中暴露2 h,以未进行磁化处理的酶液作为对照样,通过圆二色谱仪测定,石英样品池的光程为0.1 cm,扫描速度1 nm/s,过氧化氢酶质量浓度为 0.1 mg/mL,测定波长范围为 190~250 nm,圆二色谱数据为3次扫描平均值。
2 结果与分析
2.1 磁场暴露时间对过氧化氢酶的影响
从图2可以看出,不论是否经过磁场暴露,实验体系下过氧化氢酶的酶活都随着时间的增加逐渐下降,并且呈现一定的波动。在磁场强度200 mT,磁场频率50 Hz的条件下,酶活在前2 h下降速度较快,而4 h处小幅上升,之后又缓慢下降。而对照组的酶活下降趋势则较为平缓。从相对酶活的变化趋势可以看出,前1 h的相对酶活都在100%以上,说明在此磁场条件下可以造成酶活提高。此后相对酶活的下降速度较快,同时在4 h处出现了波动。本实验结果与刘勇等[10]报道的研究结果有相似之处,即0.15、0.30、0.45 T磁场处理后酶活性降低比较缓慢,并在开始一段时间内酶活性明显增大。本研究中酶活降低的速率大于对照样品且波动较大,这可能是由于本实验中采用了极低频交变磁场,在环境体系中会造成带电蛋白质表面形成不同方向的感应电流,产生安培力而造成蛋白质空间构象变化[11]。而已有的文献报道,采用稳恒磁场和静态磁化法,对酶的作用力较小。

图2 过氧化氢酶在磁场处理不同时间的酶活和相对酶活变化Fig.2 Effect of time on the specific and relative enzyme activity of catalase under magnetic field
2.2 磁场强度对过氧化氢酶的影响
从图3可以看出,不同磁场强度下,酶活都呈现下降趋势,但变化趋势不一。总体上,随着磁场强度的增加,酶活下降速率增加。可以看出,在前1 h,500 mT磁场下酶活和相对酶活的下降速率最大,但同时此磁场条件下相对酶活出现了较大波动,从2 h处的47.26%增加到4 h处的73.06%,可能是因为过氧化氢酶在较强的磁场强度下,侧链形状发生了变化,从而产生了不同的变化趋势。
同时,相对酶活的变化趋势波动性更大,说明磁场强度可以更大程度地改变酶的结构。酶活性随磁场改变的无规律性是磁场改变酶活性效应的一个特征,反映了磁场对酶的作用是高度非线性的生物学过程。酶的磁效应极其复杂,影响因素众多,“非线性”的表象正是其非线性作用本质规律的反映[12]。
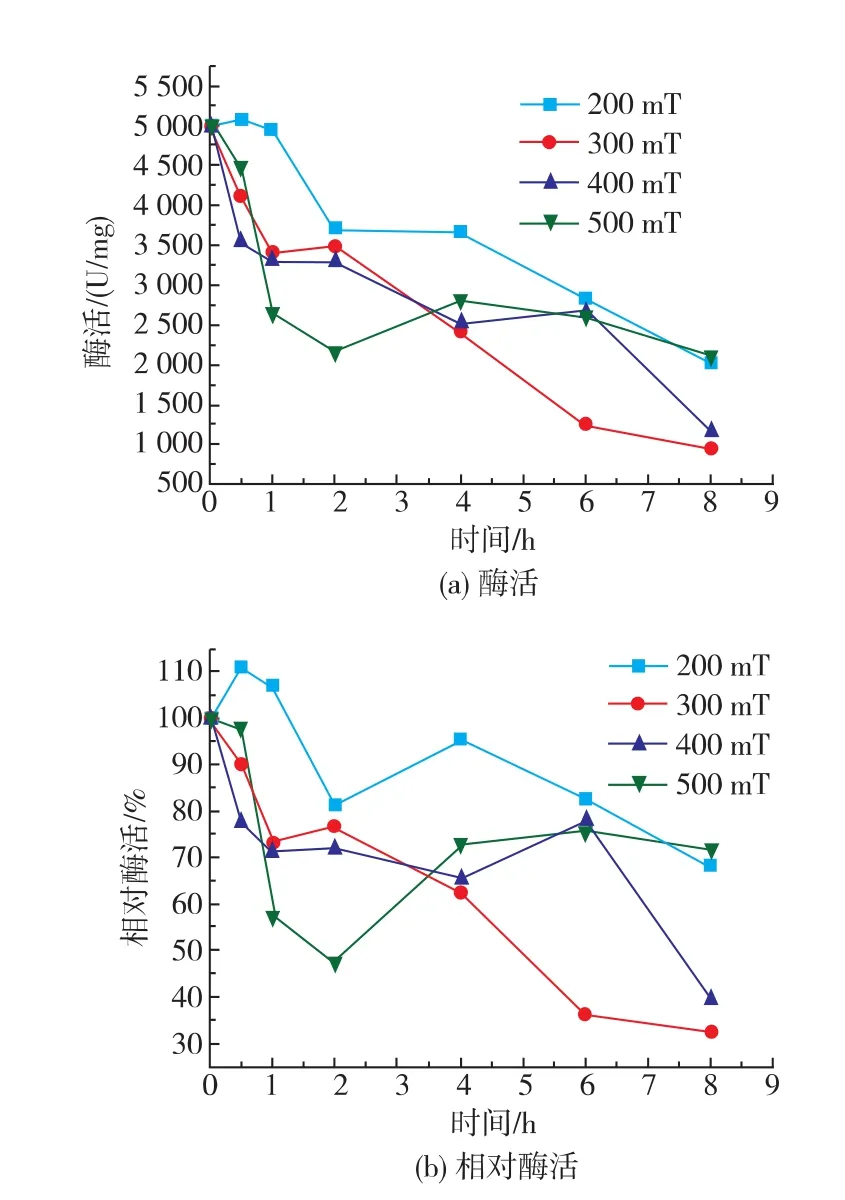
图3 过氧化氢酶在不同磁场强度下的酶活和相对变化Fig.3 Effect of the magnetic field intensity on the specific and relative enzyme activity of catalase
2.3 交变频率对过氧化氢酶酶活的影响
从图4可以看出,在不同交变频率下酶活和相对酶活都呈现下降趋势且不同频率下酶活减小的速率不同。随着频率的增加,酶活减小的程度放缓。50 Hz频率下的酶活始终大于其他3种转速下的酶活。100 Hz下前2 h,酶活较高,相对酶活为102.84%,暴露4 h后则急剧减小到28.24%。200 Hz和400 Hz下酶活变化大体相同,都维持在较低的数值。说明频率升高会影响酶的活性,尤其是较高的频率会抑制酶活。频率越高在蛋白质表面感应的环形分子电流频率就越高,相邻蛋白质之间或蛋白质内部产生的交变安培力可能对其酶活有较大的影响。


图4 过氧化氢酶在不同磁场频率下的酶活和相对酶活变化Fig.4 Effect of the magnetic field frequency on the specific and relative enzyme activity of catalase
2.4 磁场暴露下温度对过氧化氢酶酶活的影响
从图5中可以发现,在实验的4个不同温度下,酶活的变化趋势基本相同,酶活随着时间的增加逐渐减小,同时在2~4 h之间出现了波动,与前面所述时间变化趋势大体相似。25℃条件下酶活始终高于其他条件下的,35℃和45℃条件下酶活大小交替增加,55℃下酶活始终处于较低的状态。张军[13]等对4℃和25℃、0.23 T磁场处理下离体过氧化氢酶研究发现,相同磁场在处理温度不同的条件下,引起的磁效应是不相同的,并且影响效应随温度的增加趋于显著。
与此同时,可以发现25、35、45℃的相对酶活变化趋势相差不大,只是减少的程度不同,这可能是过氧化氢酶的最适温度不同造成的。而55℃的变化趋势却和前三者差异巨大,55℃条件下相对酶活急剧增加,最高点为相同时间、温度下对照酶活的2 142.86%,由于过氧化氢酶在55℃放置8 h已经完全失活酶活值为0,故8 h处相对酶活无法计算。究其原因,可能是因为极低频磁场和高温共同作用下较大程度地改变了过氧化氢酶的结构,使其更加趋于稳定,获得较好的相对耐高温特性。这个推论将在后面的实验中进一步验证。
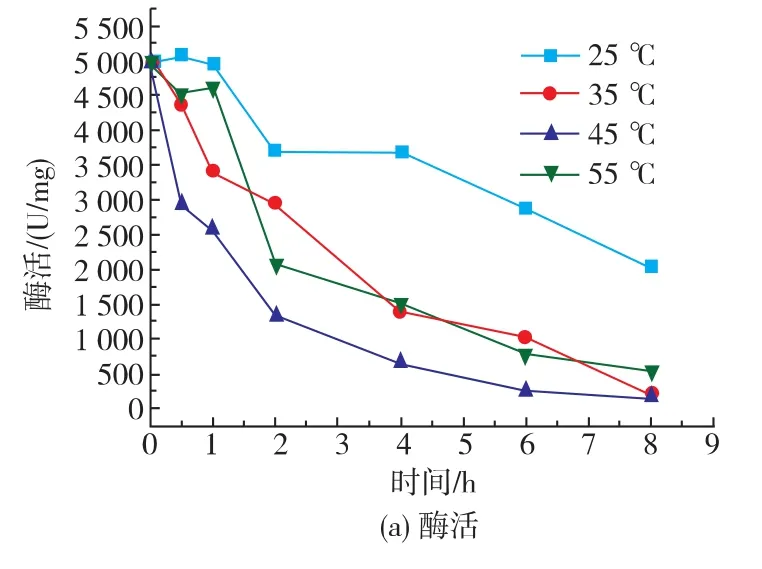
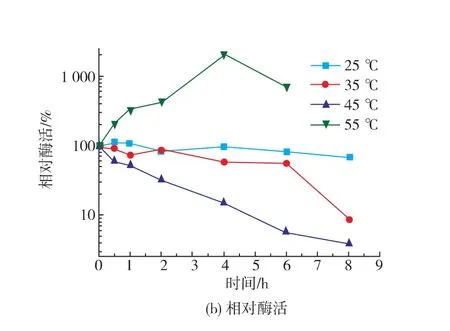
图5 过氧化氢酶在不同温度下的酶活和相对酶活变化Fig.5 Effect of temperature on the specific and relative enzyme activity of catalase
2.5 酶液pH对过氧化氢酶酶活的影响
从图6看出,pH影响酶活变化的趋势较为明朗,且与之前所述变化趋势大体一致。由于过氧化氢酶的最适pH是7.0,故最适pH周围酶活较高,而在pH 5情况下酶活受到抑制,故酶活较低。相对酶活的变化趋势与酶活变化相似,说明在磁场条件相同时,对酶的影响因素主要是pH,而这也是酶活和相对酶活变化较为规律的原因。pH不同则酶表面所带电荷量有差异,在交变磁场下于酶表面产生的感应电流大小有异则是对酶活造成影响的主要原因。
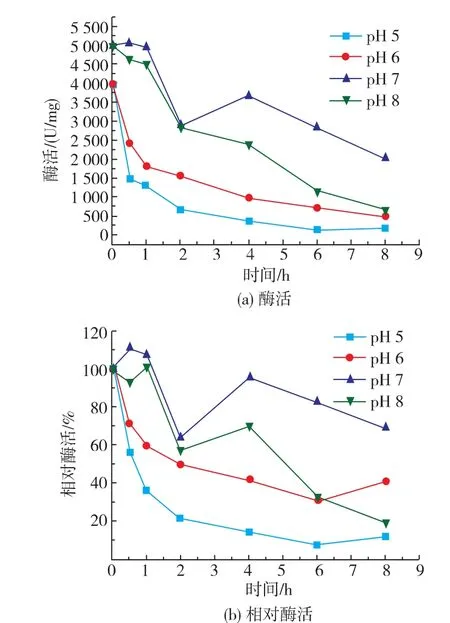
图6 过氧化氢酶在不同pH下的酶活和相对酶活变化Fig.6 Effect of pH value on the specific and relative enzyme activity of catalase
2.6 磁场处理对二级结构的影响
圆二色谱法(CD)是最常用的分析蛋白质二级结构的方法,通过CD图谱能分析计算α-螺旋、β-折叠、β-转角、无规卷曲等各组分的含量。典型α-螺旋结构在 208、222 nm处有两个负峰,典型β-折叠结构在216 nm处有一个负峰[14]。由于温度和磁场强度对酶活影响较大,故选择了25℃、200 mT,25℃、500 mT,55℃、200 mT 3个磁场条件进行CD远紫外图谱扫描,并且做了对照组的扫描。
从图7可以看到,在25℃下不同的磁场条件对过氧化氢酶的二级结构有一定的影响,但是CD图谱的形状相差不大,可见二级结构差异不大。对照组的圆二色光谱图中在209、215 nm处有两个明显负峰,表明过氧化氢酶的二级构象中同时存在α-螺旋和β-折叠结构,经过200、500 mT磁场处理后,过氧化氢酶的CD图谱发生了一些变化,209和215nm处的负峰值略有上升,并且随着磁场强度的增强,负峰值逐渐上升。
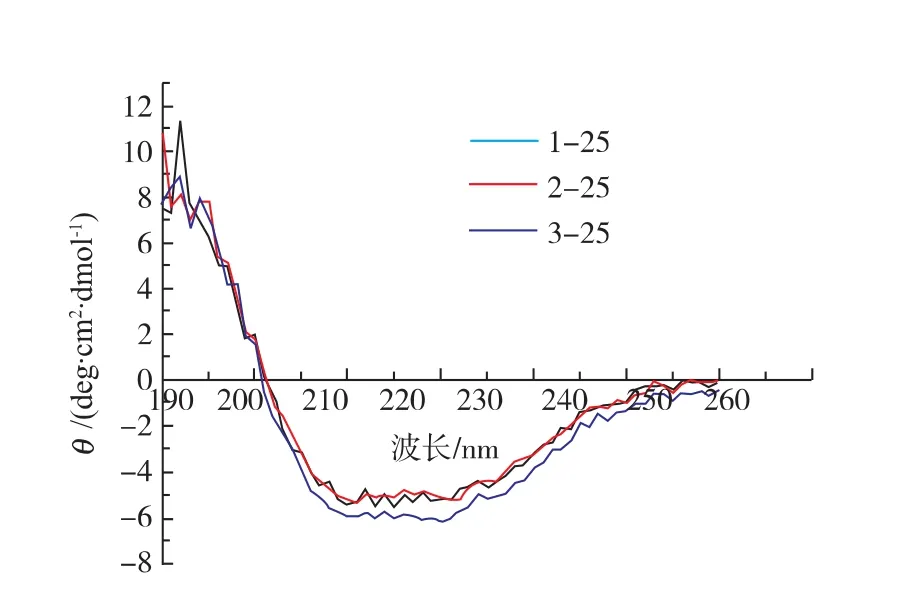
图7 25℃下不同处理方式过氧化氢酶的圆二色谱Fig.7 CD spectra of catalase treated under 25℃at different conditions
从表1的数据可以看出,经过磁场处理,过氧化氢酶的α-螺旋、β-折叠、β-转角、无规卷曲的含量都有不同程度的变化。磁场条件25℃、200 mT处理的酶液与对照相比,α-螺旋含量急剧减少,β-折叠含量略有增加,β-转角含量增加,无规卷曲含量减少。磁场条件25℃、500 mT处理的酶液与对照相比,α-螺旋含量急剧减少,β-折叠略有增加,β-转角含量减少,无规卷曲含量增加。

表1 25℃不同处理条件下过氧化氢酶的二级结构组成Table 1 Composition of catalase secondary structure on 25℃under different treatment conditions
在蛋白质二级结构中,α-螺旋和β-折叠均为有序结构,α-螺旋和β-折叠结构的增加将会增加酶的活性,反之减小则会减小酶的活性,因此又选择了将α-螺旋和β-折叠总量作为一个参数来衡量酶二级结构变化。从表1中数据可以发现,经过磁场处理后α-螺旋和β-折叠的总量小于对照组,且磁场强度越大,含量越少,这与之前的酶活结果一致。
同样,如图8所示,55℃对照的CD光谱图中也存在两个负峰,分别在210、222 nm附近,表明二级构象中同时含有α-螺旋和β-折叠两种结构。55℃磁场处理的过氧化氢酶CD光谱图中210、224 nm的负峰值明显上升,且图谱形状发生较大变化。

图8 55℃下不同处理方式过氧化氢酶的圆二色谱Fig.8 CD spectra of catalase treated under 25℃at different conditions
见表 2,55℃、200 mT条件下与对照相比,α-螺旋含量增加,β-折叠含量减少,β-转角含量减少,无规卷曲含量也减少。由表2数据可知,55℃磁场处理后α-螺旋和β-折叠的总量大于对照组,且酶的二级结构整体上有向α-螺旋转化的趋势,因而提高了酶的活性。

表2 55℃不同处理条件下过氧化氢酶的二级结构组成Table 2 Composition of catalase secondary structure on 55℃under different treatment conditions
综合以上结果说明,在55℃、200 mT的磁场条件下,过氧化氢酶的二级结构发生了较大变化,这也与之前酶活变化的结果吻合。故而推测过氧化氢酶在此极端条件下形成了具有相对耐高温的结构。
同时可以看到,经过磁场暴露处理后,无论是25℃还是55℃,过氧化氢酶的二级结构各组分含量差别不大,但是跟对照样品相比,各组分含量都有一定的变化,尤其是55℃条件下。这说明可能55℃、200 mT磁场会促使过氧化氢酶形成某种稳定结构来抵抗外界条件的变化。
另外,由于过氧化氢酶的活性中心铁卟啉环存在高自旋的Fe3+,25℃、200 mT,25℃、500 mT和55℃、200 mT 3种磁场对其的扰动会影响酶的活性。由于蛋白质分子的主链较为稳固,而侧链具有较大的柔性,有自由运动的能力。由此推测可能在25℃、200mT,25℃、500 mT和55℃、200 mT 3种磁场的作用下侧链发生了一定程度的扭转,形成了新的分布取向,从而改变了二级结构各组分的数量。温度升高,酶的构象逐渐从钝化态转为活化态,其侧链的运动自由度也增加[6]。温度越高,磁场对侧链分布的影响就越大,这也可能是55℃磁场处理后过氧化氢酶二级结构与对照样品相差较大的原因。同时,猜测高自旋的Fe3+很可能是一个主要的推动力。由此推测磁场处理后过氧化氢酶的三级结构可能也有较大变化,而文献也有类似报道[3],具体的情况还有待进一步研究。
3 结语
1) 过氧化氢酶在 25~55 ℃、200~500 mT、50~400 Hz磁场处理下酶活随着时间延长而出现不同程度的降低,并且伴有波动。
2)不同磁场处理条件对过氧化氢酶的相对酶活影响程度不同,其中频率、pH对相对酶活的影响较为平缓且有规律性,温度和磁场强度对相对酶活的影响比较复杂,并且在55℃、200 mT条件下,形成了具有相对耐高温的结构。过氧化氢酶的二级结构CD图谱显示,55℃磁场处理后过氧化氢酶的α-螺旋和β-折叠的总量大于对照组,这与相对酶活变化的结果吻合。
[1]Schrader M,Fahimi H D.Peroxisomes and oxidative stress[J].Biochimica et Biophysica Acta (BBA):Molecular Cell Research,2006,1763(12):1755-1766.
[2]Zamocky M,Furtmuller P G,Obinger C.Evolution of catalases from bacteria to humans[J].Antioxidants and Redox Signaling,2008,10(9):1527-1548.
[3]金江涛.脉冲磁场对草莓汁的杀菌钝酶效果的影响[D].广州:华南理工大学,2010.
[4]Haberditzl W.Enzyme activity in high magnetic fields[J].Nature,1967(213):72-73.
[5]Vainer L M,Podoplelov A V,Leshina T V,et al.Effect of a magnetic field on the rate of H2O2breakdown by catalase and by an Fe3+-EDTA complex[J].Biophysics:Biofizika,1978(23):234-242.
[6]张军,孙凡,陈德万,等.强稳恒磁场对离体牛肝过氧化氢酶构象及活力的影响[J].中国医学物理学杂志,2001,18:35-36,53.ZHANG Jun,SUN Fan,CHEN Dewan,et al.Studies of biological effects of high indensities static magnetic fields on the conformation and activity of vitro catalase in bovine liver[J].Chinese Journal of Medical Physics,2001,18:35-36,53. (in Chinese)
[7]Otto M,von Muhlendahl K E.Electromagnetic fields(EMF):Do they play a role in children’s environmental health(CEH)[J].Int J Hyg Environ Health,2007,210(5):635-644.
[8]WHO (World Health Organization) Extremely low frequency fields.Environmental Health Criteria Monograph No.238[M].Geneva:World Health Organization,2007.
[9]施特尔马赫.酶的测定方法[M].钱嘉渊 译.北京:中国轻工业出版社,1992.
[10]刘勇,贾绍义,吴松海.不同磁场对过氧化氢酶活性及酶促反应的影响[J].天津大学学报,2009,42(10):897-900.LIU Yong,JIA Shaoyi,WU Songhai.Effects of different magnetic fields on activity of catalase and enzymatic reaction[J].Journal of Tianjin University,2009,42(10):897-900.(in Chinese)
[11]李梅,曲久辉,彭永臻.脉冲磁场水处理技术在杀菌、灭藻方面的研究[J].环境科学学报,2004,24(2):260-264.LI Mei,QU Jiuhui,PENG Yongzhen.Sterilization and algae killing by the application of pulsed magnetic field[J].Acta Scientiae Circumstantiae,2004,24(2):260-264.(in Chinese)
[12]高梦祥,胡翠翠,严奉伟,等.磁场和抑制剂对莲藕多酚氧化酶反应动力学的影响[J].农业机械学报,2008,39(1):78-81.GAO Mengxiang,HU Cuicui,YAN Fengwei,et al.Effect on reaction dynamics of lotus root polyphenol-oxidase by inhibitors and magnetic field[J].Tansactions of the Chinese Society for Agricultural Machinery,2008,39(1):78-81.(in Chinese)
[13]张军,孙凡,陈德万,等.0.23 T稳恒磁场对不同温度离体牛肝过氧化氢酶的磁效应研究[J].激光生物学报,2001,10(3):191-194.ZHANG Jun,SUN Fan,CHEN Dewan,et al.Effect of 0.23 T steady magnetic field on catalase in different temperature[J].Acta Laser Biology Sinica,2001,10(3):191-194.(in Chinese)
[14]上官丽娟,马永昆,崔凤杰,等.高压处理对辣根过氧化物酶活性及构象的影响[J].高压物理学报,2011,25(5):475-480.SHANGGUAN Lijuan,MA Yongkun,CUI Fengjie,et al.Effects of high pressure processing on the activity and the conformation of horseradish peroxidase[J].Chinese Journal of High Pressure Physics,2011,25(5):475-479.(in Chinese)

