卵白蛋白水解产物的抗菌性及抗氧化性
唐文婷 , 张 晖 , 王 立 , 钱海峰
(1.江南大学 食品学院,江苏 无锡 214122;2.青岛农业大学 食品科学与工程学院,山东 青岛 266109)
卵白蛋白(ovalbumin)是卵清中的一种磷酸糖蛋白质,其质量分数占卵清蛋白的54%左右[1]。其由386个氨基酸残基组成,相对分子质量约为45 000,等电点为4.5[2]。卵白蛋白具有典型的蛋白质胶凝、乳化和起泡等功能特性,在食品加工中赋予食品各种风味、质地和口感等感官特性。长期以来,卵白蛋白的研究主要集中于其结构、功能特性和致敏性等相关领域。除膳食营养作用和作为胚胎发育中氨基酸来源之一以外,卵白蛋白的生理活性尚未受到广泛关注。
因全球范围内细菌耐药性的增强和合成食品防腐剂的潜在危害,抗菌肽作为一种新型抗菌剂受到国内外研究者的广泛关注。抗菌肽(Antibacterial peptides,AMPs), 又 称 肽 类 抗 生 素 (peptide antibiotics),是一类具有广谱抗菌活性的小分子短肽,是生物天然免疫防御系统的重要组成部分。抗菌肽具有不同于传统抗生素的杀菌机制,不易产生病原菌耐药性和交叉抗性,具有多重生物活性。此外,抗菌肽有较好的酸碱稳定性、热稳定性和低温贮藏稳定性,在实际应用中具有独特的使用特性,可用于医药、食品、饲料加工业等领域,具有极大的开发应用前景[3]。目前,抗菌肽的制备方法主要包括直接提取、化学合成、基因工程和酶水解。酶水解法具有安全性高、产量大、条件温和、成本较低、操作简便等优点,故有望实现工业化规模性生产。
众多食物蛋白质经过酶解后,可以释放出一系列易吸收并具有抗菌、抗氧化、降血压、抗凝血、抗肿瘤、促进矿物质吸收、促进DNA合成等多种生理活性的多肽[4]。为深入了解卵白蛋白酶解产物的生理活性及开发新型生物活性肽,本实验中采用胃蛋白酶、胰蛋白酶复合水解卵白蛋白,并对其抗菌活性组分进行分离纯化,评价其抗菌活性、细菌细胞膜损伤性特性及抗氧化活性,旨在提高卵白蛋白的综合利用水平和效益。
1 材料与方法
1.1 材料与试剂
卵白蛋白,实验室自制(纯度92.6%)。
胃蛋白酶(≥400 U/mg),Sigma公司产品;胰蛋白酶(≥50 000 U/g)、营养琼脂(BR)、鱼粉蛋白胨(BR)、牛肉浸膏(BR)、氯化钠(分析纯)、葡萄糖(分析纯),国药集团产品;GENMED半乳糖苷酶释放法细菌膜损伤荧光检测试剂盒,上海杰美基因公司产品;碘化丙锭,Aladdin公司产品。
大肠杆菌Escherichia coli ATCC 25922、金黄色葡萄球菌Staphylococcus aureus ATCC 25923,由江南大学食品学院提供。
1.2 仪器与设备
YXQ-LS-SH全自动立式电热压力蒸汽灭菌锅,上海博讯实业有限公司医疗设备厂制造;SWCJ-1FD超净工作台,苏净集团苏州安泰空气技术有限公司制造;SPX-150 C型恒温恒湿培养箱,上海博讯实业有限公司医疗设备厂制造;Free Zone 2.5型冷冻干燥机,美国Labconco公司制造;FORMA 702型超低温冰箱,美国Thermo Scientific公司制造;A¨KTA蛋白质纯化系统,瑞典Amersham Bioscience Co制造;HPLC色谱系统,Agilent Technologies公司制造;M5酶标仪,美国Molecular Devices公司制造;FACSCalibur流式细胞仪,美国Becton Dickinson公司制造。
1.3 试验方法
1.3.1 卵白蛋白水解液的制备 配制质量分数5%卵白蛋白悬浊液,用1 mol/L HCl调pH至2.0,搅拌加入1%质量分数胃蛋白酶,37℃反应5 h,反应过程中以1 mol/L HCl维持pH值恒定。采用1 mol/L NaOH调pH至8.0终止胃蛋白酶水解反应。搅拌加入2%质量分数胰蛋白酶,37℃反应8 h,反应过程中以1 mol/L NaOH维持pH值恒定。反应结束后,反应物沸水浴加热10 min钝化蛋白酶,调pH至7.0。 反应物离心 15 min(4 500 g,4 ℃),上清液冻干备用。
1.3.2 卵白蛋白水解物抑菌性质的测定
1)抑菌能力测定:指示菌大肠杆菌、金黄葡萄球菌37℃培养至对数期,制成105CFU/mL菌悬液,均匀涂布至营养琼脂培养基上。直径6 mm的灭菌滤纸片分别浸泡于2 mg/mL卵白蛋白水解液和生理盐水对照溶液中,取出置于含菌平板上,37℃培养箱倒置培养18 h,每种指示菌重复操作3个平板。培养结束后测定滤纸片的抑菌圈直径大小(mm)。
2)抑菌率的测定:灭菌96孔板中依次加入100 μL 液体培养基、100 μL 活化菌悬液和 50 μL蛋白水解产物(50 μg/mL),37 ℃培养 18 h。 生理盐水代替蛋白水解液作为对照。混匀后置于37℃恒温培养箱中培养18 h,酶标仪测定OD600值[5]。抑菌率按式(1)计算。
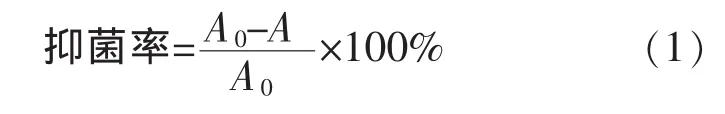
式(1)中,A0为对照的 OD600, A 为样品的 OD600。
1.3.3 卵白蛋白水解液相对分子质量分布的测定卵白蛋白水解物配成溶液,经0.22 μm滤膜过滤后采用 HPLC(TSKgel 2000 SWXL 柱:300 mm×7.8 mm)测定卵白蛋白水解液相对分子质量分布。色谱条件为:柱温30℃,流动相为乙腈/水/三氟乙酸(体积比45∶55∶0.1),体积流量 0.5 mL/min,紫外检测波长为220 nm。
1.3.4 卵白蛋白水解物的分离纯化 首先采用A¨KTA蛋白质纯化系统 (GE Healthcare SuperdexTMSuperdex peptide 10/300 GL型凝胶柱)对卵白蛋白水解物进行粗分。分别采用2个柱体积的20%乙醇、超纯水、0.02 mol/L磷酸盐缓冲液(pH 7.0)溶液对凝胶柱进行洗脱平衡。蛋白水解物配成10 mg/mL溶液, 经 0.22 μm滤膜过滤后上样 (0.5 mL)。0.05 mol/L HCl以0.5 mL/min体积流量洗脱2个柱体积。检测波长220 nm,自动收集器收集吸各峰组分,100 Da透析袋透析并冷冻干燥。冻干粉复溶检测抗菌率。由凝胶柱分离得到抗菌组分,配成2 mg/mL的溶液,经0.22 μm滤膜过滤后采用RP-HPLC(Kromasil C18柱:250 mm×10 mm)分离。 色谱条件为:柱温25℃,流动相(A:0.1%(体积分数)三氟乙酸溶液;B:含0.1%三氟乙酸的体积分数80%乙腈溶液)体积流量 0.5 mL/min,梯度洗脱(30 min内0%~100%B)。紫外检测波长为215 nm。手动收集各吸收峰,冻干、复溶并检测其抗菌率。
1.3.5 半乳糖苷酶释放法测定卵白蛋白水解物对细菌细胞内膜渗透性的影响 采用半乳糖苷酶释放法测定卵白蛋白水解物对大肠杆菌细胞膜渗透性的影响。实验采用GENMED半乳糖苷酶释放法细菌膜损伤荧光检测试剂盒,按说明书操作。以无菌生理盐水为对照。实验重复3次,数据取其平均值。
1.3.6 流式细胞仪测定卵白蛋白水解物对细菌细胞膜完整性的影响 取培养至对数生长后期的待测大肠杆菌菌液,加入100 μg/mL的卵白蛋白水解物,对照组加生理盐水,37℃培养4 h。离心洗涤样品,菌体用生理盐水悬浮,调整菌浓度为106CFU/mL。加入碘化丙啶(PI)染液至终质量浓度为50 μg/mL,37℃避光孵育30 min后离心,双蒸水洗去多余的PI并用1 mL双蒸水重悬,流式细胞仪检测PI着染阳性细菌数[6]。
1.3.7 卵白蛋白水解物的DPPH·自由基清除能力分别配制卵白蛋白水解物溶液为0.1~2.0 mg/mL。向96孔板中分别加入 50 μL蛋白水解物溶液和150 μL DPPH·甲醇溶液(0.1 mmol/L),轻微振荡混匀,室温避光反应30 min。517 nm下测定样品吸光值。以甲醇代替卵白蛋白水解物为空白对照。质量分数0.5%原始卵白蛋白悬浊液3 000 g离心5 min,还原型谷胱甘肽作为参考对照,其余操作同上[7]。每个样品重复测定3次,DPPH·自由基清除率以式(2)计算:
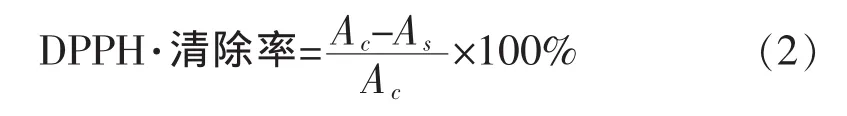
式(2)中,Ac为空白对照的 OD517, As为样品的 OD517。
2 结果与分析
2.1 卵白蛋白水解物的抗菌作用
由图1可见,卵白蛋白经水解后对大肠杆菌和金黄色葡萄球菌都具有抗菌活性,而原始卵白蛋白对两种指示菌均无抗菌活性。说明无抗菌活性的母体蛋白卵白蛋白经胃蛋白酶、胰蛋白酶复合水解后可释放出抗菌片段。且相同浓度的卵白蛋白水解物对大肠杆菌的抑菌圈直径大于对金黄色葡萄球菌的,表明其对大肠杆菌的抑菌活性大于对金黄色葡萄球菌的抑菌活性。

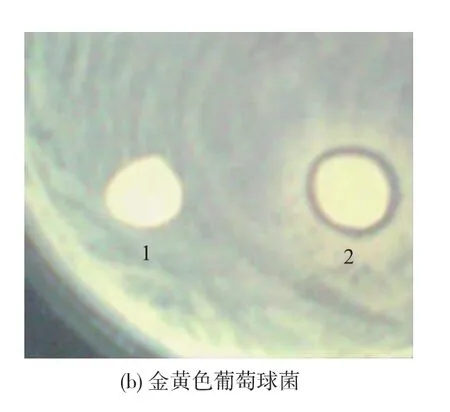
图1 卵白蛋白(1)及其水解液(2)对大肠杆菌和金黄色葡萄球菌的抑菌能力Fig.1 Antibacterial activities of ovalbumin hydrolysate against Escherichia coli and Staphylococcus aureus
2.2 卵白蛋白水解物相对分子质量分布
为在后续试验中选择合适的分离系统和分离柱,对卵白蛋白水解产物的相对分子质量分布进行了考察。由图2和表1可见,其相对分子质量大多分布在6 000以下,相对分子质量在1 000以下的组分占到了50%以上。
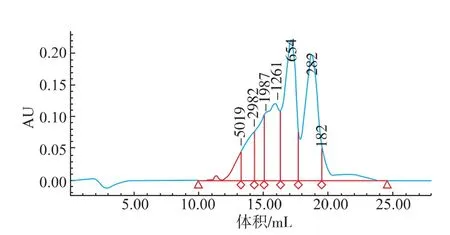
图2 卵白蛋白水解产物的相对分子质量分布图Fig.2 Relative molecular weigh distribution of ovalbumin hydrolysate
说明该水解物中含有大量的2~50个氨基酸残基组成的肽类。这与其他研究者认为抗菌肽是由50个以下氨基酸组成的小分子肽类物质的观点相一致[8]。
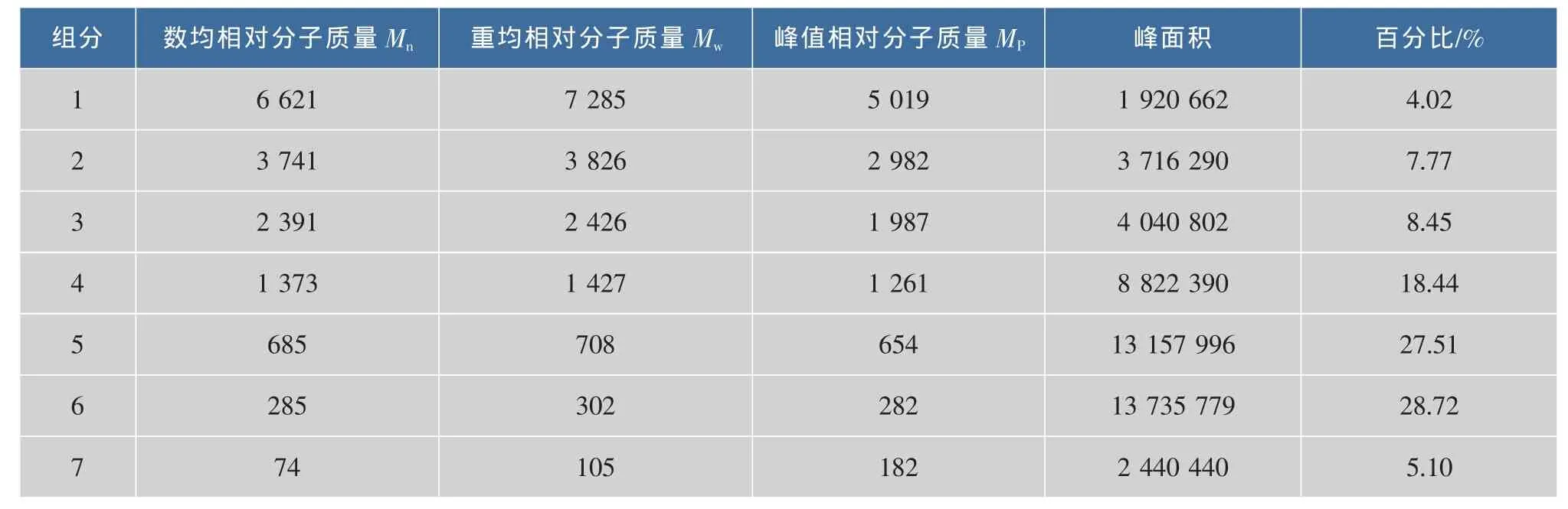
表1 卵白蛋白水解产物的相对分子质量分布计算Table 1 Relative molecular weigh distribution of ovalbumin hydrolysate
以上结果表明,蛋白水解物的抗菌活性与相对分子质量分布有关。
2.3 卵白蛋白水解物的分离纯化
因抗菌肽的相对分子质量多为6 000以下,故采用分离范围为相对分子质量100~7 000的10/300 GL型凝胶柱对卵白蛋白水解物进行分离。卵白蛋白水解物的洗脱图谱如图3所示,收集各洗脱峰冻干复溶并测定抗菌活性,仅发现峰2(F2组分,图中箭头所示)具有抗菌活性。将F2经RP-HPLC再次分离,收集各洗脱部分并测定抑菌率(图4)。抑菌率试验结果表明,50 μg/mL的F21和F22组分对大肠杆菌分别具有84.6%和22.5%的抑菌率,对金黄色葡萄球菌分别具有53.3%和29.6%的抑菌率。
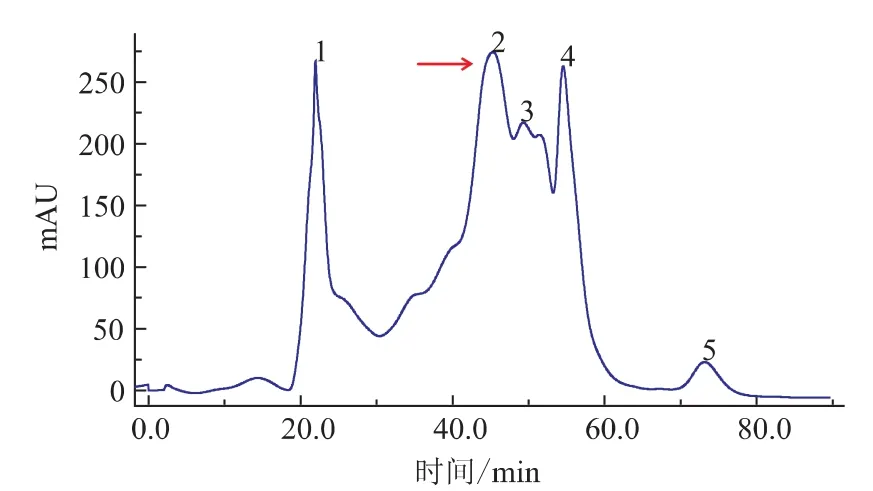
图3 KTA蛋白纯化系统分离卵白蛋白水解物洗脱图谱Fig.3 Elution profile of ovalbumin hydrolysate separated with KTA protein liquid chromatography
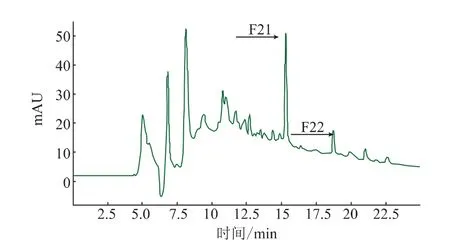
图4 RP-HPLC分离卵白蛋白水解物F2洗脱图谱Fig.4 Elution profile of F2 separated with RP-HPLC
2.4 卵白蛋白水解物对大肠杆菌细胞膜渗透性的影响
β-半乳糖苷酶(β-galactosidase)为一种细菌内源性酶,仅当细菌细胞膜受到损害时才从胞内释放出细菌外[9]。试验中采用甲基伞形酮酰β-D-半乳糖苷酸 (4-Methylumbelliferyl-β-D-galactoside) 作为β-半乳糖苷酶的底物。水解产生的甲基伞形酮具有蓝色荧光,吸收峰是 365 nm,而散射峰是 460 nm,因此可以作为一种荧光检测信号来评价细菌细胞膜损伤程度。从图5可以看出,卵白蛋白水解物F21和F22作用于大肠杆菌后,溶液的荧光强度增加,说明F21和F22引起大肠杆菌膜透性增加,导致β-半乳糖苷酶的释放量增大。荧光强度的变化5 h后趋于平缓,且相同时间内F21对膜透性的影响大于F22。细胞膜是具有高度选择性的渗透性膜,胞膜透性增加,导致细胞内物质溢出胞外,最终引起细菌死亡。
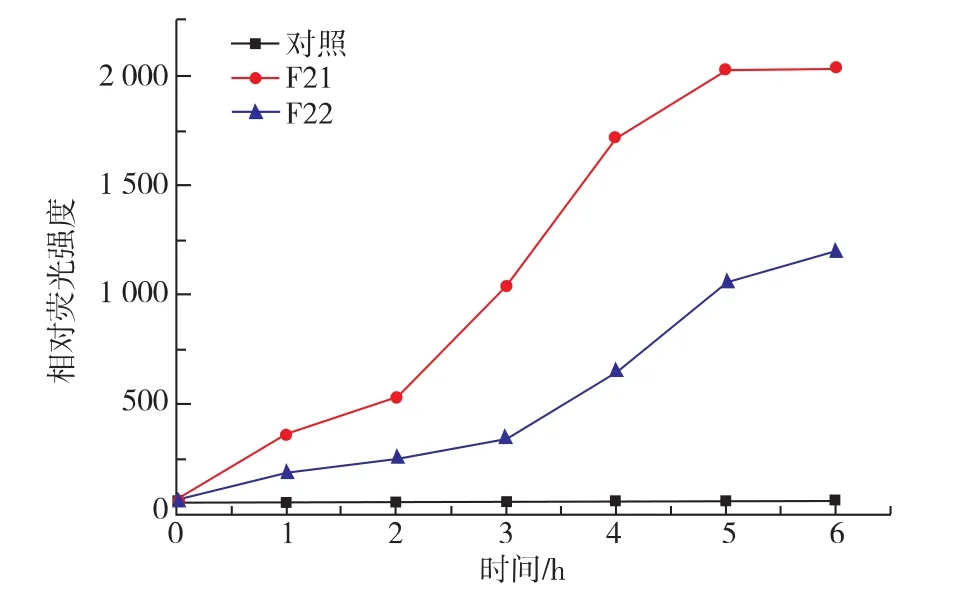
图5 卵白蛋白水解物组分F21和F22对大肠杆菌细胞膜渗透性的影响Fig.5 Effect of ovalbumin hydrolysate fraction F21 and F22 on membrane permeabilization of E.coli
以上结果表明,卵白蛋白水解物F21和F22使大肠杆菌细胞膜透性发生改变,引起胞内物质外流,从而发挥抑菌作用。
2.5 卵白蛋白水解物对细菌细胞膜完整性的影响
碘化丙锭(propidine iodide,PI)是阳离子核酸荧光染料,不能进入活细胞的完整细胞膜,但却能穿过破损的细胞膜而对细胞核染色。当细菌细胞膜受损,荧光强度会随进入细胞内的PI增多而增强,因此细菌发出荧光信号的强弱反映了其细胞膜受损伤的程度[10]。由图6可见,与对照组相比,卵白蛋白水解物处理后大肠杆菌的PI阳性染色细胞数均增多。卵白蛋白水解物处理前的大肠杆菌PI染色率为 0.15%,见图 6(a);F21处理 4 h后,大肠杆菌染色细胞数增加到 72.54%,见图 6(b);F22处理4 h后,PI染色细胞数为7.42%,见图6(c)。
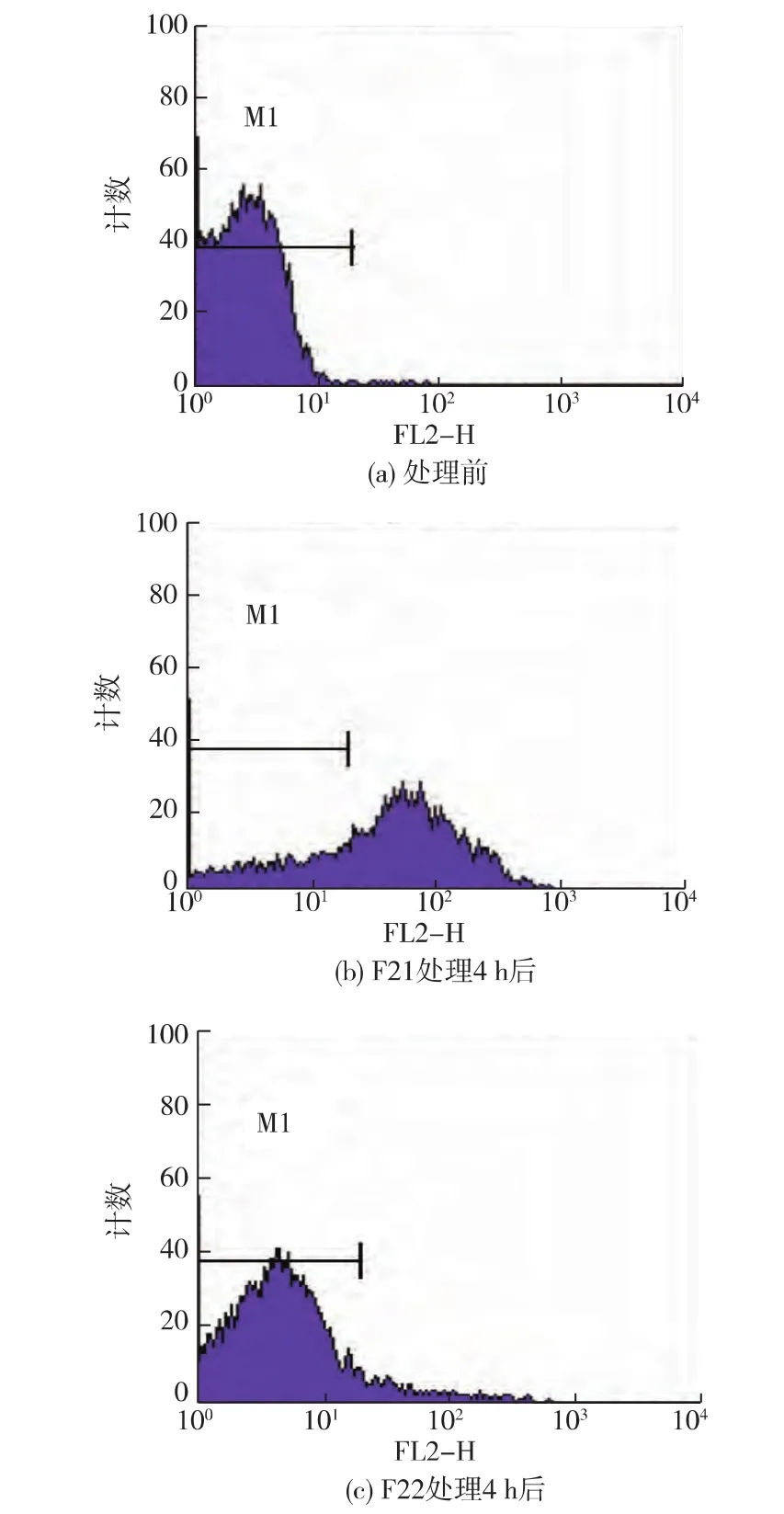
图6 PI流入F21和F22处理后的大肠杆菌流式分析结果Fig.6 Flow cytometric analysis of Escherichia coli ATCC 25922 cells labeled with PI (a) and cells treated with ovalbumin hydrolysatesfraction F21 and F22F21(b) and F22 (c)
相同处理时间下,F21处理后的大肠杆菌的PI阳性染色细胞数大于F22处理后的菌体的,这与2.3中得到的两者抑菌率结果一致。由此可知卵白蛋白水解物可以破坏细菌细胞膜的完整性。
2.6 卵白蛋白水解物的DPPH·自由基清除能力
众多蛋白水解片段具有多重生物活性,如抗菌、抗氧化、降血压、降胆固醇、抗癌等。为验证已分离出的具有抗菌作用的卵白蛋白水解片段F21和F22是否具有其他活性,实验中也考察了F21和F22的DPPH·清除能力。DPPH·自由基含单电子,在517 nm波长处有强烈吸收。当存在自由基清除物时,其在该波长下的吸光值会减小[11]。试验以GSH为对照,考察了F21和F22对 DPPH·清除能力的影响。图7表明,在0.1~2.0 mg/mL质量浓度范围内,卵白蛋白水解物对DPPH·清除能力均随质量浓度的增大而增大。质量浓度低于2.0 mg/mL时,相同质量浓度的F22的DPPH·清除能力高于F21的。当质量浓度增加至2.0 mg/mL时,两者DPPH·清除率相当,接近于1.0 mg/mL GSH的 DPPH·清除效果,表现出较强的DPPH·清除能力。
试验中也考察了质量分数0.5%原始卵白蛋白悬浊液上清液的DPPH·清除能力,仅为17.0%。因此,卵白蛋白经酶解后使其抗氧化活性大大提高,其酶解片段同时具有抗菌活性和抗氧化活性。
3 结语
为探明蛋白酶解产物的生理活性,作者采用胃蛋白酶、胰蛋白酶复合水解卵白蛋白,通过A¨KTA蛋白质纯化系统、透析及RP-HPLC得到2个具有抗菌活性的水解产物组分F21和F22,测定了其对大肠杆菌和金黄色葡萄球菌的抑菌率,相同质量浓度的F21对大肠杆菌的抑菌率高于F22的,而对金黄色葡萄球菌的抑菌率低于F22的。半乳糖苷酶释放法和流式细胞仪分析结果表明,2种产物均能破坏大肠杆菌细胞膜渗透性和细胞膜完整性,说明细菌细胞膜可能是其发挥抗菌性能的作用位点之一。此外,2种产物组分均能清除DPPH·自由基。因此,卵白蛋白水解产物在食品、医药等方面具有广阔的应用前景。
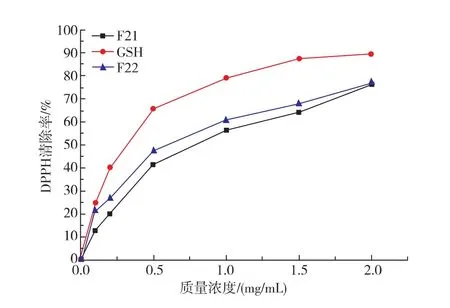
图7 卵白蛋白水解物组分F21和F22的DPPH·自由基清除能力Fig.7 DPPH free radicalscavenging abilities of ovalbumin hydrolysate fraction F21 and F22
[1]麻小娟.糖基化对卵白蛋白的构象及其抗原性和过敏原性的影响[D].南昌:南昌大学,2011.
[2]Huntington J A,Stein P E.Strueture and properties of ovalbumin[J].Journal of Chromatography B,2001,756(l-2):189-198.
[3]William C W,Kalina H.Antimicrobial peptides:successes,challenges and unanswered questions[J].The Journal of Membrane Biology,2011,239(1-2):27-34.
[4]王俊杰,赵燕,涂勇刚,等.蛋源性抗菌肽的研究进展[J].食品科学,2013,34(9):399-403.WANG Junjie,ZHAO Yan,TU Yonggang,et al.Research progress on antimicrobial peptides derived from egg protein[J].Food Science,2013,34(9):399-403.(in Chinese)
[5]Xiao J H,Zhang H,Niu L,et al.Efficient screening of a novel antimicrobial peptide from Jatropha curcas by cell membrane affinity chromatography[J].Journal of Agricultural and Food Chemistry,2011,59(4):1145-1151.
[6]LI Lirong,SHI Yonghui,SU Guanfang,et al.Selectivity for and destruction of Salmonella typhimurium via a membrane damage mechanism of a cell-penetrating peptide ppTG20 analogue[J].International Journal of Antimicrobial Agents,2012,40(4):337-343.
[7]Amarowicz R,Pegg R B,Rahimi-Moghaddam B P,et al.Free-radical scavenging capacity and antioxidant activity of selected plant species from the Canadian prairies[J].Food Chemistry,2004,84(4):551-562.
[8]Keymanesh K,Soltani S,Sardari S.Application of antimicrobial peptides in agriculture and food industry[J].World Journal of Microbiology and Biotechnology,2009,25(6):933-944.
[9]Jacobson R H,Zhang X J,Dubose R F,et al.Three-dimensional structure of β-galactosidase from E.Coli[J].Nature,1994,369:761-766.
[10]Alvarez-Barrientos A,Arroyo J,Canton R,et al.Applications of flow cytometry to clinical microbiology[J].Clinical Microbiology Reviews,2000,13:167-195.
[11]Huang D,Ou B,Prior R L.The chemistry behind antioxidant capacity assays[J].Journal of Agricultural and Food Chemistry,2005,53(6):1841-1856.

