酿酒酵母蛋白质双向电泳条件优化及图谱建立
赵绍辉, 周景文, 堵国成, 陈 坚
(江南大学 生物工程学院,江苏 无锡 214122)
酿酒酵母是与人类关系最密切的一种酵母,传统上它用于酿酒和制作发酵食品,在现代分子生物学中它作为真核模式菌株。在食品安全方面,酿酒酵母发酵过程中由于氮源利用的不同,会产生一些危害人体健康的胺类化合物,氨基甲酸乙酯是其中受关注较多的一种[1-2]。目前对胺类物质产生机理研究得还不透彻,并且大部分研究集中在基因组以及转录组方面。对于生物体来说,基因的功能主要通过它编码的蛋白质来实现,因此蛋白质是生命活动的真正执行者。生物体的基因组相对来说是固定的,但它的蛋白质组是动态的,同一基因组在不同细胞、不同组织中的蛋白质表达情况各不相同。即使是同一细胞,在不同的生长阶段、不同的生理条件,以及不同的环境影响下,其蛋白质组的存在状态也都不尽相同,因此蛋白质组是空间和时间上变化的整体。通过直接对细胞表达的全局蛋白质进行研究,可以更准确地搞清基因调控的机理和生命活动的本质过程[3]。
随着检测技术与信息技术的迅速发展,基因组研究已经取得了很多重大的进展和成就。然而蛋白质组由于其自身的复杂性和不稳定性,至今尚未得到像基因组研究一般通用、简便、高效的技术支持[4]。双向电泳与质谱结合的研究方法,是现在蛋白质组学最为常规的实验技术。由于双向电泳实验操作性强、步骤繁琐、周期长,实验过程各个环节都可能影响双向电泳对蛋白质分离的效果,直接关系到蛋白质图谱分析的准确性和可靠性,因此对于不同来源的样品,即便是同一物种也都需要摸索优化出专用的实验室可重复的实验条件[5-6]。本研究的目标就是通过对影响双向电泳结果的各种关键条件进行优化,建立一套高分辨率、高灵敏度、高重复度和高稳定性的双向电泳技术体系。为深入研究不同氮源条件下酿酒酵母的差异蛋白质组学提供可靠依据,进而为研究氮代谢本质调控过程奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 菌株与培养条件
1)菌株:Saccharomyces cerevisiae N85,由浙江古越龙山绍兴酒股份有限公司提供。
2)培养条件:从甘油管中取400 μL菌体接入到20 mL的YPD培养基,30℃,200 r/min,培养至20 h取样。
1.1.2 试剂 固化IPG线性干胶条、两性电解质Bio-Lyte,购自美国Bio-Rad公司;丙烯酰胺、甲叉丙烯酰胺、尿素、硫脲、3-(3-胆胺丙基)二甲氨基-1-丙磺酸(CHAPS)、二硫苏糖醇(DTT)、碘乙酰胺(IAA)、甘氨酸、三羟甲基氨基甲烷(Tris)、四甲基乙二胺(TEMED)、过硫酸铵、溴酚蓝、低熔点琼脂糖、十二烷基磺酸钠(SDS)、考马斯亮蓝G-250、蛋白酶抑制剂、蛋白测定试剂盒,购自上海生工集团;甲醇、正丁醇、冰醋酸、甘油、三氯乙酸(TCA)、磷酸、乙酸钠,均为国产分析纯产品。
1.1.3 主要仪器 Ettan IPG-phor 3型等电聚焦电泳仪,Ettan DALTsix垂直电泳系统,Image Master LabScan凝胶电泳图像分析系统,GE公司产品;CR22G型高速冷冻离心机,日本日立公司产品;UV-2100型紫外可见分光光度计,尼龙柯仪器有限公司产品;PD-Quest 8.0.1分析软件,美国Bio-Rad公司研发。
1.2 方法
1.2.1 蛋白质提取 取100 mL酵母培养液离心(7 000 r/min,15 min),弃去上清。 用 100 mL 超纯水悬浮洗涤菌体,离心(7 000 r/min,15 min),重复 3次得菌体沉淀。用2 mL细胞裂解液(7 mol/L尿素、2 mol/L硫脲、质量分数4%CHAPS)悬浮酵母细胞,加入20 μL蛋白酶抑制剂。冰浴中超声破碎(3 s/2 s)30 min,期间尽量低温,完毕后离心(14 000 r/min,30 min)。
1)丙酮沉淀法:将上清液转移到50 mL的离心管中,加入10倍体积丙酮溶液沉淀蛋白质,-20℃放置过夜。离心(14 000 r/min,30 min)获得蛋白质沉淀。
2)TCA-丙酮沉淀:将上清液转移到50 mL离心管中,加入10倍体积TCA-丙酮溶液沉淀蛋白质,-20 ℃放置过夜,离心(14 000 r/min,30 min)。用丙酮溶液悬浮洗涤沉淀,放置1 h,离心(14 000 r/min,30 min),重复两次,得蛋白质沉淀。
3)使用GE公司的clean-up试剂盒进行蛋白质沉淀。
将蛋白质沉淀溶于1 mL上样水化缓冲液(7 mol/L尿素、2 mol/L硫脲、质量分数4%CHAPS、65 mmol/L DTT、 质量分数 1%pH 3~10的 Bio-Lyte)中,放置 1 h 后离心(12 000 r/min,5 min),取上清,使用上海生工集团的非干扰性蛋白质浓度测定试剂盒,-20℃冷冻待用。
1.2.2 双向电泳 按照GE公司的 《双向电泳操作手册》进行水化上样、等电聚焦、平衡,以及第二向SDS-PAGE电泳。等电聚焦时采用电压逐步优化方案对聚焦条件进行优化,第二向分别采用质量分数12%、14%和15%的丙烯酰胺凝胶进行比较优化。简要步骤如下:按表1要求的上样量,测定出蛋白质浓度,计算出需要的稀释体积。干胶条在含有蛋白质样品的上样水化液中水化过夜。水化过夜后的胶条转移到等电聚焦仪器,设定程序进行等电聚焦,结束后立即进行平衡。采用两步平衡法,IPG胶条先后在平衡液I和平衡液II中平衡。进行第二向电泳,当溴酚蓝条带移至凝胶底部时结束。

表1 双向电泳蛋白质上样量Table 1 Sampling amount of 2-DE
分别采用改良胶体考马斯亮蓝G-250染色法和银染法对蛋白质进行染色[7]。脱色后的双向电泳凝胶用GE公司的凝胶电泳图像分析系统Image Master LabScan对其进行扫描分析。利用伯乐公司PDQuest 8.0.1软件进行图像分析处理。
2 结果与讨论
2.1 不同蛋白质提取及纯化方法对双向电泳图谱的影响
样品的制备方法是影响双向电泳结果的关键因素,制备方法如果选择不当,会造成蛋白质溶解不充分、蛋白质丢失,以及大量杂质(盐离子、核酸等)残留等,严重影响等电聚焦过程,从而影响双向电泳的最终结果。高效合理的样品制备可以有效地溶解蛋白质,并除去蛋白质样品中的大量杂质,有助于消除条纹,使图谱更加清晰,分辨率更高[8-9]。因此对样品提取过程做以下优化。
细胞裂解时胞内的蛋白酶会释放出来,造成大量蛋白质的降解,因此在提取蛋白质时有必要加入合适的蛋白酶抑制剂,但是在蛋白质提取过程中加入蛋白酶抑制剂可能会对蛋白质有所修饰,从而对双向电泳结果产生影响[10-11]。因此,本实验中对比了不添加(图 1(a))或者添加(图 1(b))蛋白酶抑制两种情况下蛋白质图谱的最终结果。图1(a)(b)相差不大,可以看出蛋白质在提取体系中的降解不是很严重,添加蛋白酶抑制剂对蛋白质的修饰也不是很严重,用PD-Quest软件分析后发现添加蛋白酶抑制剂的一组(图 1(b))比未添加的一组(图 1(a))蛋白质点稍多一些(493∶504),因此后续实验均添加蛋白酶抑制剂。
细胞破碎后胞内很多物质会与蛋白质一起被提取出来,这些杂质会使凝胶上产生条纹,影响后续的双向电泳,因此很有必要对提取的蛋白质样品进行纯化,使其适合做双向电泳分析[9]。试验对比了3种纯化蛋白质的方法,分别是:丙酮沉淀法,TCA/丙酮沉淀法,Clean-up 试剂盒法。 从图 1(c)(d)(e)中可以看出,丙酮沉淀法所得的双向电泳图谱在酸性端有明显的横条纹,蛋白质点也不是很多,有文献证明丙酮沉淀后有相当部分的蛋白质不能再复溶[9]。TCA/丙酮沉淀法对条纹有所缓解,但酸性端仍有部分横条纹未被除去。TCA/丙酮沉淀处理后蛋白质点的数量也有所增加,说明蛋白质的复溶效果比丙酮沉淀法要好。用Clean-up试剂盒所得图谱在条纹和蛋白质复溶方面都有很大的改善,所得图谱分辨率最高,蛋白质点最多,效果最好。因此,后续实验大部分会采用Clean-up试剂盒做蛋白质纯化,但由于其价格昂贵,有少部分试验仍会使用TCA/丙酮沉淀法。

图1 利用不同蛋白质提取方法所得双向电泳图谱Fig.1 2-DE map of protein sample extracted by different methods
2.2 不同凝胶参数对双向电泳图谱的影响
预制IPG胶条pH范围的选择对最终实验效果影响很大,大范围的胶条对蛋白质的覆盖率大,相对分辨率较低,小范围的胶条正好相反[12]。根据酿酒酵母的基因数据库,得到其5 867个开放阅读框,由其基因序列推测出蛋白质序列,进而推测出蛋白质的PI值和相对分子质量,利用JVirGel软件构建了酿酒酵母理论全蛋白质二维分布图[13]。从图2理论分布可知,酿酒酵母有94%的蛋白质分布在pH 3~10范围内,酸性蛋白质和碱性蛋白质偏多,中性蛋白质偏少。根据以上结果,本实验先用7 cm pH 3~10的 IPG 胶条做预实验,由图 1(a)(b)可以看出,蛋白质在整块凝胶pH范围上都有分布,并且分辨率尚可,因此后续均采用pH 3~10的IPG胶条。
第二向SDS-PAGE对蛋白质点的分布也有一定影响,它是通过蛋白质相对分子质量不同将蛋白质点分离开来。凝胶质量分数高时,垂直方向蛋白质较为密集,分辨率不高;质量分数低时蛋白质移动速度快,容易跑出凝胶[14]。因此,实验中使用了3种不同质量分数的丙烯酰胺凝胶做对比,结果如图3所示。由图可以看出,质量分数12%的凝胶所得的图谱蛋白质点聚集在凝胶底部,质量分数15%的底部有一部分空白,只有质量分数14%的蛋白质点分布较为均匀,因此以后实验均采用14%的丙烯酰胺凝胶进行SDS-PAGE。
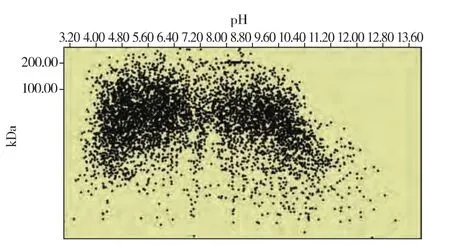
图2 根据预测的蛋白质等电点和相对分子质量构建的酿酒酵母理论全蛋白质二维分布图Fig.2 Representation of 2-DE gel separation of the Saccharomyces cerevisiae proteome according to predicted pI andmolecular weights

图3 不同质量分数的丙烯酰胺凝胶所得双向电泳图谱Fig.3 2-DE maps of Saccharomyces cerevisiae by different concentration of acrylamide gel
2.3 染色方法对蛋白质点检测的影响
不同的凝胶染色方法对双向电泳成像效果以及蛋白质点的检测有很大影响[7],试验对比了常用的考马斯蓝G-250染色法和银染法(图4),已知两种染色方法各有优势,但又各有不足。可以看出,银染法灵敏度高,少量蛋白质即可检测到,但银染步骤复杂,染色时间不容易控制,染色后底色深并且对后续的质谱分析有影响;考马斯蓝G-250染色法操作简单,无毒性,染色后底色不深,对比度较高,并且可以与下游质谱友好兼容。由于大部分实验需要质谱鉴定差异蛋白质点,综合考虑,本实验后续选择考马斯蓝G-250染色法对凝胶进行染色。

图4 不同染色方法所得双向电泳图谱Fig.4 2-DE maps of Saccharomyces cerevisiaeby different staining methods
2.4 重复性实验
由于双向电泳步骤繁杂,试验周期长,影响因素很多,实验结果往往具有不稳定性。为了保证最大程度地从蛋白质二维图像中获得可靠的生物学信息,良好的重复性是不可或缺的[15]。本实验中利用上述建立的方案,相同样品进行3次生物学重复,进行重复性验证。由图5可以看出,3个重复样品的电泳图谱分辨率清晰,蛋白质点的分离效果较好。利用PDQuest软件分析,3张图谱中蛋白质点的匹配率可以达到88.5%以上,证明利用本试验建立的实验方案不仅可以得到较高分辨率的双向电泳图谱,同时具有较好的重复性,所得数据具有统计学意义。

图5 酿酒酵母总蛋白双向电泳图谱的重复性Fig.5 Repeatability of 2-DE maps with the total proteins separated from Saccharomyces cerevisiae
3 结语
在后基因组时代,功能基因组学越来越受到人们的关注,作为生命活动的真正执行者,全局蛋白质研究也逐步走入了生命机制研究的核心领域[3]。作为蛋白质组学的常规技术,双向电泳在全局蛋白质分离方面有着分辨率高、适用范围广、单次分离蛋白质数量多等特有的优点。但又由于双向电泳实验操作性强、步骤繁琐、周期长等因素,使得双向电泳操作过程中会出现各种各样的问题,所以对不同来源的样品需要进行双向电泳方法的建立,并不断进行摸索和优化。影响双向电泳结果的因素包括试剂的纯度、样品的制备方法、样品上样量、等电聚焦程序、染色方法、凝胶参数、实验技术的熟练程度等[16-17]。加之酿酒酵母作为真核生物,其细胞结构较原核生物来说有一定的复杂性,因此它的蛋白质双向电泳图谱的优化工作具有重要的意义。
为了获得高分辨率、高灵敏度、高重复性、高稳定性的双向电泳图谱,试验比较了不同的蛋白质提取、纯化方法,调整优化了适用于实验室条件下酿酒酵母的双向电泳体系。经过各个条件优化,选取了超声破碎法进行细胞破碎,在破碎过程中添加蛋白酶抑制剂,然后用clean-up试剂盒对蛋白质样品进行纯化处理,选择24 cm pH范围3~10的IPG预制胶条,以质量分数为14%的丙烯酰胺凝胶进行双向电泳实验,然后再选取考马斯蓝G-250染色法对凝胶进行染色。最终作者建立起本实验室条件下分辨率较高、重复性较好、无明显横纵条纹的酿酒酵母N85全蛋白质双向电泳图谱(图 1(e)),经 PDQuest软件分析,所得图谱约分离到1 000个蛋白质点,该图谱的构建为后续酿酒酵母的蛋白质组学研究奠定了基础。
[1]张伟平,赵鑫锐,堵国成,等.酿酒酵母氮代谢物阻遏效应及其对发酵食品安全的影响[J].应用与环境生物学报,2012,18(5):862-872.ZHANG Weiping,ZHAO Xinrui,DU Guocheng,et al.Nitrogen catabolite repression in Saccharomyces cerevisiae and its effect on safety of fermented foods[J].Chin J Appl Environ Biol,2012,18(5):862-872.(in Chinese)
[2]Zhao X,Zou H,Fu J,et al.Nitrogen regulation involved in the accumulation of urea in saccharomyces cerevisiae[J].Yeast,2013:462-472.
[3]王英超,党源,李晓艳,等.蛋白质组学及其技术发展[J].生物技术通讯,2010,21(1):139-144.WANG Yingchao,DANG Yuan,LI Xiaoyan,et al.Development of proteomics and its technology[J].Letters in Biotechnology,2010,21(1):139-144.(in Chinese)
[4]Wrighton K H.Technology:Proteomics gets more selective[J].Nature Reviews Molecular Cell Biology,2013,14(3):131-131.
[5]孔令琼,管政兵,陆健,等.绍兴黄酒成品麦曲中微生物胞外酶的双向电泳技术的建立[J].食品与生物技术学报,2011,30(3):453-457.KONG Lingqiong,GUAN Zhengbing,LU Jian,et al.Establishment of a two-dimensional electrophoresis protocol for extracellular enzymes excreted by microorganisms from Shaoxing rice wine wheat Qu[J].Journal of Food Science and Biotechnology,2011,30(3):453-457.(in Chinese)
[6]乌日娜,张和平,孟和,等.干酪乳杆菌蛋白质双向电泳条件优化及图谱建立[J].食品与生物技术学报,2009,28(5):598-602 WU Rina,ZHANG Heping,MENG He,et al.Construction and optimization condition of proteomic map of Lactobacillus casei[J].Journal of Food Science and Biotechnology,2009,28(5):598-602.(in Chinese)
[7]秦慧,刘霆,柳斌,等.几种双向凝胶电泳蛋白质检测方法的比较[J].中国实验血液学杂志,2006,14(1):168-172.QIN Hui,LIU Ting,LIU Bin,et al.Comparison between protein detection methods for Two-Dimensional gel electrophoresis[J].Journal of Experimental Hematology,2006,14(1):168-172.(in Chinese)
[8]WI&SACUTE J R.Universal sample preparation method for proteome analysis[J].Nature Methods,2009,6(5):359-362.
[9]陈波,沈国理.不同样品制备方法对双向电泳图谱的影响[J].武警医学院学报,2007(3):256-258.CHEN Bo,SHEN Guoli.Methods of sample preparation on the effect of map quality of two-dimensional electrophoresis[J].Acta Academiae Medicinae CPAPF,2007(3):256-258.(in Chinese)
[10]宋敏,赖国旗,邱宗荫,等.HeLa细胞蛋白质组双向电泳技术的建立[J].重庆医科大学学报,2007,32(2):117-120.SONG Min,LAI Guoqi,QIU Zongyin et al.Establishment of a Two-Dimensional electrophoresis protocol for HeLa cell[J].Journal of Chongqing Medical University,2007,32(2):117-120.(in Chinese)
[11]张国庆,廖杰,于力方.双向电泳技术在蛋白质组研究中的应用[J].标记免疫分析与临床,2003(3):171-173.ZHANG Guoqing,LIAO Jie,YU Lifang.Applications of Two-Dimensional electrophoresis technology in proteomics research[J].Labeled Immunoassays and Clinical Medicine,2003(3):171-173.(in Chinese)
[12]张丽,姜丽,石韵,等.桃果实总蛋白质双向电泳优化体系的建立[J].食品与生物技术学报,2013,32(3):251-257.ZHANG Li,JIANG Li,SHI Yun,et al.Optimization of Two-Dimensional electrophoresis conditions for proteome analysis of peach fruit[J].Journal of Experimental Hematology,2013,32(3):251-257.(in Chinese)
[13]Hiller K,Schobert M,Hundertmark C,et al.Jvirgel:Calculation of virtual Two-Dimensional protein gels[J].Nucleic Acids Research,2003,31(13):3862-3865.
[14]高艳利,杨思文,樊凯奇,等.SDS-PAGE电泳技术分析蛋白质的研究[J].辽宁化工,2007,36(7):460-463.GAO Yanli,YANG Siwen,FAN Kaiqi,et al.SDS-PAGE electrophoresis analysis of protein research[J].Liaoning Chemical Industry,2007,36(7):460-463.(in Chinese)
[15]孙庆,杨小玉,李红群,等.人骨肉瘤蛋白质组双向电泳图像分析方法的建立[J].中国实验诊断学,2006,10(7):730-732.SUN Qing,YANG Xiaoyu,LI Hongqun,et al.Established of the Two-Dimensional gel electrophoresisin from the proteome analysis of the human osteosarcoma[J].Chinese Journal of Laboratory Diagnosis,2006,10(7):730-732.(in Chinese)
[16]阮松林,童建新,赵杭苹.双向电泳技术研究进展[J].杭州农业科技,2006(5):2-5.RUAN Songlin,TONG Jianxin,ZHAO Hangping.Advances of Two-Dimensional electrophoresis[J].Hangzhou Agricultural Science and Technology,2006(5):2-5.(in Chinese)
[17]杜鹏,冯伟华,郭俊生.蛋白质组双向电泳技术研究进展[J].卫生研究,2005(2):237-240.DU Peng,FENG Weihua,GUO Junsheng.Advances of Two-Dimensional electrophoresis technology[J].Journal of Hygiene Research,2005(2):237-240.(in Chinese)

