微波辅助提取和田玉枣环磷酸腺苷的工艺及与其他方法比较
王立霞
(陕西学前师范学院,陕西 西安 710100)
环磷酸腺苷 (简称 cAMP,Adenosine 3′,5′-cyclic monophosphate)1957年由 Sutherland发现,它普遍存在于哺乳动物体内,控制并调节细胞新陈代谢[1-3]。医学研究证实,至少40多种疾病(癌症、冠心病、心源性休克、高血压和心肌梗死等重大疾病)与cAMP代谢有关,人体缺乏cAMP或cAMP/cGMP值下降,会导致众多疾病的发生。cAMP是枣中重要活性物质[4-5]。据报道,枣成熟果肉中cAMP含量为一般动植物的数千至数万倍,具有重要开发价值[6-7]。目前,已有关于cAMP在保健食品领域应用的报道[8]。我国枣园面积已达150多万公顷,产量200万t,新疆和田地区凭借其独特资源优势,近年枣业发展迅速,面积达30多万公顷[9]。作者已对不同产地、不同含水量、不同组织骏枣、灰枣中cAMP含量进行了研究并得出结果,和田玉枣(山西省交城县骏枣引种于和田后其商品名称为和田玉枣)中cAMP含量相对最高。
微波辐射过程是高频电磁波穿透萃取介质,达到物料内部维管束和腺胞系统,胞内温度迅速上升,细胞膨胀破裂,胞内有效成分自由流出,在较低的温度下提取介质。利用微波可更快、更均衡地加热材料,并且实现更高的产量和有更干净的反应物。关于cAMP的提取方法,作者已对传统溶剂提取法进行了研究,本研究中引入了微波辅助提取法,并对传统溶剂提取法和微波辅助提取法进行对比,以获取微波辅助提取和田玉枣cAMP的最优工艺参数。本研究成果为和田玉枣及其它枣品种cAMP的深入研究及开发利用提供了参考及理论依据。
1 材料与方法
1.1 材料与仪器
新疆和田玉枣,2012年10月采摘后烘干枣,枣去核经40℃干燥,粉碎过60目筛,室温下密封保存;cAMP标品(纯度≥99%),色谱纯,德国Sigma公司生产;甲醇 (纯度99.8%),色谱纯,加拿大Promptar公司生产;其余试剂为国产分析纯。LS-200型大孔吸附树脂,西安蓝深特种树脂有限公司生产。
1525型高效液相色谱仪,Waters公司制造;TDL-5型低速大容量离心机,上海安亭科学仪器有限公司制造;UV2550型紫外可见分光光度计,Shimadzu公司制造;WD780BS微波炉,格兰仕电器有限公司制造。
1.2 实验方法
1.2.1 高效液相色谱检测条件 色谱柱:Brava-BDS C18(250 mm×4.6 mm,5 μm)柱;流动相:甲醇-双蒸水(pH 为 3)(体积比 10∶90);体积流量 0.8 mL/min,紫外全波长扫描(如图1所示)确定检测波长257.0 nm,室温,进样量 20 μL[10-12]。

图1 cAMP标准品扫描图谱Fig.1 Scanning images of standard cAMP
1.2.2 cAMP标品溶液的制备及标准曲线的制作精密称取cAMP标品2.5 mg,置50 mL容量瓶,加流动相至刻度,摇匀,得0.05 mg/L cAMP标品溶液。分别吸标品溶液 1、2、3、4、5、6、7、8 mL 于 10 mL 容量瓶,加流动相至刻度,摇匀,得 5、10、15、20、25、30、35、40 μg/mL 系列标品溶液,分别吸 20 μL 系列标品溶液入色谱仪[13-14],记录色谱图,以浓度为横坐标,以cAMP峰面积为纵坐标线性回归,得线性方程
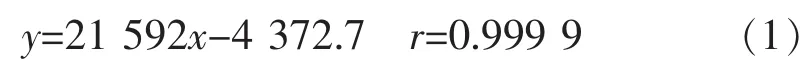
1.2.3 乙醇体积分数对枣cAMP提取量的影响实验准确称取和田玉枣粉2 g(按1.1中所介绍方法制得),以料液比1∶15[9]分别溶解于体积分数5%、10%、15%、20%、25%、30%、35%、40%的乙醇溶液,常温浸泡8 h,300 W功率微波处理1 min,所得溶液离心、过滤、真空浓缩后用双蒸水定容,过0.45 μm滤膜,进样分析,保留时间法定性。如图2所示,样品峰与标品峰的保留时间几乎一致,分别为8.253min和8.297 min,以后均按此法进行检测[15-16]。峰面积外标法定量[8-9],测不同体积分数乙醇中提取物的提取量(μg/g)。

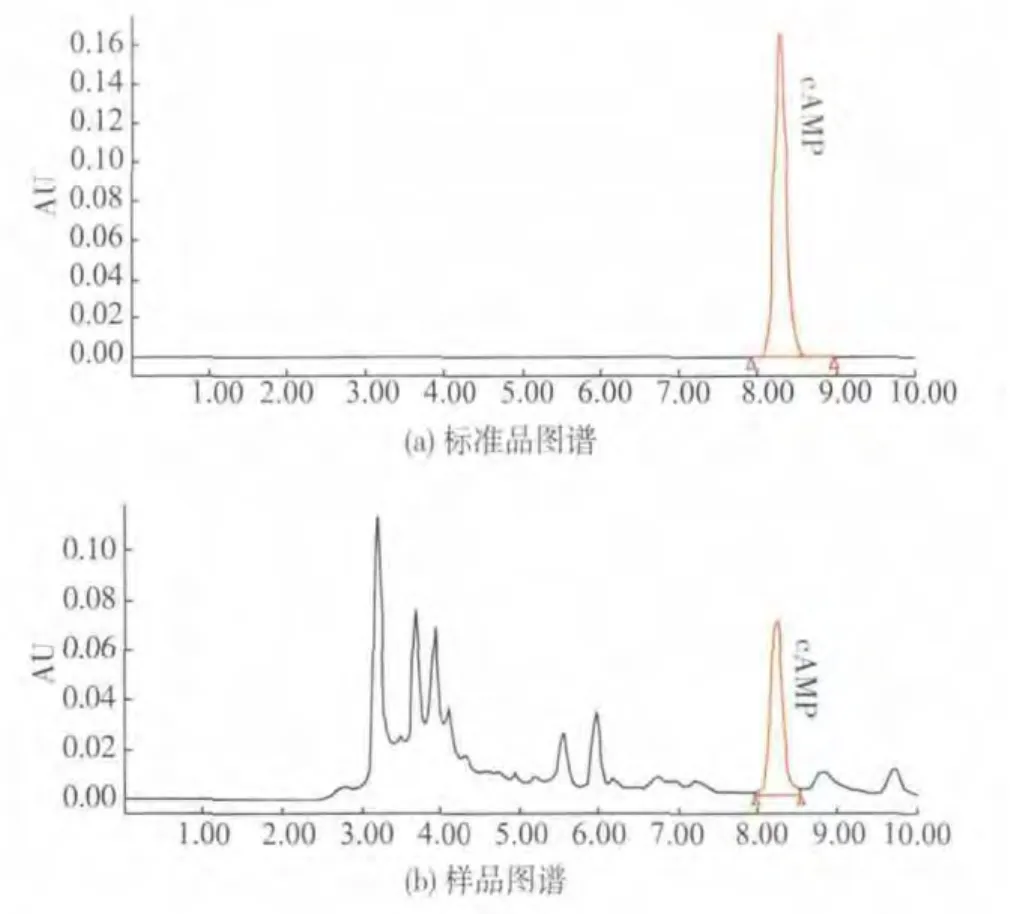
图2 样品及标品中cAMP色谱图Fig.2 Chromatogram of cAMP in jujube sample and standard cAMP
1.2.4 微波提取条件对枣cAMP提取量的影响实验影响微波辅助提取效果的主要因素有微波功率、微波时间、浸泡时间及液料比,对上述4因素进行单因素实验,并在此基础上进行正交实验,确定最佳提取工艺参数[17-21]。在进行微波辅助法提取的同时,与超声波辅助法及传统溶剂法进行对比。
1)微波功率对枣cAMP提取量的影响实验:准确称取和田玉枣粉2 g,以料液比1∶15加入体积分数10%乙醇溶液,常温浸泡8 h,分别在100、200、300、400、500、600 W 功率下微波处理 1 min[22]。分别测定(方法见 1.2.3,下同)cAMP 提取量(μg/g),确定最佳提取功率。
2)微波时间对枣cAMP提取量的影响实验:准确称取和田玉枣粉2 g,以料液比1∶15加入体积分数10%乙醇溶液,常温浸泡8 h,300 W功率分别微波处理 1、2、3、4、5、6 min[23]。分别测定 cAMP 提取量(μg/g),确定最佳提取时间。
3)浸泡时间对枣cAMP提取量的影响实验:准确称取和田玉枣粉2 g,以料液比1∶15加入体积分数 10%乙醇溶液, 分别常温浸泡 0、2、4、6、8、10 h,300 W功率微波处理 3 min[24]。分别测定cAMP提取量(μg/g),确定最佳浸泡时间。
4)液料比对枣cAMP提取量的影响实验:准确称取和田玉枣粉 2 g, 分别以料液比 1∶10、1∶15、1∶20、1∶25、1∶30、1∶35 加入体积分数 10%乙醇溶液,常温浸泡6 h,以300 W功率微波处理3 min。分别测定cAMP提取量(μg/g),确定最佳料液比。
5)正交实验:在单因素实验基础上对微波功率、微波时间、浸泡时间、料液比采用L9(34)正交实验进行优选,以确定最佳微波工艺。因素水平设计见表1[25]。
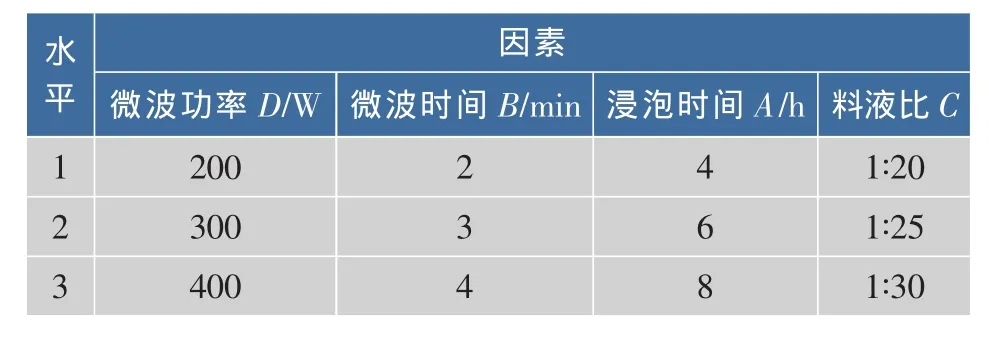
表 1 L9(34)实验因素水平表Table 1 L9(34) Orthogonal factor level table
1.2.5 和田玉枣cAMP的分离效果实验 用LS-200型大孔吸附树脂做动态吸附及解吸实验[11],计算和田玉枣cAMP的分离效率。

1)泄露曲线的研究试验:准确称取25 mL处理好的LS-200型树脂装玻璃层析柱,将和田玉枣粉以1∶15料液比加入体积分数10%乙醇溶液,按照2.2.5中最优条件提取cAMP,过滤后真空浓缩,调整质量浓度为30 μg/mL,pH为4,进行动态吸附[11]:上样体积流量1 mL/min,其间每管收集20 mL,过0.45 μm滤膜,进样分析,测流出液浓度,至流出液浓度与上样液浓度相同时停止上样,做泄露曲线,确定最佳上样体积。
2)LS-200型树脂的洗脱曲线:准确称取25 mL处理好的LS-200型树脂装玻璃层析柱,量取160 mL和田玉枣cAMP上样液,调整质量浓度为30 μg/mL,pH为4,以1 mL/min体积流量上柱吸附。先用蒸馏水洗脱,每50 mL收集一份,再用体积分数35%乙醇洗脱,每20 mL收集一份,分别将洗脱液于50℃下真空浓缩除去溶剂,用蒸馏水定容于25 mL容量瓶中,过0.45 μm滤膜,进样分析,计算其cAMP含量,做洗脱曲线,并将洗脱液真空浓缩后冷冻干燥,测定其纯度。
2 结果与分析
2.1 乙醇体积分数对枣cAMP提取量的影响
乙醇体积分数对枣cAMP提取量的影响见图3。可见,随着乙醇体积分数增大,cAMP提取量先增大后缓慢减小。在乙醇体积分数为15%时,cAMP提取量达到最高,为570.33 μg/g,仅比乙醇体积分数10%时高1 μg/g,考虑能量节省及减少污染等因素,乙醇体积分数以10%为宜。
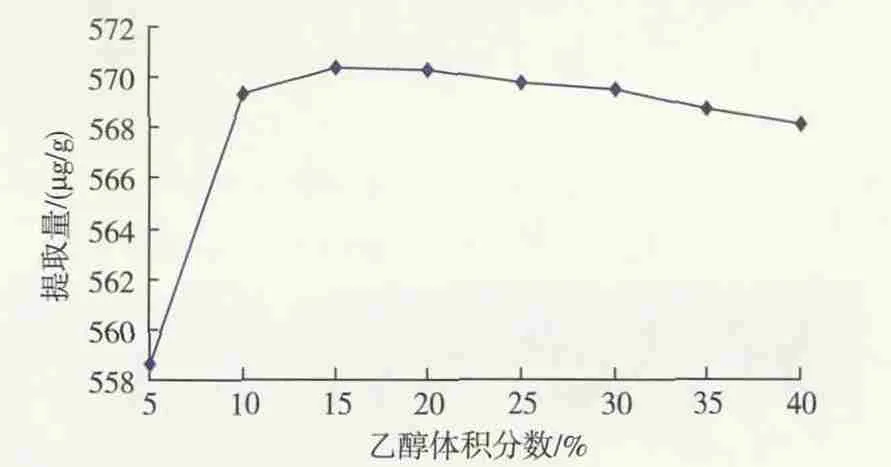
图3 乙醇体积分数对cAMP提取量的影响Fig.3 Effect of ethanol volume fraction on extracting content of cAMP
2.2 微波提取条件对枣cAMP提取量的影响
2.2.1 微波功率对枣cAMP提取量的影响 微波功率对枣cAMP提取量的影响见图4。由图可见,cAMP提取量随微波功率的增大而先增大后缓慢减小,当微波功率为300 W时,cAMP提取量最高为571.23 μg/g,故选择微波提取功率300 W为宜。
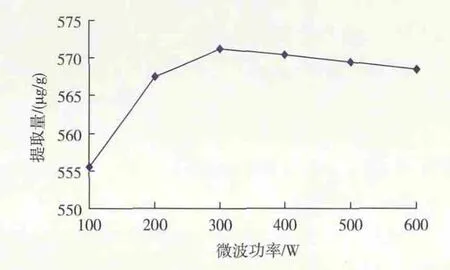
图4 微波功率对cAMP提取量的影响Fig.4 Effect of power of microwave wave on extracting content of cAMP
2.2.2 微波时间对枣cAMP提取量的影响 提取时间对枣cAMP提取量的影响见图5。由图可见,cAMP提取量随微波时间的延长而先增大后缓慢减小,当微波时间为3 min时,cAMP提取量最高为590.89 μg/g,故选择微波提取时间3 min为宜。
2.2.3 浸泡时间对枣cAMP提取量的影响 浸泡时间对枣cAMP提取量的影响见图6。可见,cAMP提取量随浸泡时间的延长而先增大后减小,这是由于适当浸泡可促进细胞中cAMP的溶出,但浸泡时间过长,cAMP又发生改变,当浸泡时间为6 h时,cAMP提取量最高为621.35 μg/g,故选择浸泡时间6 h为宜。
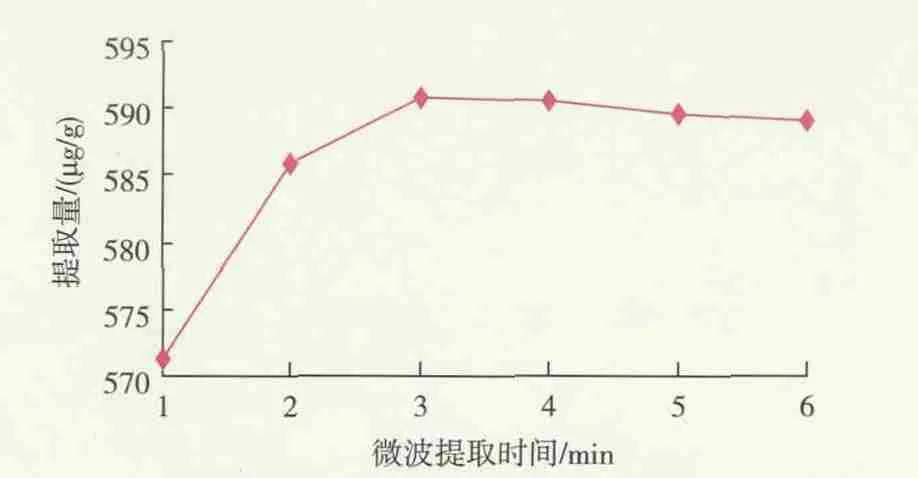
图5 微波时间对cAMP提取量的影响Fig.5 Effect of microwave time on extracting content of cAMP

图6 浸泡时间对cAMP提取量的影响Fig.6 Effect of soak period on extracting content of cAMP
2.2.4 料液比对枣cAMP提取量的影响 料液比对枣cAMP提取量的影响见图7。可见,cAMP提取量随料液比的增大而先增大后趋于一致,当料液比为 1∶25 时,cAMP 提取量最高为 651.65 μg/g, 故选择料液比1∶25为宜。

图7 料液比对cAMP提取量的影响Fig.7 Effect of liquid-solid ratio on extracting content of cAMP
2.2.5 正交实验 按L9(34)进行正交实验,数据处理及结果见表2,方差分析见表3。由极差分析可知,各因素对cAMP提取量影响的大小顺序为:微波时间>微波功率>料液比>浸泡时间。微波辅助提取和田玉枣cAMP最优工艺组合为A2B2C2D3,即微波功率300 W、微波时间3 min、浸泡时间6 h、料液比1∶30。由表3方差分析知,微波功率、微波时间、浸泡时间、料液比差异显著。

表2 正交实验结果Table 2 Result of orthogonal experiment
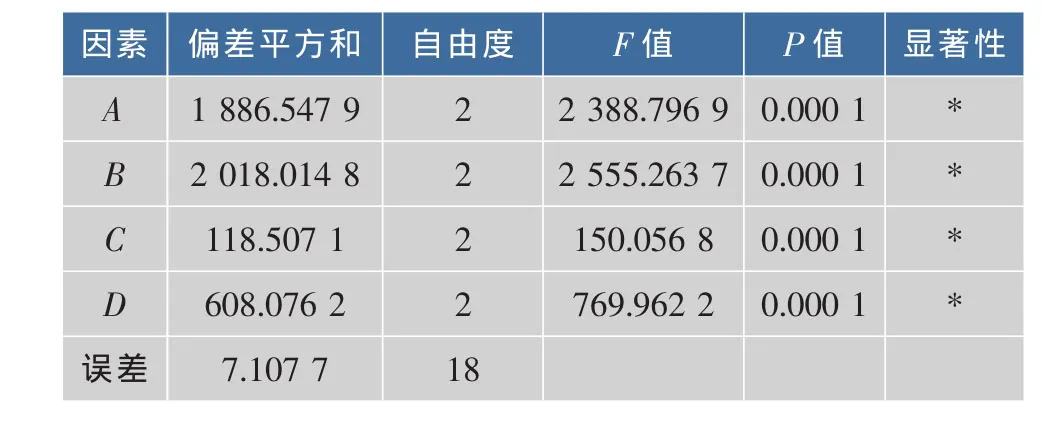
表3 方差分析表Table 3 Variance analysis table
2.2.6 验证实验 正交实验中提取量最高的组合为A2B2C3D1,正交表分析得出最佳组合为A2B2C2D3,对两组工艺进行验证实验,分别重复3次,取平均值。结果表明,最优组合A2B2C2D3的cAMP提取量为 795.63 μg/g,组合 A2B2C3D1提取量为723.59 μg/g,因此微波辅助提取和田玉枣cAMP最优工艺条件为微波功率300 W、微波时间3 min、浸泡时间6 h、料液比 1∶30。
2.3 提取方法比较
采用传统溶剂法[9]、超声波辅助法[11]提取和田玉枣cAMP,并与2.2.5中微波辅助法最优工艺进行对比。3种方法工艺条件及实验结果见表4。可见,微波辅助法(提取量795.63 μg/g)明显优于传统溶剂法(620.28 μg/g),优于超声波辅助法(771.95 μg/g)。由于微波功率及微波时间短,故能耗少于超声波辅助法。
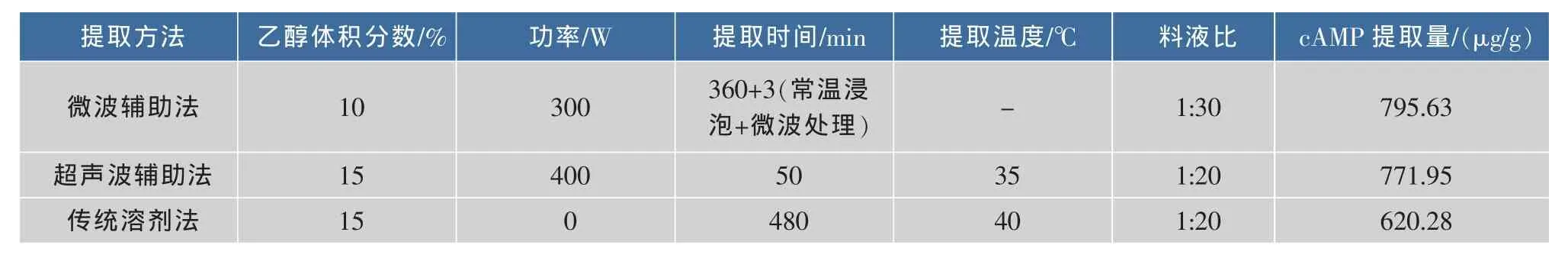
表4 3种提取方法比较Table 4 Comparison of different extraction methods
2.4 和田玉枣cAMP分离纯化效果
2.4.1 泄露曲线 LS-200型树脂对和田玉枣cAMP的泄露曲线见图8。可见,上样160 mL,即第8份收集液以后流出液中cAMP含量开始升高,故将其确定为漏点。确定LS-200型树脂最大上样体积160 mL,即6.4倍树脂体积。

图8 LS-200型树脂对和田玉枣cAMP的泄露曲线Fig.8 Leak curve of LS-200 resint adsorb cAMP from Hetianyuzao
2.4.2 LS-200型树脂洗脱曲线 LS-200型树脂洗脱曲线见图9。可见,水洗过程中极少量cAMP洗脱下来,不影响cAMP得率。同时,HPLC色谱图中发现大量杂质被洗脱下来,第4份水洗物中吸收峰已很少,故确定脱除杂质水洗体积200 mL(8倍树脂体积)。35%乙醇洗脱第一份时,即有cAMP检出,收集至第6份时,洗脱液几乎不含cAMP,故确定体积分数35%乙醇洗脱剂为120 mL,即4.8倍树脂体积。

图9 洗脱曲线Fig.9 Washing curve
经计算和田玉枣cAMP分离效率为97.81%。洗脱过程发现,颜色最重流份中cAMP含量最高,没有颜色流份中几乎不含cAMP,说明cAMP和色素结合在一起,故得到cAMP粗品纯度不高,为3.47%。粗品色谱图见图10

图10 和田玉枣cAMP粗品色谱图Fig.10 Chromatogram of cAMP in Hetianyuzao crude sample
3 结语
经单因素及正交实验分析,确定微波辅助提取和田玉枣cAMP的最优工艺条件:乙醇体积分数10%,微波功率300 W,微波时间3 min,浸泡时间6 h,料液比1∶30。在此工艺条件下,和田玉枣cAMP平均提取量为795.63 μg/g;影响和田玉枣cAMP提取量的各因素显著顺序为:微波时间>微波功率>料液比>浸泡时间。
通过对3种提取方法的比较,得知微波辅助法较传统溶剂法提取量高,提取时间短;较超声波辅助法提取量高,能耗低。
采用LS-200型树脂分离纯化和田玉枣cAMP的分离效率为97.81%。cAMP粗品纯度为3.47%。
[1]程功,白焱晶,赵玉英.枣属植物化学成分及药理活性研究概况[J].国外医药:植物药分册,1999,14(4):151-157.CHENG Gong,BAI Yanjing,ZHAO Yuying.Jujube is a summary of the research on chemical constituents and pharmacological activities in plants[J].Foreign Medical Sciences:Plant Medicine,1999,14(4):151-157.(in Chinese)
[2]Fedyk E R,Adawi A,Looney R J,et al.Regulation of IgE and cytokine production by cAMP:Implication for extrinsic asthma[J].Clinical Immunology and Immunopathology,1996,81(2):101-113.
[3]Nikolaus A.The current status of cyclic AMP in high plants[J].Annual Review of Plant Physiology,1977,2(8):123-132.
[4]Jyong-Chycl Cyong,Kiyomichi Hanabusa.Cyclic adenosine monophosphate in fruits of zizyphus jujuba[J].Pergamon Press Ltd.Printed in England,1980,19:2747-2748.
[5]Hanabusa K,Cyong J,Takahashi M.High-Level of cyclic AMP in the jujube plum[J].Hippokrates Verlag GmbH,1981,42:380-384.
[6]刘孟军,王永惠.枣和酸枣等14种园艺植物cAMP含量的研究[J].河北农业大学学报,1991,14(4):20-23.LIU Mengjun,WANG Yonghui.CAMP contents of zizyphus jujuba mill zizyphus spinosus hu and other twelve hortieural plants[J].Journal of Hebei Agricultural University,1991,14(4):20-23.(in Chinese)
[7]王立霞.和田玉枣cAMP口服液的研制[J].农产品加工,2010(4):76-78.WANG Lixia.Development of Hetian jade jujube cAMP oral liquid[J].The Processing of Agricultural Products,2010(4):76-78.(in Chinese)
[8]王立霞.和田玉枣cAMP的分析检测方法的研究[J].食品科技,2011(7):303-306.WANG Lixia.Methods analysing cAMP from Hetian jade jujuba[J].Food Science and Technology,2011 (7):303-306.(in Chinese)
[9]朱建华,邹秀容,陈侠涛.微波提取碎米中蛋白质的工艺研究[J].现代食品科技,2013(2):294-296.ZHU Jianhua,ZOU Xiurong,CHEN Xiatao.Study on the microwave extraction of protein from broken rice[J].Modern Food Science and Technology,2013(2):294-296.(in Chinese)
[10]王立霞,陈锦屏,张娜,等.和田玉枣中cAMP提取工艺的研究[J].食品工业科技,2009(10):234-236.WANG Lixia,CHEN Jinping,ZHANG Na,et al.Study on technology of extracting cAMP from Hetian jade jujuba[J].Science and Technology of Food Industy,2009(10):234-236.(in Chinese)
[11]王立霞,陈锦屏,张娜,等.和田玉枣中环磷酸腺苷(cAMP)的分离纯化工艺研究[J].食品科学,2008(12):250-254.WANG Lixia,CHEN Jinping,ZHANG Na,et al.Separation and purification of adenosine 3 ,5-Cyclic monophosphate(cAMP)from Hetian jade jujube[J].Food Science,2008(12):250-254.(in Chinese)
[12]王立霞.超声波辅助提取和田玉枣cAMP的工艺研究[J].食品工业科技,2013,34(12):267-274.WANG Lixia.The technology of extracting cAMP from Hetian jade jujuba by the auxiliary of ultrasonic wave[J].Science and Technology of Food Industy,2013,34(12):267-274.(in Chinese)
[13]吴世斌,葛跃,耿莉,等.高效液相色谱法测定环磷酸腺苷及其制剂的含量[J].中国生物药物杂志,2001,22(1):32-33.WU Shibin,GE Yue,GENG Li,et al.Determination of cAMP and its preparation by HPLC[J].Chinese Journal of Biochemical Pharmaceutics,2001,22(1):32-33.(in Chinese)
[14]王荔,亓树艳,莫晓燕.大枣环磷酸腺苷提取纯初步研究[J].食品科技,2012,37(4):191-194.WANG Li,QI Shuyan,MO Xiaoyan.Preliminary on extraction and purification of cAMP from Chinese jujube[J].Food Science and Technology,2012,37(4):191-194.(in Chinese)
[15]周向辉,王娜,石聚领,等.微波-超声波联合提取枣中环磷酸腺苷的工艺研究[J].食品科学,2009,30(18):196-201.ZHOU Xianghui,WANG Na,SHIJuling,etal.Combined ultrasonicandmicrowaveextraction ofcyclicadenodsine monophosphate from ziziphus jujuba cv.huizao fruits[J].Food Science,2009,30(18):196-201.(in Chinese)
[16]崔志强,孟宪军.微波辅助萃取冬枣环磷酸腺苷工艺研究[J].食品科学,2007,28(4):163-166.CUI Zhiqiang,MENG Xianjun.Studyon microwave-assisted extractionofe AMPm winter dates[J].Food Science,2007,28(4):163-166.(in Chinese)
[17]Setyaningsih W,Palma M,Barroso C G.A new microwave-assisted extraction method for melatonin determination in rice grains[J].Journal of Cereal Science,2012,56(2):340-346.
[18]MAO Xuejin,WAN Yiqun,YAN Aiping.Simultaneous determination of organophosphorus,organochlorine,pyrethriod and carbamate pesticides in Radix astragali by microwave-assisted extraction/dispersive-solid phase extraction coupled with GC-MS[J].Talanta,2012,97:131-141.
[19]Zhang Z F,Lv G Y,Pan H J.Optimization of the microwave-assisted extraction process for polysaccharides in Himematsutake(Agaricus blazei Murrill) and Evaluation of their antioxidant activities[J].FoodOOD Science and Technology Research,2011,17(6):461-470.
[20]Mostafa Khajeh,Mansour Ghaffari Moghaddam.Optimization of microwave assisted extraction for determination of iron and manganese in cereal flour using FAAS:Doehlert design[J].Russian Agricultural Sciences,2012,38(4):275-280.
[21]Delazar A,Nahar L,Hamedeyazdan S,et al.Microwave-assisted extraction in natural products isolation[J].Methods Mol Biol,2012,864:89-115.
[22]李紫薇,刘伟,张艺,等.薰衣草总黄酮的微波提取及其抗氧化性研究[J].食品工业科技,2013,34(5):255-258.LI Ziwei,LIU Wei,ZHANG Yi,et al.Study on microwave extraction and antioxidant activity of total flavonoid in lavender[J].Science and Technology of Food Industy,2013,34(5):255-258.(in Chinese)
[23]周丹红,蔡晓咏,王聪,等.微波一超声波辅助提取枸杞中的多糖工艺[J].光谱实验室,2013,30(1):383-387.ZHOU Danhong,CAI Xiaoyong,WANG Cong,et al.Technology of extraction of polysaccharides from lycium barbarum by microwave-ultrasonic assisted extration[J].Chinese Journal of Spectroscopy Laboratory,2013,30(1):383-387.(in Chinese)
[24]邹建国,刘飞,刘燕燕,等.响应面法优化微波辅助提取枳壳中总黄酮工艺[J].食品科学,2012,33(2):24-28.ZOU Jianguo,LIU Fei,LIU Yanyan,et al.Optimization of microwave-assisted extraction of total flavonoids from fructus aurantii immaturus by response surface methodology[J].Food Science,2012,33(2):24-28.(in Chinese)
[25]王建辉,刘永乐,李赤翎,等.丝兰皂甙的微波辅助提取工艺研究[J].食品科学,2012,33(2):58-62.WANG Jianhui,LIU Yongle,LI Chiling,et al.Optimization of microwave-assisted extraction process for yucca saponins[J].Food Science,2012,33(2):58-62.(in Chinese)

