常山胡柚皮柠檬苦素提取工艺
刘晓政, 施堂红, 占元毅, 严晓丽
(浙江省果品质量检验中心,浙江 常山324200)
柠檬苦素类化合物(Limomin)是一类高度氧化的四环三萜类植物次生代谢产物,主要存在于芸香科和楝科植物中[1-2]。柑桔属芸香科植物,是天然柠檬苦素化合物的主要来源[3]。大量动物试验表明,柠檬苦素类物质可以抑制由化学物质导致的肝癌、乳腺癌、胃癌等,且作用强于抗癌药物他莫昔芬。柠檬苦素化合物在镇痛、调节体内胆固醇水平、防止动脉粥样硬化和除虫方面也具有明显的效果[4-8]。
常山胡柚果实与常见的柑桔果实不同,它在中医学上属于凉性果品,具有清凉祛火、平喘化痰、生津止咳、健胃壮身、降血脂、抗便秘、抗衰老等特殊的药理功效[9]。胡柚皮作为胡柚的下脚料常常被丢弃,仅有小部分用于制作胡柚果茶、果脯等,大部分被废弃,易造成资源的浪费和环境的污染。
作者对常山胡柚皮中柠檬苦素的几种提取方法进行了比较研究,确定了水作为提取剂的工艺参数,为实现常山胡柚皮中柠檬苦素的无污染提取、促进常山胡柚深加工的产业化发展提供了理论依据和实践基础。
1 材料与方法
1.1 材料与试剂
常山胡柚皮:将常山太公山胡柚基地的胡柚鲜果皮切块,洗净后置于45℃烘箱内,烘10 h后粉碎,放入密封塑料袋中,置于干燥器内保存。柠檬苦素标准品,上海同田生物公司产品,纯度98.0%。甲醇、正丁醇,均为乙腈色谱纯;二氯甲烷、无水乙醇、正丁醇和丙酮,均为分析纯。水为超纯水。
1.2 仪器与设备
ProStar230型液相色谱仪,美国瓦里安公司制造;PL403型电子天平,梅特勒-托利多仪器(上海)有限公司制造;KQ-500DE超声波清洗机,昆山舒美超声仪器有限公司制造;电热鼓风干燥箱,上海森信实验仪器有限公司制造;R-200型旋转蒸发器,瑞士布奇公司制造;数显水浴锅,上海银屏仪器仪表有限公司制造;超纯水器,杭州永洁达净化科技有限公司制造;循环水式真空泵,河南巩义英峪予华仪器厂制造;0.45 μm针头过滤器,安捷伦科技有限公司制造。
2 实验方法
2.1 柠檬苦素的测定方法
色 谱 柱 :ZORBAX SB-C18 StableBond Analytical,4.6 mm×250 mm,5-Micron;进样量 10 μL;流动相乙腈与水体积比为45∶55;紫外检测器波长210 nm;流动相体积流量1.0 mL/min。以标样的保留时间和峰面积进行定性,定量计算柠檬苦素质量分数Y。

式(1)中,m为提取物所含柠檬苦素质量(mg),M为胡柚皮样品质量(g)。详见文献[10-11]。
2.2 柠檬苦素标准液的制备
精确称取柠檬苦素标准品,用乙腈溶解定容,配制成质量浓度为 50、100、200、400、800 μg/mL 的系列标准工作溶液。
2.3 胡柚皮中柠檬苦素提取方法
详见文献[12-16]。
2.3.1 水浴提取法 准确称取2.000 g样品置于三角瓶中,加入60 mL有机溶剂,在50℃下水浴回流提取2 h;准确称取2.000 g样品置于三角瓶中,加入60 mL水,在100℃下水浴回流提取2 h。
2.3.2 超声波提取法 准确称取2.000 g样品置于三角瓶中,加入60 mL提取液(有机溶剂或水),室温下(25℃)超声提取2 h。样品提取后,提取液用滤纸过滤,将滤液置于旋转蒸发器减压蒸干,立即加入2 mL乙腈洗脱溶解,经针头过滤器过滤进样。用水作为提取溶剂时,样品提取后,提取液用滤纸过滤,将滤液真空干燥至干,立即加入2 mL乙腈洗脱溶解,经针头过滤器过滤进样。
2.4 单因素试验
考察了提取温度(℃)、提取时间(h)和料液比(g/mL)3个因子对胡柚皮中柠檬苦素提取率的影响,每个实验作5次平行样。
3 结果与讨论
3.1 柠檬苦素的定性分析
按照色谱条件2.1,柠檬苦素标准品及样品的高效液相色谱如图1所示,柠檬苦素标准品的保留时间为13.756 min,样品中柠檬苦素的保留时间为13.768 min。样品的色谱图峰形好,较对称,分离效果好。
3.2 标准曲线和检出限
在50~800 μg/mL范围内,按选定的色谱条件进行HPLC分析,以保留时间定性,以峰面积对标准品的质量浓度绘制工作曲线。在该浓度范围内呈良好线性关系,峰面积与质量浓度的线性回归方程为

相关系数r=0.999 6。当信噪比S/N=3时,柠檬苦素的检测限为 0.028 μg/g。

图1 柠檬苦素标准品及胡柚皮样品图谱Fig.1 Chromatograms of Limonin standard and sample
3.3 精密度及稳定性
精确吸取质量浓度为400 μg/mL的柠檬苦素标准液,重复进样5次,以测得的柠檬苦素的峰面积为参数,计算得相对标准偏差RSD (n=5)为1.64%,表明方法精密度好。精确吸取质量浓度为50、100、200、400、800 μg/mL 的标准品,每隔 2 h 进样一次,各进样5次,以测得的柠檬苦素的峰面积为参数,计算得相对标准偏差RSD(n=5)分别为2.34%、1.55%、2.91%、0.86%、0.78%, 结果均小于5%,说明检测方法具有较好的稳定性。
3.4 加标回收率
精确吸取已经定量的柠檬苦素标准品,分成2组,准确加入到胡柚皮样品中。一组用有机溶剂乙醇进行提取,另一组用水进行提取。结果显示用乙醇进行提取的样品平均回收率为92.4%,用水进行提取的样品平均回收率为90.1%,相对标准偏差分别为3.49%和2.91%。
3.5 单因素实验
3.5.1 有机溶剂提取及水提取 选择了二氯甲烷、甲醇、乙醇、丙酮、正丁醇、乙腈6种有机溶剂,比较不同有机溶剂对常山胡柚皮中柠檬苦素的提取得率的影响。参照试验方法2.3,精确称取胡柚皮样品2.000 g,加入60 mL有机溶剂,在50℃下水浴回流提取2 h。由图2可知,乙醇和二氯甲烷的提取效果相近,也优于其他的提取溶剂。二氯甲烷提取柠檬苦素的得率为2.82 mg/g,乙醇提取柠檬苦素的得率为2.97 mg/g,乙腈的提取效果最差。准确称取2.000 g样品置于三角瓶中,加入60 mL水,在100℃下水浴回流提取2 h。研究以水作为提取液时,常山胡柚皮中的柠檬苦素的得率,柠檬苦素得率为2.42 mg/g。综合考虑成本、有机溶剂的危害等,选择乙醇为有机溶剂提取液和水作为提取液进行比较研究。
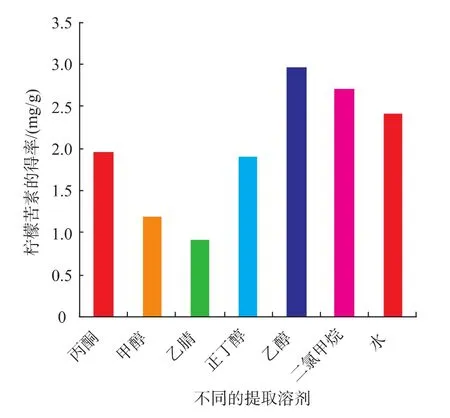
图2 不同提取溶剂对柠檬苦素得率的影响Fig.2 Effect of different extraction solvent on yield of Limonin
3.5.2 提取时间的比较 提取时间是影响工艺成本、工艺效率的重要因素。参照试验方法2.3中样品提取方法,精确称取胡柚皮样品2.000 g,加入60 mL乙醇,在50℃条件水浴回流提取,研究乙醇作为提取溶剂时提取时间对提取效果的影响;精确称取胡柚皮样品2.000 g,加入60 mL水,在100℃条件水浴回流提取,研究水提取时时间对提取效果的影响。由图5可知,无论是乙醇提取还是水提取,随着时间的延长,柠檬苦素的得率明显上升。乙醇提取时,时间达到60 min,柠檬苦素提取得率达到最高,但是随着时间延长,柠檬苦素提取得率变化不明显。用水作为提取溶剂时,90 min为最佳的提取时间。
3.5.3 提取温度的选择 温度是影响提取工艺的重要参数。样品提取方法参照试验方法2.3进行,料液比 1∶30(g/mL),乙醇提取时间 60 min,水提取时间90 min。用乙醇作为提取溶剂时,研究了30~70℃范围内,温度对柠檬苦素提取得率的影响;以水作为提取液时,研究了40~100℃范围内温度的影响。由图4可知温度对柠檬苦素提取得率的影响较大。

图3 提取时间对常山胡柚皮中柠檬苦素得率的影响Fig.3 Effect of extracting time on yield of Limonin

图4 提取温度对常山胡柚皮中柠檬苦素得率的影响Fig.4 Effect of extracting temperature on yield of Limonin
乙醇提取时,当温度到50℃时达到最佳,50~60℃时,柠檬苦素在有机溶剂中提取得率的变化不明显;在60~70℃范围内,柠檬苦素的提取得率有所降低,因此选择50℃作为最佳的提取温度。用水作为提取溶剂时,温度达到80℃柠檬苦素得率达到最高;温度高于80℃时,柠檬苦素的提取得率升高不明显。
3.5.4 料液比 通常提取液越多,提取效果越好。但过多的提取液也将造成资源的浪费、成本的增加。参照试验方法2.3,研究料液比对提取效果的影响。乙醇提取时,提取温度为50℃,提取时间60 min;水提取时,提取温度为80℃,提取时间90 min。结果由图5可知,用乙醇提取时,在料液比为1∶20(g/mL)时,常山胡柚皮中的柠檬苦素提取得率达到最大值,随着提取液的增多,提取得率并没有明显增高;用水提取时,最佳料液比为 1∶25(g/mL)。
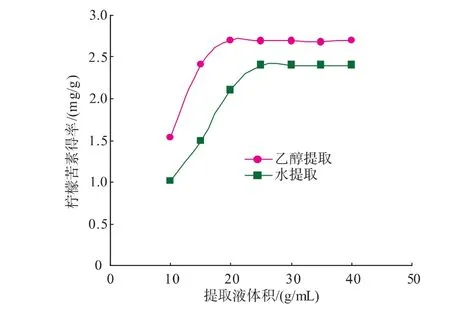
图5 料液比对柠檬苦素提取得率的影响Fig.5 Effect of solid-liquid ratio on yield of Limonin
3.5.5 超声波辅助提取 参照试验方法2.3,在室温条件下,研究超声辅助提取对柠檬苦素得率的影响。乙醇提取时,料液比 1∶20(g/mL),提取时间 60 min,室温下超声提取。 水提取时,料液比1∶25(g/mL),提取时间90 min,室温下超声提取。结果表明:超声有利于常山胡柚皮中柠檬苦素的提取。超声波的扩散、振荡等效应,可以使柠檬苦素从胡柚皮中扩散到溶剂中,缩短提取时间,提高柠檬苦素的得率。以乙醇作为提取溶剂时,柠檬苦素的得率为3.22 mg/g;以水作为提取液时,柠檬苦素的得率为2.87 mg/g。
4 结语
本文报道的常山胡柚皮中柠檬苦素的检测体系,精密度、稳定性好,标准曲线在 50~800 μg/mL范围内,相关系数r=0.999 6。柠檬苦素的检测限为0.028 mg/g。加标回收率在90%以上。
常山胡柚皮中的天然柠檬苦素的提取可以采用有机溶剂二氯甲烷和乙醇进行提取。用乙醇作为提取溶剂,单因素最佳提取条件为温度50℃,提取时间 60 min,料液比 1∶20(g/mL),柠檬苦素的提取得率为2.97 mg/g。用水作为提取溶剂,单因素最佳提取条件为温度80℃,提取时间90 min,料液比1∶25(g/mL),柠檬苦素的提取得率为2.42 mg/g。超声波辅助提取时,以乙醇作为提取溶剂,在室温下超声提取60 min,柠檬苦素的得率为3.32 mg/g;以水作为提取溶剂,在室温条件下超声提取90 min,柠檬苦素的得率为2.87 mg/g。
以水作为提取溶剂,无毒、可食、易得,有利于常山胡柚皮中柠檬苦素提取实现产业化。
[1]蔡护华,桥永文男.柑桔果实中柠檬苦素类化合物的研究现状与展望[J].植物学报,1996,38(4):328-336.CAI Huhua,Hashinaga Fumio.The prospect and current studies on the limonoids in citrus[J].Acta Botanica Sinica,1996,38(4):328-336.(in Chinese)
[2]黎继烈,张慧,曾超珍,等.超声波辅助提取金橘柠檬苦素工艺研究[J].中国食品学报,2009,9(4):96-102.LI Jilie,ZHANG Hui,ZENG Chaozhen,et al.Study on ultrasonic extraction technology of limonin from the kumquat[J].Journal of Chinese Institute of Food Science and Technology,2009,9(4):96-102.(in Chinese)
[3]刘君.柑桔种子中类柠檬苦素提取纯化工艺研究[D].重庆:西南大学,2008.
[4]孙崇德,陈昆松,戚行江,等.柑桔果实柠檬苦素类化合物的研究与应用[J].浙江农业学报,2002,14(5):297-302.SUN Chongde,CHEN Kunsong,QI Xingjiang,et al.Studies and utilizations on limonoids from citrus frutis[J].Acta Agriculturae Zhejiangensis,2002,14(5):297-302.(in Chinese)
[5]童红梅.柠檬苦素类化合物临床作用的研究应用[J].农产品加工学刊,2009(11):69-71.TONG Hongmei.Research and application of limonin compounds clinical role[J].Academic Periodical of Farm Products Processing,2009(11):69-71.(in Chinese)
[6]田庆国,戴军,丁霄霖.液相色谱/电喷雾质谱测定柑桔中的柠檬苦素类似物配糖体[J].色谱,2000,18(4):291-294.TIAN Qingguo,DAI Jun,DING Xiaolin.Screening for limonoid glucosides in Citrus grandis L osbeck by high performance liquid Chromatography-Electrospray Ionization/Mass spectrometry[J].Chinese Journal of Chromatography,2000,18 (4):291-294.(in Chinese)
[7]Shibu M Poulose,Edward D Harris,Bhimanagouda S Patil.Antiproliferative effects of citrus Limonoids against human neuroblastoma and colonic adenocarcinoma cells[J].Nutrition and Cancer,2006,56(1):103-112.
[8]SUN Chongde,CHEN Kunsong,CHEN Yang,et al.Contents and antioxidant capacity of limonin and nomilin in different tissues of citrus fruit of four cultivars during fruit growth and maturation[J].Food Chemistry,2005,93(4):599-605.
[9]仲山民,胡芳名,田荆祥.常山胡柚果实的综合利用研究[J].江西林业科技,2003(2):15-17.ZHONG Shanmin,HU Fangming,TIAN Jingxiang.Study on the comprehensive utilization of fruit of citrus changshan-huyou[J].Jiangxi Forestry Science and Technology,2003(2):15-17.(in Chinese)
[10]Soleiman Abbasi,Parvin Zandi,Esmaeil Mirbagheri.Quantitation of limonin in Iranian orange juice concentrates using highperformance liquid chromatography and spectrophotometric methods[J].European Food Research and Technology,2005,221(1-2):202-207.
[11]Robert J Braddock,Charles R Bryan.Extraction parameters and capillary electrophoresis analysis of limonin glucoside and phlorin in citrus byproducts[J].Journal of Agricultural and Food Chemistry,2001,49(12):5982-5988.
[12]谢明勇,陈奕.微波辅助萃取技术研究进展[J].食品与生物技术学报,2006,25(1):105-114.XIE Mingyong,CHEN Yi.The research progress of Microwave-Assisted extracting technology[J].Journal of Food Science and Biotechnology,2006,25(1):105-114.(in Chinese)
[13]Girija Raman,Minhee Cho,Jennifer S Brodbelt,et al.Isolation and purification of closely related citrus limonoid glucosides by flash chromatography[J].Phytochemical Analysis,2005,16(3):155-160.
[14]赵二劳,赵小花,范建凤.金莲花黄酮微波辅助提取及其抗氧化性[J].食品与生物技术学报,2009,28(1):81-85.ZHAO Erlao,ZHAO Xiaohua,FAN Jianfeng.Study on the extraction and antioxidation of flavone from trollius chinensis bunge[J].Journal of Food Science and Biotechnology,2009,28(1):81-85.(in Chinese)
[15]Gary D Manners,Shin Hasegawa.A new normal phase liquid chromatographic method for the analysis of limonoids in Citrus[J].Phytochemical Analysis,1999,10(2):76-81.
[16]Gary D Manners.Citrus limonoids:Analysis,bioactivity,and biomedical prospects[J].Journal of Agricultural and Food Chemistry,2007,55(21):8285-8294.
——营养
——去皮

