黄曲霉毒素B1与杂色曲霉素对HepG2细胞的联合毒性
刘 洋, 杜 明, 张根义
(江南大学 食品学院,江苏 无锡 214122)
复杂的自然界中经常会有不同类型的真菌毒素共同存在,人们在生活中有可能同时接触2种甚至2种以上的毒素,不同毒素共存时对机体的联合毒性作用引起了人们的广泛研究。M.J.Ruiz研究了白僵菌素(BEA)、呕吐毒素(DON)和 T-2毒素在CHO-K1细胞中的联合作用,其中BEA和T-2毒素为协同作用,DON与BEA、T-2均显示为拮抗作用[1];熊丽林求得微囊藻毒素和黄曲霉毒素及伏马菌素的联合作用类型为加和作用[2]。
黄曲霉毒素 B1(Aflatoxin B1,简称 AFB1)是目前已知的毒性较强的真菌毒素,它可以导致诱发性肝癌的产生。有关黄曲霉毒素在不同剂量下单独作用于多种细胞的急慢性毒性已有很多报道,但关于黄曲霉毒素与其它毒素的联合作用的毒性研究较少。杂色曲霉素(Sterigmatocystin,简称ST)由10多种真菌代谢产生,是一种含有呋喃环的氧杂蒽酮类化合物,已知被ST污染的食品包括大米、小麦、玉米、花生、大豆、火腿、奶酪、咖啡等,而黄曲霉毒素AFB1也广泛存在于各种谷物和饲料中,它们共存的可能性非常高。为此选取了黄曲霉毒素B1和杂色曲霉素进行联合毒性的研究。AFB1的主要靶器官是肝脏,同时ST在肝内会转化成1,2-环氧ST,该物质会与DNA形成加合物,这极有可能是ST导致肝癌发生的机制[3],因此肝脏是 AFB1和 ST共同的主要靶器官。
HepG2细胞来源于人肝胚细胞瘤,分化程度较高[4],并且其所含的生物转化代谢酶与人正常肝实质细胞具有同源性,其中肝细胞色素P450是主要参与体内药物代谢的酶系[5],对许多内源性、外源性化合物在体内Ⅰ相生物转化有重要作用,许多药物通过P450酶的调控作用来影响其活性,因而选择HepG2细胞为实验对象,来研究AFB1和ST的联合毒性作用。
1 材料与方法
1.1 材料
HepG2人肝癌细胞,中国科学院细胞库提供;DMEM高糖培养基、胎牛血清、胰酶、无酚红HBSS,Gibco公司提供;杂色曲霉素标准品(ST)、黄曲霉B1标 准 品 (AFB1)、SRB、TCA、H33258、Tris base、小 牛胸腺 DNA、DCFH-DA、DCF、罗丹明 123,Sigma公司提供;ATP检测试剂盒,碧云天生物技术公司提供;Infinite 1000酶标仪,Tecan公司产品。
1.2 细胞培养与染毒
HepG2细胞用内含体积分数10%胎牛血清、质量分数0.5%青霉素-链霉素的DMEM高糖培养基,于37℃、质量分数5%CO2培养箱中培育至对数生长期[6]。用DMSO溶解AFB1、ST制成母液,再用DMEM培养基稀释1 000倍至DMSO终质量分数为0.1%的储备液。用含有质量分数0.1%DMSO溶液的DMEM培养基将储备液配制为所需浓度的工作液。
1.3 细胞毒性测定方法
1.3.1 SRB法测定AFB1、ST对HepG2细胞的半数抑制浓度 调整对数期细胞密度为3×104个/mL,每孔200 μL接种于96孔板中孵育24 h后,弃去培养液,加入含AFB1或者ST的培养液继续培养48 h。每孔加入4℃预冷的三氯乙酸(TCA)溶液,4℃固定1 h,去离子水洗4~5次,风干后每孔加入4 g/L SRB溶液,室温下孵育30 min,用质量分数1%乙酸洗4~5次,风干后每孔加入10 mmol/L的Tris-HCl缓冲液(pH 7.4),摇动混匀,震荡5 min后在490 nm下测定吸光度A(下标g、k、d分别表示给药组、空白组、对照组)。计算不同时间、不同浓度的真菌毒素对HepG2细胞的增殖抑制率。增殖抑制率
Y=[1-(Ag-Ak)/(Ad-Ak)]×100%。
其中 AFB1染毒浓度为 0 (溶剂对照)、1、5、10、50、100 μmol/L,ST 染毒浓度为 0(溶剂对照)、0.1、1、5、10、14 μmol/L,溶剂对照组为含有质量分数0.1%DMSO的DMEM培养基,每个实验组4个重复。
1.3.2 AFB1和ST对HepG2细胞各部位损伤的检测 设置染毒剂量时使大部分细胞处于染毒未致死的状态,其中AFB1染毒浓度为0(溶剂对照)、0.5、1、5、10 μmol/L;ST 染毒浓度为 0 (溶剂对照)、0.5、2.5、5、7 μmol/L;联合染毒组设置为 0(溶剂对照),AFB1(10 μmol/L)+ST(浓度设置与单独染毒组相同),ST(5 μmol/L)+AFB1(浓度设置与单独染毒组相同);对照组为含有质量分数0.1%DMSO的DMEM培养基,每个实验组4个重复[2]。
1)SRB法测定细胞增殖力的变化:操作步骤同1.3.1。
2)细胞内总DNA含量的测定:调整对数期细胞密度为 5×104个/mL,每孔 200 μL接种于 96孔板中孵育24 h后,弃去培养液,加入含AFB1或者ST的培养液继续培养24、48 h。染毒24 h或48 h后,弃培养基,37℃预热的HBSS洗一遍,将96孔板置于-80℃的冰箱中冷冻1 h,然后置于37℃水浴锅中加热30 min,在所有样品孔、对照孔和空白孔中加入100 μL去离子水,再放入-80℃冰箱中冷冻1 h,37 ℃加热 30 min后,每孔加入 100 μL 5 mg/mL的H33258染料,同时绘制小牛胸腺DNA标准曲线。室温下避光静置30 min后用荧光酶标仪测各孔的荧光值[7]。
3)细胞内ATP含量的测定:调整对数期细胞密度为5×104个/mL,每孔200 μL接种于96孔板中孵育24 h后,弃去培养液,加入含AFB1或者ST的培养液继续培养24、48 h。染毒24 h或48 h后,弃培养基,每孔加入20 μL ATP裂解液(冰上操作),反复吹打使细胞完全裂解,每孔加180 μL PBS将裂解液洗出,12 000 g离心10 min后,取100 μL上清液,加入预先加有100 μL ATP检测工作液的底部透明板中,迅速混匀后,立即用化学发光酶标仪检测荧光值。根据标准曲线计算出加药组细胞内ATP浓度。
4)细胞内线粒体通透性的转换:调整对数期细胞密度为 5×104个/mL,每孔 200 μL接种于 96孔板中孵育24 h,弃培养基,每孔加入5 μg/mL罗丹明123工作液,质量分数5%CO237℃孵育30 min后,1 000 r/min离心10 min,用培养基洗一遍,相同条件离心后加入含AFB1或者ST的培养液继续培养24、48 h,使用荧光酶标仪测定荧光值,根据标准曲线计算出加药组细胞内检测到的罗丹明123含量,判断细胞内线粒体通透性的改变。
5)细胞内活性氧含量的测定:调整对数期细胞密度为5×104个/mL,每孔200 μL接种于96孔板中孵育24 h后,弃去培养液,37℃预热的PBS洗一遍后,加入37℃预热的DCFH-DA探针(终浓度为10 μmol/L,溶解于DMEM中),37℃避光孵育30 min后,1 000 r/min离心10 min,将探针吸除,加入DMEM清洗探针,再1 000 r/min离心10 min,吸除DMEM后将各孔换为含AFB1或者ST的培养液继续培养24、48 h,采用荧光酶标仪检测二氯荧光黄(DCF)的荧光强度[8]。
1.4 统计分析
实验数据均以x±s进行表示,使用SPSS20.0软件进行统计分析,采用origin18.1软件绘图。用Probit analysis算出各毒素的IC50[9]。ST与AFB1混合物对HepG2联合毒性作用类型采用成对样本T检验“预测值”和“测量值”之间的显著性差异,若P>0.05,表示两组数据无显著性差异,反映AFB1与ST的联合毒性为加和作用[10]。其中,“预测值”为AFB1或ST的固定浓度产生的效应值与另一种毒素的各浓度梯度单独作用于细胞分别产生的效应值的相加值;“测量值”为两种毒素以不同浓度混合后实际测得毒素对细胞产生的效应值。5个毒性作用终点采用主成分分析法(PCA)进行聚类分析。
2 结果与分析
2.1 AFB1、ST对HepG2细胞的半数抑制浓度
AFB1和ST对HepG2细胞增殖力的抑制率呈现剂量相关性,根据实验中染毒浓度对应的细胞增殖力抑制率,使用SPSS进行Probit analysis分析,概率为50%时对应的浓度即为该毒素对HepG2细胞的半数抑制浓度(IC50)。两种毒素对HepG2细胞的IC50如表1所示。从表1可看出,ST的 IC50要比AFB1的IC50低50%,说明ST对HepG2细胞的毒性高于AFB1的毒性。
2.2 AFB1、ST单独作用及联合作用对HepG2细胞的细胞增殖力影响
AFB1、ST对细胞的毒性作用在24 h时并没有明显的趋势,48 h时细胞增殖力的降低程度基本呈现毒素剂量相关性。如图1所示,细胞染毒48 h后,与对照组(100%)相比,单独作用时AFB1浓度在0.5~10 μmol/L时,细胞增殖力抑制率为 6.28%~43.59%, 呈指数型下降;ST浓度在 0.5~7 μmol/L时,细胞增殖力抑制率为24.32%~49.5%,呈线性下降;联合作用时,ST+AFB1(10 μmol/L)混合组中,ST浓度为0.5 μmol/L时的抑制率为45.39%,同单独作用时ST的最大浓度即7 μmol/L的抑制率基本一致。并且从图1(b)可以看出,AFB1+ST混合组的抑制率均高于单独作用组,其中 ST(5 μmol/L)+AFB1混合组的细胞增殖力呈指数型下降,ST+AFB1(10 μmol/L)混合组的增殖力呈线性下降,可以看出两种毒素混合后并不会影响毒素自身对细胞增殖力抑制作用的变化规律。
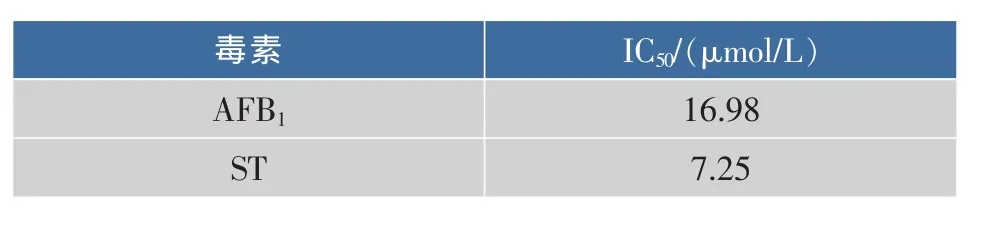
表 1 AFB1、ST 对 HepG2的 IC50Table 1 IC50determinations of AFB1and ST in HepG2 by probit analysis
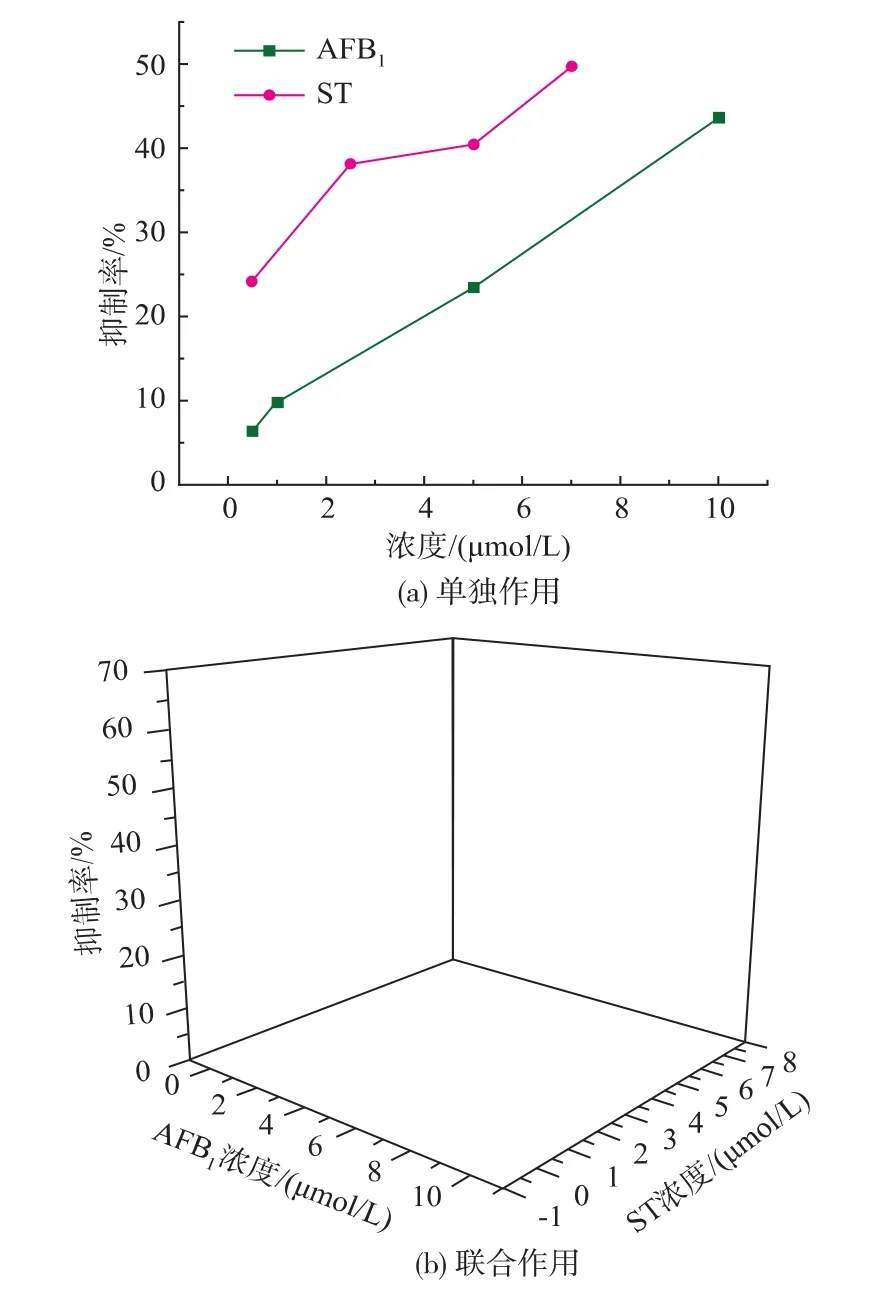
图1 AFB1和ST对HepG2细胞的细胞增殖力的影响(48 h)Fig.1 Inhibition rate of AFB1and ST in HepG2(48 h)
2.3 AFB1、ST单独作用及联合作用对HepG2细胞DNA含量的影响
细胞在96孔板中经过两次冻融循环被破坏并释放DNA,而H33258与双链DNA结合时由非荧光物质转化为高荧光物质,反映了细胞中总DNA的含量。AFB1、ST对细胞DNA含量的影响在24 h时并不明显,48 h时DNA含量的降低程度基本呈现毒素剂量相关性。如图2所示,细胞染毒48 h后,与对照组 (100%)相比,单独作用时AFB1浓度在0.5~10 μmol/L 时,DNA 质量分数(相对质量)下降为110.55%~55.21%,呈对数型下降;ST浓度在0.5~7 μmol/L时,DNA质量分数下降为 116.27%~76.89%,下降趋势可用乘幂回归表示;实验结果中细胞DNA含量在低剂量组中出现了高于对照组DNA含量的现象,可能由于低剂量的毒素未对细胞造成损伤,反而引起细胞内的抵抗反应,合成了较多的DNA,从而高出对照组的含量。联合作用时,ST(5 μmol/L)+AFB1混合组中,AFB1浓度为 0.5 μmol/L时的DNA质量分数下降为54.72%,同单独作用时AFB1的最大浓度即10 μmol/L时的DNA含量基本一致。
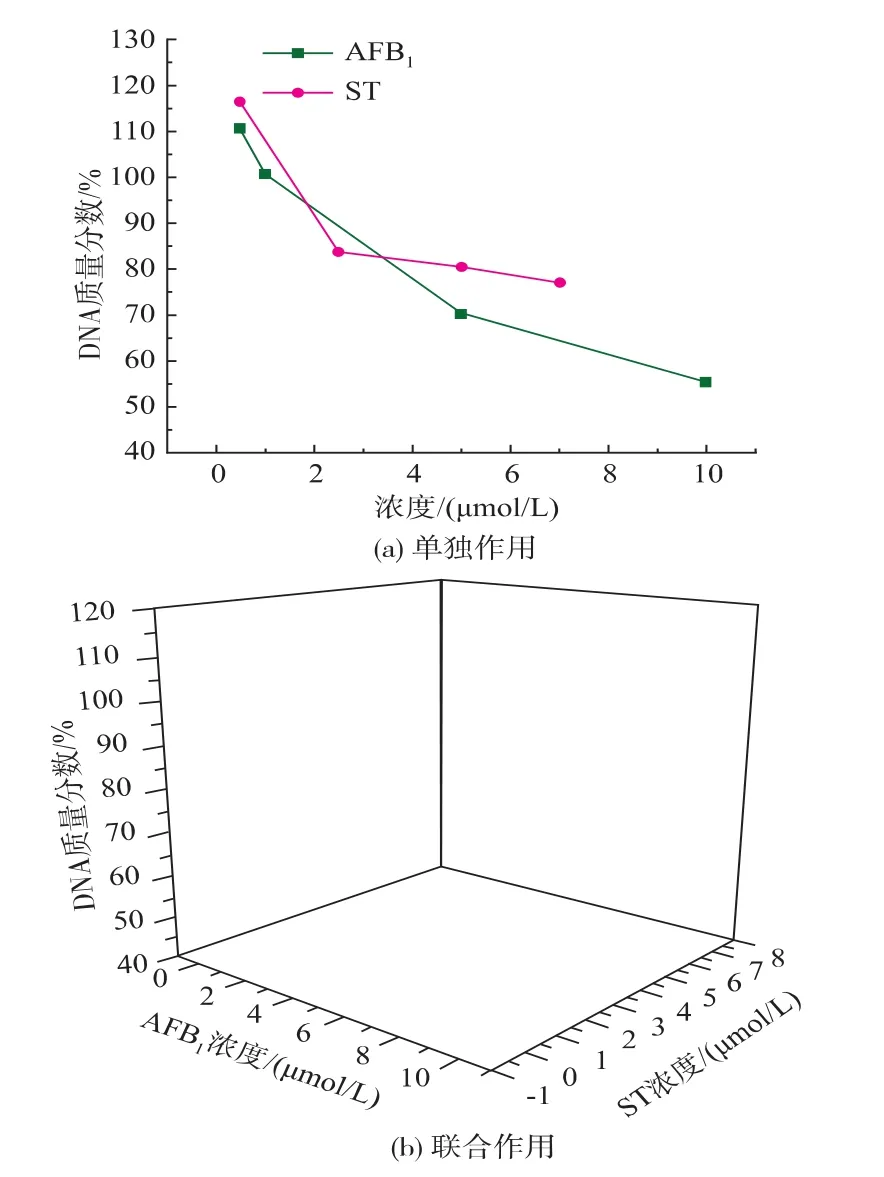
图2 AFB1和ST对HepG2细胞内DNA含量的影响(48 h)Fig.2 Effect of AFB1and ST on DNA content in HepG2 cells(48 h)
从图2(b)可以看出,AFB1+ST混合组的DNA减少量均高于单独组,其中 ST(5 μmol/L)+AFB1混合组的细胞增殖力呈对数型下降,ST+AFB1(10 μmol/L)混合组的增殖力的下降趋势可用乘幂回归表示,可以看出毒素在单独作用和联合作用时,并不会因为另外一种毒素的混合而影响其本身对细胞的毒性作用。
2.4 AFB1、ST单独作用及联合作用对HepG2细胞ATP水平的影响
细胞ATP水平在24 h时已基本呈现毒素剂量相关性,48 h时ATP含量的降低程度更加明显。如图3所示,细胞染毒24 h后,与对照组(100%)相比,AFB1浓度在 0.5~10 μmol/L 时,单独作用及联合作用时ATP含量呈线性下降;而ST单独作用浓度在 0.5~7 μmol/L时,ATP摩尔分数(相对物质的量)下降为42.30%~22.21%,为乘幂型下降,与AFB1联合作用后同样呈乘幂型下降。ATP是5个毒性作用终点中最早对毒素产生显著反应的指标,较早的反应细胞的染毒状态可以作为细胞染毒的早期检测指标。
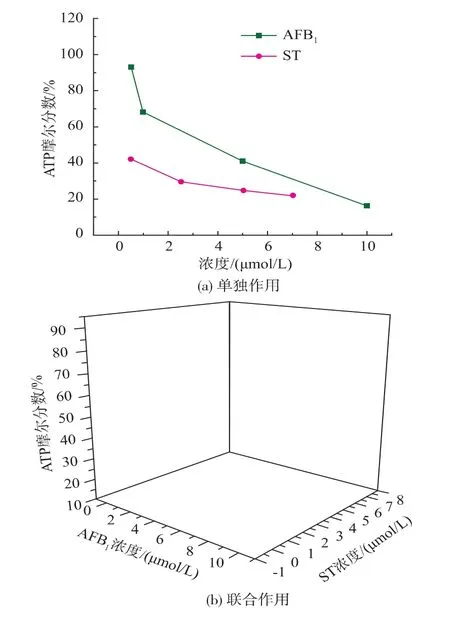
图3 AFB1和ST对HepG2细胞内ATP含量的影响(24 h)Fig.3 Effect of AFB1and ST on ATP content in HepG2 cells(24 h)
2.5 AFB1、ST单独作用及联合作用对HepG2细胞线粒体通透性的影响
罗丹明123在正常细胞中能够依赖线粒体跨膜电位进入线粒体基质,荧光强度减弱或消失。而在凋亡发生时,线粒体膜完整性破坏,线粒体膜通透性转运孔开放,引起线粒体跨膜电位(ΔΨm)的崩溃,罗丹明123重新释放出线粒体,发出强黄绿色荧光。通过荧光信号的强弱,检测线粒体膜电位的变化和凋亡的发生。如图4所示,细胞染毒48 h后,随着AFB1和ST浓度的增加,细胞内罗丹明123的含量有上升的趋势,但上升的程度并不明显,但从图4(b)可看出,AFB1和ST混合组中罗丹明123的含量增长率均明显高于单独作用组。
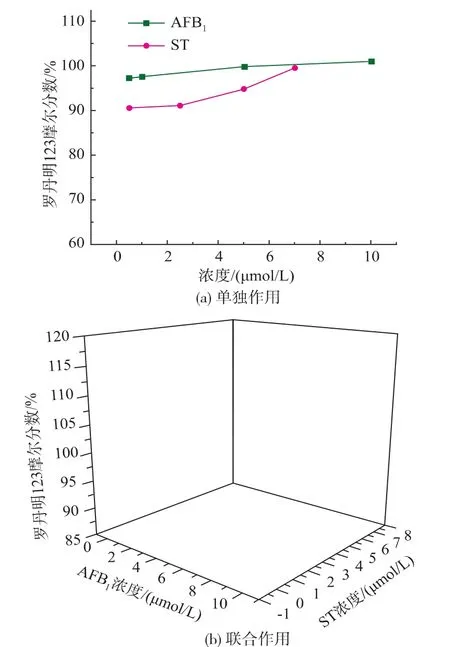
图4 AFB1和ST对HepG2细胞内线粒体膜通透性的影响(48 h)Fig.4 Effect of AFB1and ST on mitochondrial membrane permeability in HepG2 cells(48 h)
2.6 AFB1、ST单独作用及联合作用对HepG2细胞活性氧水平的影响
细胞中二氯荧光黄(DCF)的荧光强度反映细胞中活性氧的含量。染毒24 h后细胞中活性氧的产生并不明显,48 h时细胞活性氧含量的增加基本呈现毒素剂量相关性,如图5所示。
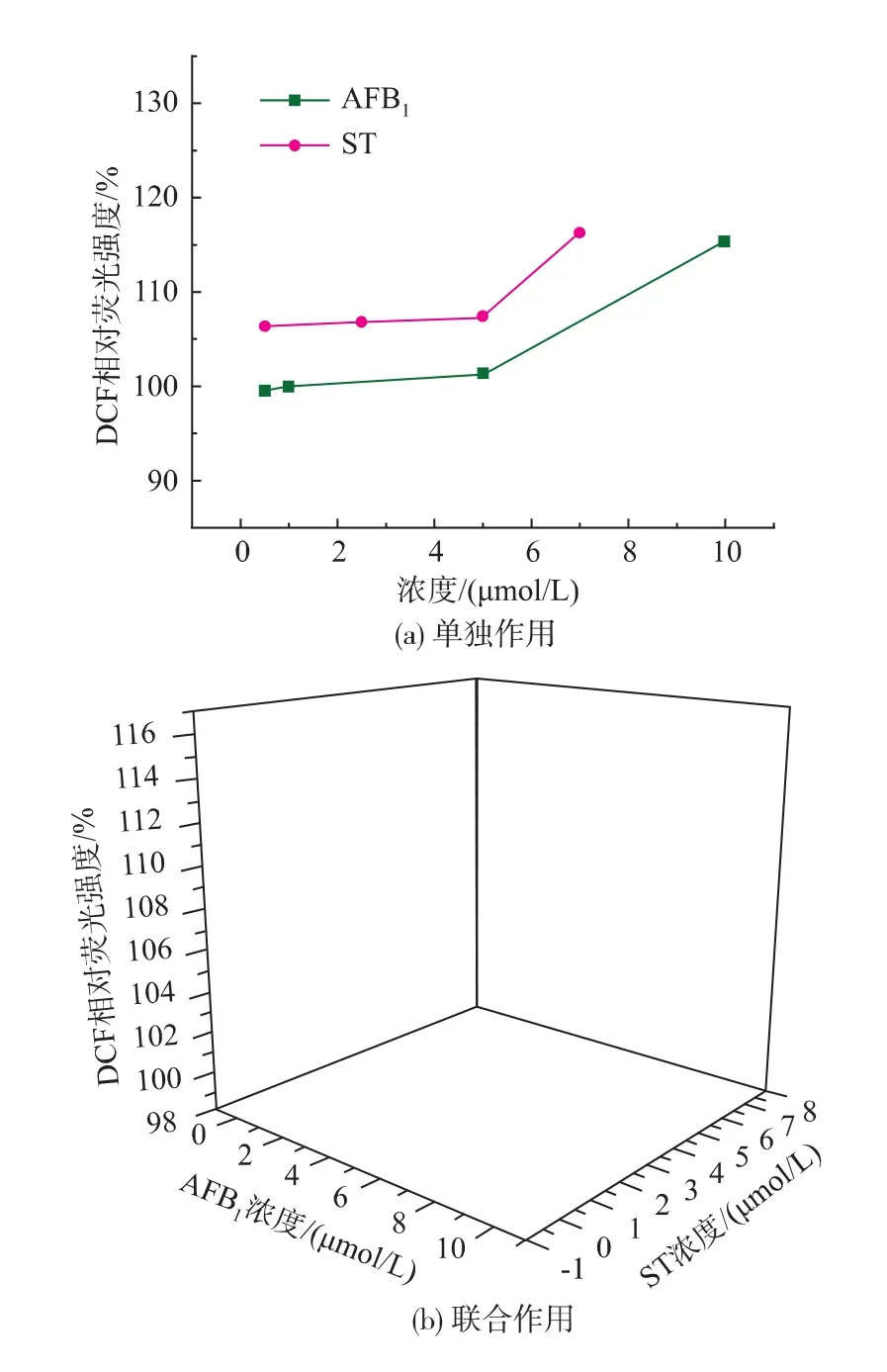
图5 AFB1和ST对HepG2细胞内活性氧含量的影响(48 h)Fig.5 Effect of AFB1and ST on reactive oxygen in HepG2 cells(48 h)
细胞染毒48 h后,与对照组(100%)相比,单独作用时AFB1浓度在0.5~10 μmol/L时,活性氧摩尔分数(相对物质的量)上升为99.50%~115.29%;ST浓度在0.5~7 μmol/L时,活性氧摩尔分数上升为106.28%~116.27%; 联合作用时,ST (5 μmol/L)+AFB1混合组中,AFB1浓度为1 μmol/L时的ROS的摩尔分数值为102%,同单独作用时AFB1浓度为5 μmol/L的ROS含量基本一致。通过拟合,AFB1和ST在单独作用和联合作用时均呈指数型下降,并且从图5(b)可以看出,AFB1+ST混合组的活性氧增加量均大于单独作用组,可以得出两种毒素混合后对HepG2细胞的毒性作用有所增强。
2.7 AFB1与ST混合物对HepG2细胞的联合毒性作用
5个毒性作用终点的测量值与预测值的显著性分析如表2所示,细胞增殖力、ATP含量、DNA含量、ROS含量及线粒体膜电位的测量值与预测值之间均无显著性差异,表明AFB1和ST对HepG2的联合毒性表现为加和作用。
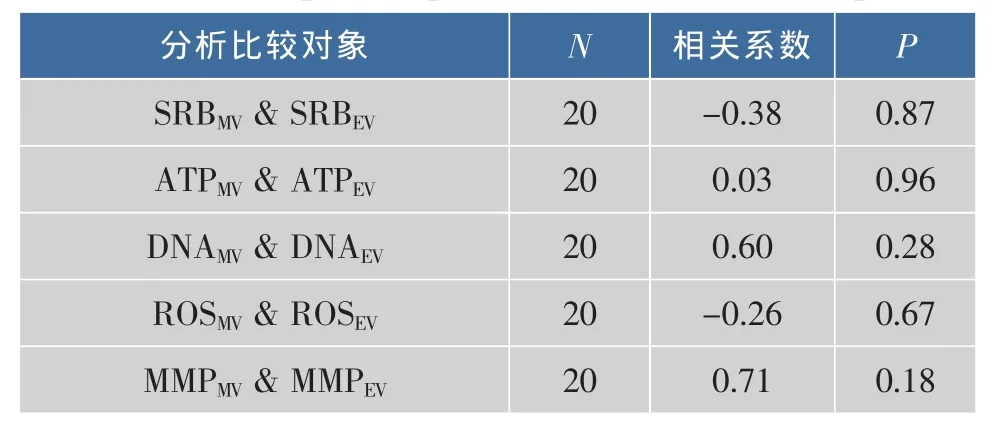
表2 成对样本T检验分析混合物的测量值及预测值差异性Table 2 Principal component analysis of five endpoints
2.8 AFB1和ST对HepG2细胞的5个作用终点的主成分分析
AFB1及ST对HepG2细胞48 h毒性作用的PCA分析如表3所示。
根据各个作用终点在2个成分中的系数,AFB1和ST对HepG2细胞的单独作用及联合作用终点均可分为3类:细胞增殖力;ATP含量、DNA含量;活性氧含量(ROS)和线粒体膜通透性(MMP)。根据主成分分析分类结果,ROS的产生与线粒体膜通透性的下降反映了两种毒素对细胞的同一损伤效应。因线粒体受损后产生活性氧,进一步对线粒体氧化损伤,故深入研究时,可根据分类结果选取每类中的一个指标进行毒素对细胞的毒性作用检测。
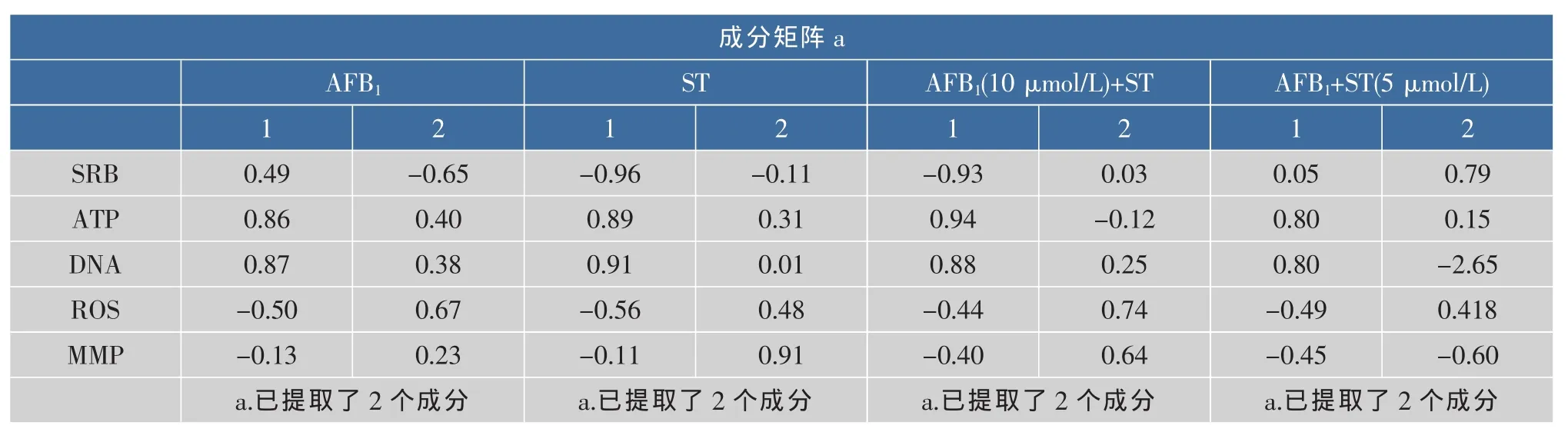
表3 AFB1及ST对HepG2毒性5个作用终点的主成分分析Table 3 Principal component analysis of five endpoints
3 讨论
首次得出杂色曲霉素ST在HepG2细胞中的IC50值;并且以HepG2细胞为对象,以5个毒性作用终点为依据,研究了AFB1和ST两种真菌毒素的联合作用类型,经分析推断其联合毒性作用类型为加和作用。本实验中5个毒性终点从不同方面检验了AFB1和ST对HepG2细胞的毒性。有研究发现,细胞受到毒素刺激后,细胞内线粒体膜电位的下降会伴随着ATP水平的下降,同时线粒体是活性氧产生的主要场所,又是活性氧作用最敏感的部位,活性氧会对线粒体造成氧化损伤,进而诱导细胞凋亡[11]。5个毒性作用终点的主成分分析得知,单独作用及联合作用均具有共同的主成分,推测可能由于黄曲霉毒素B1与杂色曲霉素对HepG2细胞的毒性作用位点基本一致,并且具有相似的信号代谢通路,使其联合作用的类型为加和作用。
4 结语
此次研究虽然仅从细胞水平对2种毒素的联合作用类型进行判断,但采用的多指标验证方法为多种真菌毒素联合作用的深入研究提供了参考。对于食品中真菌毒素的最大允许量,国家有明确的规定[12],但规定中没有提及两种以上的真菌毒素共同存在时的限量标准,所以当两种以上毒素共存时,其含量分别符合限量标准,但如果其联合加和或协同作用,则会对人体造成更大伤害。因此,通过研究食品中常见的真菌毒素共存时的联合作用,可为食品安全提供更准确的理论依据。
[1]Ruiz M J,Franzova P,Juan-Garcia A,et al.Toxicological interactions between the mycotoxins beauvericin,deoxynivalenol and T-2 toxin inCHO-K1 cells in vitro[J].Toxicon,2011,58:315-326.
[2]熊丽林,唐萌,王加生,等.微囊藻毒素和黄曲霉毒素及伏马菌素联合毒性[J].中国公共卫生,2006,22(5):548-549.XIONG Lilin,TANG Meng,WANG Jiasheng,et al.Combinative toxicity of microcystin,aflatoxin and fumonisin[J].China J Public Health,2006,22(5):548-549.(in Chinese)
[3]Sivakumar V,Thanislass J,Niranjali S,et al.Lipid peroxidation as a possible secondary mechanism of sterigmatocystin toxicity[J].Hum Exp Toxicol,2001,20(8):398-403.
[4]Noor F,Niklas J,Muller-Vieira U,et al.An integrated approach to improved toxicity prediction for the safety assessment during preclinical drug development using HepG2 cells[J].Toxicol Appl Pharmacol,2009,237(2):221-231.
[5]赵博,王中伟.细胞色素P450的研究进展[J].山东农业大学学报:自然科学版,2004,35(1):142-144.ZHAO Bo,WANG Zhongwei.New progress in studies on cytochrome 450[J].Journal of Shandong Agricultural University:Nature Science Edition,2004,35(1):142-144.(in Chinese)
[6]赵玉坤,杨晓临,王丹.细胞培养的基本条件[M].上海:上海科学技术出版社,2004:23-37.
[7]LIU Yitong,Thomas J Flynn.Effects of dietary phenolics and botanical extracts on hepatotoxicity-related endpoints in human and rat hepatoma cells and statistical models for prediction of hepatotoxicity[J].Food and Chemical Toxicology,2011,49:1820.
[8]吕品田,周坤,王亚珍,等.薏苡仁注射液(康莱特)联合顺铂对人肺腺癌细胞A549抑制作用及机制[J].中成药,2011,33(3):393-396.LUE Pintian,ZHOU Kun,WANG Yazhen,et al.Effect of Kanglaite Injection associated with Cisplatin in lung adno carcinoma cells A549[J].Chinese Traditional Patent Medicine,2011,33(3):393-396.(in Chinese)
[9]McKean C,Tang L.Comparative acute and combinative toxicity of aflatoxin B1 and fumonisin B1 in animals and human cells[J].Food and Chemical Toxicology,2006,44:868-876.
[10]Ficheux A S,Sibiril Y,Parent-Massin D.Co-exposure of Fusarium mycotoxins:In vitro myelotoxicity assessment on human hematopoietic progenitors[J].Toxicon,2012,60:1171-1179.
[11]Stefano Costa,Aneli Utan,Ester Speroni,et al.Carnosic acid from rosemary extracts:a potential chemoprotective agent against aflatoxin B1[J].Appl Toxicol,2007,27:152-159.
[12]中华人民共和国卫生部.GB 2761-2011,食品中真菌毒素限量[S].南京:凤凰出版社,2011.

