MMP-9与VEGF在成人肝血管瘤中的表达及其意义
王兆京,张丹丹,陈志伟,陈彻,姚学权,张峰,刘福坤
(1.江苏省中医院消化肿瘤外科,江苏南京 210029;2.江苏省省级机关医院呼吸科,江苏南京 210024;3.南京医科大学第一附属医院肝脏移植中心,江苏南京 210029)
肝血管瘤包括海绵状血管瘤、硬化性血管瘤、血管内皮细胞瘤和毛细血管瘤4种类型,临床以海绵状血管瘤最为多见。肝血管瘤尸检发现率为0.4%~7.3%[1],可发生于任何年龄段,女性多见,男女比例高达1∶5。肝血管瘤通常为单发,约10%的患者为多发血管瘤。大多数患者无症状,生长快、瘤体大的肝血管瘤常有右上腹疼痛、腹胀等症状[2],巨大肝血管瘤有时会并有自发性或创伤性破裂出血,甚至危及生命。
以往研究显示,各种促血管生成因子如基质金属蛋白酶-9(MMP-9)、血管内皮生长因子(VEGF)及其 受 体 (VEGFR1/FLT1、VEGFR2/KDR、VEGFR3/FLT4)在新生儿血管瘤的生长过程中发挥着重要作用,这些促血管生成因子在增生期表达显著上调,在消退期表达则明显降低[3-5]。而在成人肝血管瘤中这些促血管生成因子又发挥着什么样的作用尚待进一步研究。本实验通过收集成人肝血管瘤的临床标本,初步探讨了各种促血管生成因子在肝血管瘤中的表达,旨在为成人肝血管瘤的临床研究提供理论依据。
1 材料与方法
1.1 材料
1.1.1 标本来源 2010至2012年间共收集成人肝血管瘤标本30例,均来自肝血管瘤肝部分切除术患者;正常肝脏标本15例,均来自肝移植时供体修剪的剩余肝组织。以上标本的获取均取得伦理委员会的同意,所收集的肝血管瘤标本最终均为术后病理所证实。
1.1.2 试剂 Trizol试剂购自Invitrogen公司,实时反转录(RT)试剂盒、PCR分子质量标准物(DL500)购自TaKaRa公司,PCR预混反应体系购自Bioworld生物公司,UltraSensitiveTMS-P超敏试剂盒购自福州迈新生物技术有限公司,抗MMP-9多克隆抗体、抗VEGF多克隆抗体及辣根过氧化酶标记的抗兔二抗均购自Abcam公司,明胶购自Sigma公司,非变性蛋白上样缓冲液购自Beyotime公司。
1.2 方法
1.2.1 RT-PCR检测肝血管瘤中 MMP-9、VEGF、FLT1、KDR、FLT4的 mRNA表达 采用 RT-PCR法,MMP-9、VEGF、FLT1、KDR、FLT4 和 GAPDH 引物由Invitrogen公司合成。引物序列见表1。采用Trizol试剂提取总RNA,并检测RNA的浓度和纯度。取RNA 2μl,按照RT-PCR试剂盒进行RT反应获得cDNA,并置于 -20℃保存备用。检测 MMP-9、VEGF、FLT1、KDR、FLT4和GAPDH表达的反应体系共20μl,其中2倍PCR预混反应体系10μl,上游和下游引物各0.5μl,cDNA 1.5μl DEPC处理水7.5μl。PCR反应条件:94℃ 3 min;94℃变性30 s,59℃退火30 s,72℃延伸45 s,30个循环;最后72℃延伸10 min。PCR反应在Eppendorf PCR扩增仪中进行。PCR反应结束后,取出扩增产物8μl进行琼脂糖凝胶电泳检测。
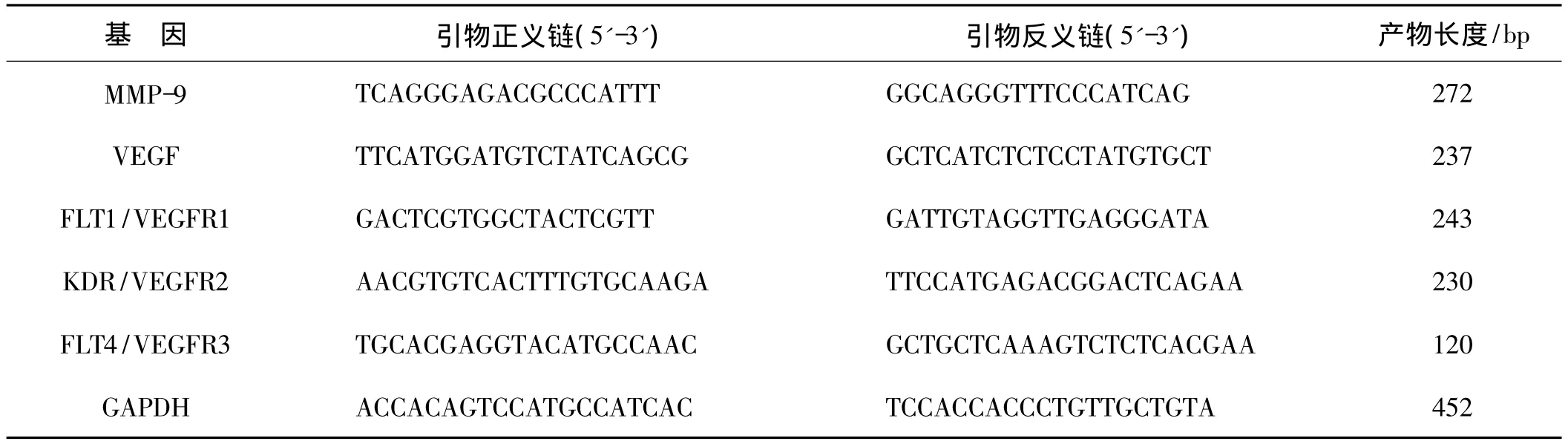
表1 RT-PCR的引物序列
1.2.2 免疫组化方法检测血管瘤组织中MMP-9和VEGF的表达 标本经10%中性甲醛固定、石蜡包埋,5μm厚连续切片,常规脱蜡、脱水,微波抗原修复,3%H2O2封闭内源性过氧化物酶,封闭液封闭30 min,然后分别滴加兔抗人MMP-9多克隆抗体(工作浓度1∶500)和兔抗人VEGF多克隆抗体(工作浓度1∶500),4℃孵育过夜。生物素化二抗严格按照UltraSensitiveTMS-P超敏试剂盒说明书进行。显微镜下控制DAB显色,苏木素复染,梯度乙醇脱水,二甲苯透明,中性树胶封片,镜检。阳性对照为肝细胞肝癌组织[6]。
1.2.3 蛋白质印迹法检测肝组织中MMP-9的表达取冻存肝血管瘤组织各50 mg分别进行裂解、匀浆、提取组织蛋白,测定蛋白浓度后加入适量蛋白上样缓冲液,100℃变性10 min,每个泳道以40μg蛋白量上样,以12%SDS-聚丙烯酰胺凝胶电泳后电转至PVDF膜,5%脱脂奶粉封闭2 h,加入兔抗人MMP-9多克隆抗体(1∶1 500),4℃孵育过夜,TBST洗 4次,每次5 min,然后加入辣根过氧化酶标记的抗兔二抗(1∶2 500),37℃孵育1 h,TBST洗4次,每次5 min,然后ECL显色,压片曝光。
1.2.4 明胶酶谱法检测肝血管瘤组织中MMP-9和pro-MMP9的活性变化 -70℃保存的肝血管瘤组织标本放入冰盒中的玻璃匀浆器内,加入缓冲液进行匀浆提取(缓冲液为 50 mmol·L-1Tris-HCl,pH 7.3,100 mmol·L-1NaCl,1%Triton-100,0.05%Brij-35),4 ℃离心(12 000 r·min-1,10 min),留取上清提取物。将提取的组织匀浆液中加入适量5倍非变性电泳缓冲液于含有0.1%明胶底物的10%SDS-聚丙烯酰胺凝胶上电泳2 h,用2.5%Triton-100室温洗涤2次,每次30 min,然后转移至底物消化缓冲液中(10 mmol·L-1Tris-Base,40 mmol· L-1Tris-Cl,0.2 mol·L-1NaCl,5 mmol·L-1CaCl2,0.02%Brij-35,pH 7.6),37 ℃孵育 24 h,0.25% 考马斯亮蓝染色30 min,洗脱液内脱色,直至出现清晰的消化条带。电泳结果进行拍照分析。
1.3 统计学处理
采用SPSS13.0软件进行统计学分析。数据以均数±标准差表示,两样本均数的比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 肝血管瘤中 MMP-9、VEGF、FLT1、KDR、FLT4的mRNA表达
RT-PCR检测成人肝血管瘤患者和正常人两组间MMP-9、VEGF、FLT1、KDR、FLT4 的 mRNA 表达,结果显示,肝血管瘤中MMP-9 mRNA的表达量明显升高,而正常组表达较低,差异有统计学意义(P<0.05)。但测定VEGF、FLT1、KDR、FLT4的mRNA表达未发现明显差异(图1)。
2.2 免疫组化法检测血管瘤组织中MMP-9和VEGF的表达
免疫组化法检测发现,MMP-9在血管瘤中的阳性表达率为90%(27/30),而在正常组织中阳性表达率为13.3%(2/15)。而且MMP-9的蛋白阳性表达主要位于血管瘤的间质细胞和内皮细胞中(图2)。同时我们也检测了VEGF在两组中的表达,结果发现VEGF在两者中表达均较低,未发现明显差异(数据文章中未列出)。
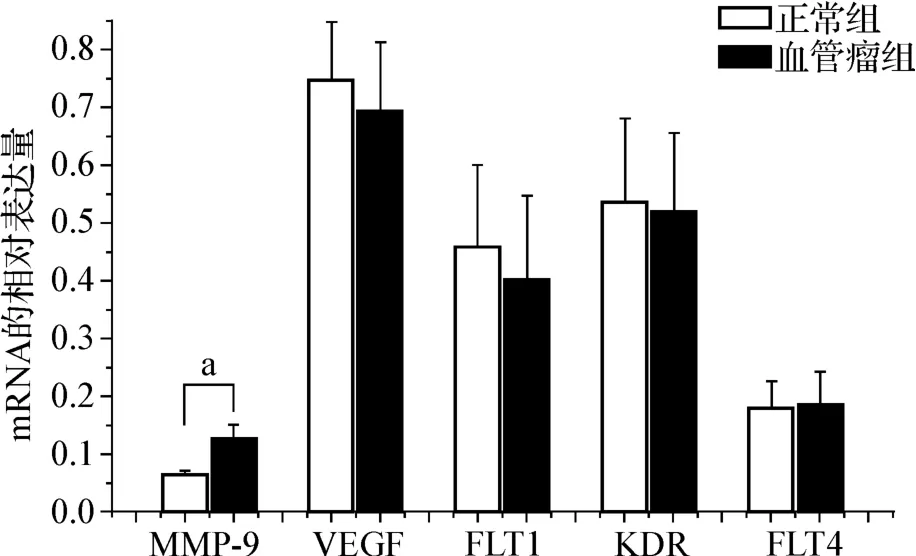
图1 MMP-9、VEGF、FLT1、KDR 和 FLT4在成人肝血管瘤中的mRNA表达 (a P<0.05)
2.3 血管瘤组织中MMP-9的蛋白表达及其活性变化
MMP-9的蛋白表达与MMP-9 mRNA的表达基本一致。在正常肝组织中MMP-9的表达很少,膜上的显色条带很浅,肉眼几乎不能辨认,通过计算机成像分析才能检测到。但在血管瘤组织中MMP-9的表达明显增强(图3),两者比较,差异有统计学意义(P<0.05)。此外,明胶酶谱法检测发现肝血管瘤组织中MMP-9和pro-MMP9的活性较正常肝组织明显增强。从上到下观察得到的蓝色背景凝胶块,可以清楚地看到两条带,与分子质量标准物对照,其分子质量分别约在92 kD和82 kD,结果可见明显差异(图3)。
3 讨 论
虽然肝血管瘤是一种常见肝疾病,但是其确切的病理发生机制至今尚不清楚。一般认为血管瘤是一种异常的血管增生,血管调节因子在其中发挥了重要作用[7-8]。MMP-9与VEGF是重要的促血管生成因子,它们在血管内皮细胞增殖及新生血管形成中发挥着重要作用。以往的研究发现,新生儿血管瘤在增生期MMP-9和VEGF的表达显著增高,而在消退期其表达显著下调[3]。但成人肝血管瘤的生长特征与新生儿血管瘤完全不同。新生儿血管瘤通常在其出生后的数周内出现,它的生长分为增生期、消退期和消退后期3期。增生期血管瘤生长迅速,持续时间可长达12个月,紧接着进入消退期,此时血管瘤的生长开始减慢,持续时间5~7年,最终进入消退后期,此时血管瘤的生长几乎完全停止[3,9]。约有50%的患者瘤体在5岁时可完全消退。而成人肝血管瘤多见于40~50岁成人,它的生长则表现为持续性、缓慢性,其生长特点与新生儿血管瘤完全不同。这表明在成人肝血管瘤的生长过程中可能存在着与新生儿血管瘤不同的病理发生机制。在本实验中,我们检测到在成人肝血管瘤中MMP-9的mRNA、蛋白表达及其活性明显高于正常组织。而测定 VEGF及其受体 FLT1、KDR、FLT4的mRNA、蛋白表达未发现明显差异。
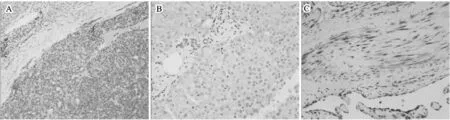
图2 MMP-9在成人肝血肝瘤中的表达及分布 ×200 A为肝细胞肝癌做阳性对照;B为正常肝组织;C为成人肝血管瘤组织
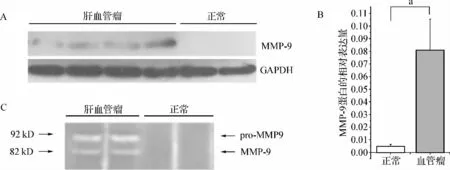
图3 MMP-9在成人肝血肝瘤中的蛋白表达及其活性变化 A、B为蛋白质印迹法检测的蛋白表达;C为明胶酶谱法测定的MMP-9和pro-MMP9的活性变化(a P<0.05)
血管瘤的生长依赖于新生血管的形成[10]。在新生血管生成过程中,血管内皮细胞主要以生芽方式生长,这一过程要经过细胞外基质的降解、细胞分裂、迁移并侵入细胞外基质,才能形成毛细血管样结构[11]。而细胞外基质的降解是血管生成的关键一步[12]。MMP-9是92 kD的明胶酶B,能有效地降解基底膜和细胞外基质,在此过程中,MMP-9还可以诱导血管内皮细胞迁移和血管的塑形,并促进新生血管的生成[13-14]。本研究证实成人肝血管瘤组织中MMP-9的蛋白表达及其活性均明显增高,因此MMP-9在血管瘤组织中高表达可能与血管瘤中基质降解重塑及内皮细胞迁移和管状结构形成密切相关,可能是成人肝血管瘤持续生长的原因,如能阻断MMP-9的作用,有望能抑制肝血管瘤的增生。
[1]HERMAN P,COSTA M L,MACHADO M A,et al.Management of hepatic hemangiomas:a 14-year experience[J].J Gastrointest Surg,2005,9(6):853-859.
[2]GIULIANTE F,ARDITO F,VELLONE M,et al.Reappraisal of surgical indications and approach for liver hemangioma:single-center experience on 74 patients[J].Am J Surg,2011,201(6):741-748.
[3]KLEINMAN M E,GREIVES M R,CHURGIN S S,et al.Hypoxia-induced mediators of stem/progenitor cell trafficking are increased in children with hemangioma[J].Arterioscler Thromb Vasc Biol,2007,27(12):2664-2670.
[4]STORCH C,HOEGER P.Propranolol for infantile haemangiomas:insights into the molecular mechanisms of action[J].Br J Dermatol,2010,163(2):269-274.
[5]PRZEWRATIL P,SITKIEWICZ A,WYKA K,et al.Serum levels of vascular endothelial growth factor and basic fibroblastic growth factor in children with hemangiomas and vascular malformations--preliminary report[J].Pediatr Dermatol,2009,26(4):399-404.
[6]程桂丹,陆枫林.肝癌中基质金属蛋白酶及其抑制因子的研究进展[J].东南大学学报:医学版,2010,29(2):215-220.
[7]MAHAJAN D,MILLER C,HIROSE K,et al.Incidental reduction in the size of liver hemangioma following use of VEGF inhibitor bevacizumab[J].J Hepatol,2008,49(5):867-870.
[8]ZHANG WJ,YE L Y,WU L Q,et al.Morphologic,phenotypic and functional characteristics of endothelial cells derived from human hepatic cavernous hemangioma[J].J Vasc Res,2006,43(6):522-532.
[9]ITINTEANG T,BRASCH H D,TAN S T,et al.Expression of components of the renin-angiotensin system in proliferating infantile haemangioma may account for the propranolol-induced accelerated involution[J].J Plast Reconstr Aesthet Surg,2011,64(6):759-765.
[10]BREM H,GRESSER I,GROSFELD J,et al.The combination of antiangiogenic agents to inhibit primary tumor growth and metastasis[J].J Pediatr Surg,1993,28(10):1253-1257.
[11]LI A,DUBEY S,VARNEY M L,et al.IL-8 directly enhanced endothelial cell survival,proliferation,and matrix metalloproteinases production and regulated angiogenesis[J].J Immunol,2003,170(6):3369-3376.
[12]CAVALLO-MEDVED D,RUDY D,BLUM G,et al.Live-cell imaging demonstrates extracellular matrix degradation in association with active cathepsin B in caveolae of endothelial cells during tube formation[J].Exp Cell Res,2009,315(7):1234-1246.
[13]NEWBY A C.Matrix metalloproteinases regulate migration,proliferation,and death of vascular smooth muscle cells by degrading matrix and non-matrix substrates[J].Cardiovasc Res,2006,69(3):614-624.
[14]HUANG PH,CHEN Y H,WANG CH,et al.Matrix metalloproteinase-9 is essential for ischemia-induced neovascularization by modulating bone marrow-derived endothelial progenitor cells[J].Arterioscler Thromb Vasc Biol,2009,29(8):1179-1184.

