醋浸渍对蚕豆抗氧化能力和植酸含量的影响
刘春菊, 朱丹宇, 李大婧, 吴海虹, 刘春泉
(1.江苏省农业科学院农产品加工研究所,江苏 南京210014;2.南京市(明天)农产品加工工程技术研究中心,江苏 南京210014;3.国家蔬菜加工技术研发专业分中心,江苏 南京210014)
醋豆为中国传统食品,是以整豆粒为原料,经食醋浸渍而成的一种保健食品。醋豆汇集了豆类和食醋两者的营养和保健功效,浸渍后的醋豆还原能力、1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除能力和羟自由基清除能力均大于浸渍醋和大豆,具有降血压、降低胆固醇和甘油三酯,对脑血栓、糖尿病、肥胖症等有辅助治疗作用,同时还可使豆中原有的抗营养因子如胰蛋白酶抑制剂、凝血素等失去活性[1],提高豆类的吸收率,扩大其使用途径。
醋浸渍对豆类的营养和功能成分变化已有相关报道,刘曼西等[2]发现醋浸渍导致大豆粗蛋白质、可溶性蛋白质和总氨基酸含量降低,可溶性糖、还原糖、低分子质量肽和粗蛋白质中的氨基酸总量显著增加;韩涛等[1]发现生豆和熟豆在醋浸渍过程中游离氨基酸含量逐渐增加,分别浸渍48 h 和10 h 后趋于恒定;陈芬等[3]分析发现醋浸渍促使大豆中饱和脂肪酸和单不饱和脂肪酸的相对含量下降,多不饱和脂肪酸相对含量显著升高。蚕豆是一种高蛋白质、低脂肪的豆类蔬菜,味道鲜美,营养丰富,富含多种维生素、氨基酸和矿物元素,还含多种有益生物活性物质,包括多酚、黄酮、活性蛋白质、香豆素、生物碱等[4-5]。现有的醋豆营养与功能研究主要是针对大豆来开展的,而在醋浸渍蚕豆方面还未见研究报道。本试验以鲜蚕豆、热处理鲜蚕豆、干蚕豆和热处理干蚕豆为材料,研究醋浸渍处理对维生素C 含量、总酚含量、总黄酮含量、DPPH 自由基清除率、总抗氧化能力和植酸含量的影响,以期为药食两用醋蚕豆营养和功能性研究提供理论依据。
1 材料与方法
1.1 材料与试剂
供试鲜蚕豆和干蚕豆,品种为通蚕鲜6 号,购于江苏省明天农牧科技有限公司南京六合农产品加工中心;酿造白醋购于苏果超市。1,1-二苯基-2-三硝基苯肼(DPPH)、2,4,6-三吡啶基-S-三嗪(TPTZ)、植酸钠标准品购自sigma 公司;芦丁标准品、没食子酸标准品购于中国药品生物制品检定所;其他试剂均为分析纯。
1.2 仪器与设备
TU-1810 紫外可见分光光度计,北京普析通用仪器有限责任公司产品;TG16-WS 台式高速离心机,湖南长沙湘仪离心机仪器有限公司产品;KQ-250DB 型台式数控超声波清洗器,昆山市超声仪器有限公司产品。
1.3 试验处理
1.3.1 蚕豆样品的准备 鲜蚕豆采收后及时去荚剥粒,用清水清洗蚕豆粒,得到鲜蚕豆样品;将鲜蚕豆在沸水中加热3 min,用清水冷却至室温,沥干水分即得到热处理鲜蚕豆样品;将干蚕豆放入清水中浸泡12 h,即得到干蚕豆样品;将浸泡好的干蚕豆在沸水中加热3 min,用清水冷却至室温,沥干水分即得到热处理干蚕豆样品。
1.3.2 醋浸渍处理过程 将准备好的4 种蚕豆样品分别装入玻璃罐中,装入量不要超过玻璃罐容积的三分之二,然后加入酿造米醋,浸没过最顶层蚕豆粒3 ~4 cm,将玻璃罐密封,置于25 ℃恒温箱中,在浸渍1 d、4 d、7 d、10 d、14 d 分别取蚕豆样品进行指标分析。
1.4 测定方法
1.4.1 维生素C 含量的测定 维生素C 含量按照GB/T 6195-1986[6]方法测定,醋浸渍后的蚕豆样品用清水冲洗表面醋液,用滤纸擦干水分,直接取样采用2,6-二氯靛酚滴定法进行维生素C 含量测定。
1.4.2 总酚、总黄酮、DPPH 自由基清除率和总抗氧化能力的测定 总酚含量按照Folin-Ciocalteau
法[7]测定,将清洗擦干的蚕豆样品打浆,取5 g 定容于50 ml 60%乙醇溶液,80Hz 超声提取1 h,9 000g离心15 min,取上清液用于总酚、总黄酮、DPPH 自由基清除率和总抗氧化能力测定;总黄酮含量采用比色法[8]测定;DPPH 自由基清除率按照参考文献[9]方法测定;总抗氧化能力采用FRAP 方法[10]测定。
1.4.3 植酸含量的测定 植酸含量测定采用分光光度法[11],取打浆蚕豆样品加入0.01 mol/L HCl 溶液10 ml,80 Hz 超声提取30 min,定容至25 ml,6 000g离心30 min,取上清液用于植酸含量测定。
1.5 数据分析
采用SPSS Statistics17.0 软件和Excel 2010 软件进行数据处理和分析。
2 结果与分析
2.1 醋浸渍对蚕豆维生素C 含量的影响
醋浸对4 种蚕豆样品维生素C 的影响如图1 所示,热处理均可使鲜蚕豆和干蚕豆维生素C 含量明显减少,而与干蚕豆相比,鲜蚕豆中维生素C 含量较高,经过热处理后维生素C 保存率较高。醋浸1 d,鲜蚕豆和热处理鲜蚕豆中维生素C 含量反而增加,随着醋浸泡时间的增加,鲜蚕豆和热处理鲜蚕豆维生素C 含量逐渐减少,与浸泡时间呈线性负相关(鲜蚕豆R2= 0.81,回归方程为Y= - 2.02x+13.26;热处理鲜蚕豆R2=0.90,回归方程为Y= -1.42x+9.06)。这可能是由于酸促使蚕豆中的D-葡萄糖醛酸生成L-古洛糖酸,在L-古洛糖酸内酯氧化酶的作用下进一步生成维生素C[12]。随着醋浸渍时间延长,维生素C 发生氧化分解。干蚕豆和热处理干蚕豆在醋浸渍1 d 时维生素C 含量显著降低,到了第4 d 均检测不出。蚕豆在醋浸渍过程中维生素C 含量逐渐降低与Serpil 等[13]报道一致,醋浸渍绿辣椒21 d内维生素C 含量快速减少,随之趋于稳定。大蒜在醋浸渍过程中维生素C 损失较大[14]。
2.2 醋浸渍对蚕豆总酚含量的影响
醋浸对蚕豆中总酚含量有一定的影响(图2)。鲜蚕豆经过醋浸后总酚含量显著增加(P<0.05),醋浸渍14 d 时总酚含量增加了69.49%,热处理鲜蚕豆随着醋浸时间的增加,总酚含量也逐渐增加,但增加幅度不及鲜蚕豆,仅增加了35.32%。醋浸鲜蚕豆的总酚含量明显高于干蚕豆和热处理蚕豆样品(P<0.05),这可能是由于在醋浸渍过程中蚕豆籽粒体内的蛋白质、脂肪和淀粉不断酶解,释放出小分子物质,部分物质转化为酚类物质,使得总酚含量逐渐增加[15]。未经醋浸渍干蚕豆中的总酚含量明显高于鲜蚕豆,热处理会导致鲜蚕豆和干蚕豆中的总酚含量显著降低。经过醋浸渍,干蚕豆和热处理干蚕豆的总酚含量逐渐降低,在醋浸渍4 d 时基本趋于稳定,差异不显著。该结果与Seok 等的报道一致,经过醋浸渍14 d 黑豆种子中的总酚含量显著低于未浸渍黑豆种子[16]。
2.3 醋浸渍对蚕豆总黄酮含量的影响
图3 所示,随着醋浸渍时间的延长,鲜蚕豆和热处理鲜蚕豆样品总黄酮含量呈先增加后降低的趋势;干蚕豆和热处理干蚕豆中的总黄酮含量则先降低后增加。但不论鲜蚕豆还是干蚕豆经过热处理,样品中的总黄酮含量均显著下降,降幅达40.00%以上,造成黄酮物质的大量损失,主要是由于在热处理过程中黄酮类物质会溶解于热水中[17]。
已有一些学者报道了醋浸渍会促使豆类样品中黄酮物质增加。随着醋浸渍时间的增加,发芽大豆和未发芽大豆中的总黄酮含量均逐渐升高[18-19]。不同品种的大豆在醋浸过程中均呈现黄酮物质增加现象[20]。发酵过程中也会使得大豆黄酮物质含量增加[17,21]。同时,醋浸会使得大豆样品黄酮物质发生变化,黄酮苷元大量增加[2,22]。黄酮物质在醋浸渍过程中的变化,可能是由于醋浸渍激活了大豆内源β-糖苷酶,β-糖苷酶在温度10 ~50 ℃、pH 值3.5 ~7.0 条件下可以水解糖苷配基上的葡萄糖部分,生成黄酮苷元。醋浸渍提供了β-糖苷酶适宜的pH 值水平,渗透破坏大豆细胞,使得β-糖苷酶溶出,增加酶与底物的接触,促使黄酮物质的生成[17]。
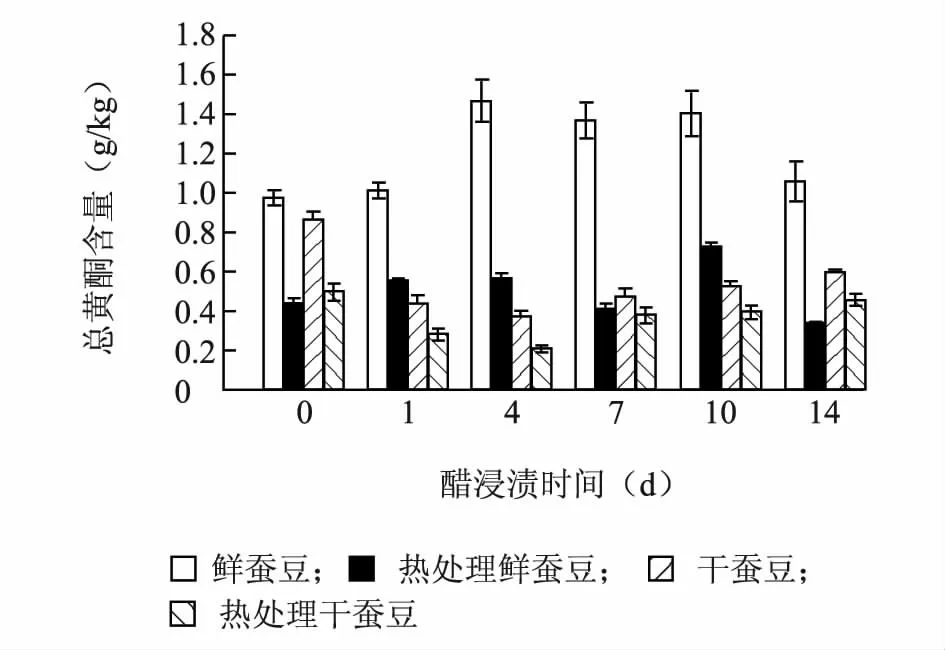
图3 醋浸渍对蚕豆总黄酮含量的影响Fig.3 Effect of vinegar pickling on total flavonoid contents of faba bean
2.4 醋浸渍对蚕豆DPPH 自由基清除率的影响
鲜蚕豆和热处理鲜蚕豆的DPPH 自由基清除率明显高于干蚕豆和热处理干蚕豆,热处理对蚕豆清除DPPH 自由基能力没有太大影响(图4)。醋浸渍可提高蚕豆清除DPPH 自由基的能力,不论是鲜蚕豆、干蚕豆还是热处理蚕豆样品,醋浸渍1 d 后蚕豆样品的DPPH 自由基清除率由原来的45.51% ~67.25%增加至90.00%以上,随着醋浸渍时间的增加,清除DPPH 自由基能力变化差异不显著(P<0.05)。
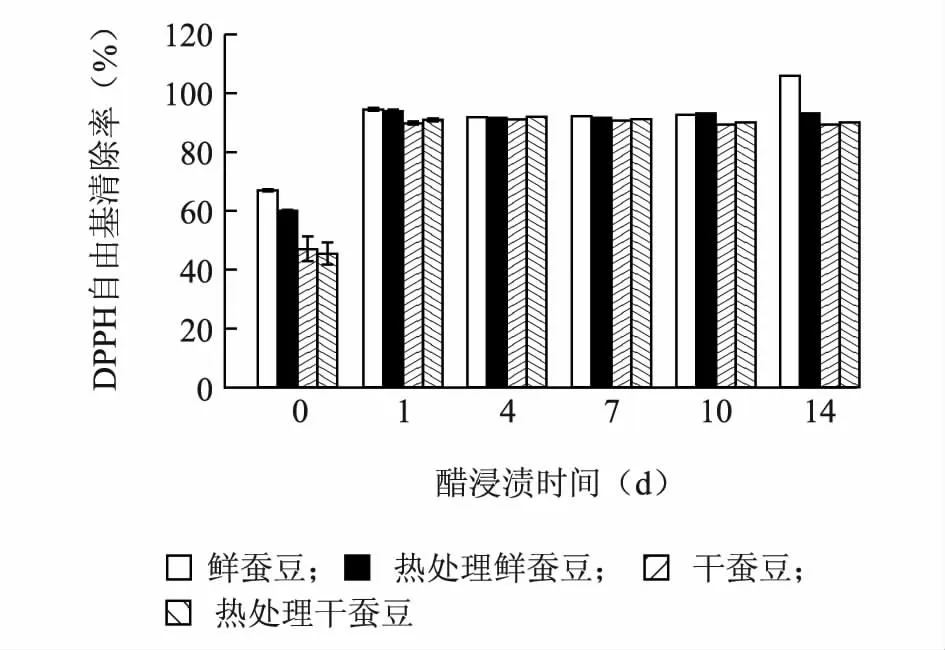
图4 醋浸渍对蚕豆DPPH 自由基清除率的影响Fig.4 Effect of vinegar pickling on DPPH radical scavenging activities of faba bean
2.5 醋浸渍对蚕豆总抗氧化活性的影响
醋浸渍对蚕豆样品总抗氧化活性的影响如图5所示,鲜蚕豆和热处理鲜蚕豆随着醋浸渍时间增加,总抗氧化能力先增加后降低,醋浸渍第4 d 时总抗氧化能力比未浸醋增加了170.00%以上,到了第14 d 略有下降。干蚕豆和热处理干蚕豆在醋浸渍过程中总抗氧化能力先减少后增加。这与蚕豆样品在醋浸渍过程中黄酮含量变化趋势基本一致。热处理会造成鲜蚕豆和干蚕豆的抗氧化能力减弱,而鲜蚕豆和热处理鲜蚕豆醋浸渍后总抗氧化能力均比干蚕豆和热处理干蚕豆高。醋蚕豆中的抗氧化活性主要由醋、总酚和总黄酮的抗氧化活性决定的。食醋具有较强的抗氧化能力[23]。醋浸渍促使大豆抗氧化物质含量增加,抗氧化活性提升[24]。Qin 等发现大豆发酵过程中会造成酚类物质和黄酮类物质含量显著增加,表现出高抗氧化活性[25]。Seo 等分别用水溶液和醇溶液提取醋豆,2 种溶液提取物中均具有较强的抗氧化活性,醇溶液比水溶液略高一些[26]。

图5 醋浸渍对蚕豆总抗氧化能力的影响Fig.5 Effect of vinegar pickling on total antioxidant activities of faba bean
2.6 醋浸渍对蚕豆植酸含量的影响
干蚕豆中植酸含量是鲜蚕豆的2 倍,热处理会引起鲜蚕豆和干蚕豆植酸含量下降,降幅达到16.90%和18.10%。与未浸醋处理相比,醋浸渍1 d 的鲜蚕豆和干蚕豆的植酸含量大量减少,分别降低了41.70%和70.40%,继续醋浸渍其植酸含量变化不显著(P<0.05);醋浸渍1 d 的热处理鲜蚕豆和热处理干蚕豆植酸含量分别下降了76.00% 和79.60%(图6)。热处理会提高醋对蚕豆中植酸的溶解率,这可能是热处理增加了蚕豆细胞的通透性,促使在醋浸过程中植酸从蚕豆细胞中的溶解量大大增加,从而醋浸渍使热处理蚕豆样品中含有较低的植酸。
植酸是豆类中有机磷的主要存在形式,具有极强的螯合能力,在肠胃中能牢固地粘合钙、镁、铁等金属离子,形成难溶性的植酸盐络合物,与蛋白质、维生素等形成不溶性复合物,降低微量元素和蛋白质的利用率及消化率[27-28]。目前人们发现采用加工处理可以降低产品中的植酸含量,Vellingiri 等和Hagir 等发现浸泡、蒸煮和油炸处理方式都会减少豆类中植酸含量[29-30],Gertrud 等发现高压处理会降低豌豆和大豆中植酸含量,而蒸煮会造成植酸的大量下降[31]。本试验中采用醋浸渍方式是一种冷加工处理,可明显降低蚕豆中植酸含量,且避免了其他营养成分的损失。

图6 醋浸渍对蚕豆植酸含量的影响Fig.6 Effect of vinegar pickling on phytic acid contents of faba bean
3 结论
随着醋浸泡时间的延长,鲜蚕豆和热处理鲜蚕豆维生素C 含量逐渐减少,干蚕豆和热处理干蚕豆在醋浸渍1 d 后维生素C 含量显著降低,到了第4 d已经检测不到。醋浸渍后,鲜蚕豆和热处理鲜蚕豆总酚含量增加,干蚕豆和热处理干蚕豆的总酚和黄酮含量均下降。鲜蚕豆的DPPH 自由基清除能力明显高于干蚕豆,醋浸渍1 d 后,鲜蚕豆、干蚕豆和热处理蚕豆样品的DPPH 自由基清除率均可达到90.00%以上,继续浸渍DPPH 自由基清除率没有显著变化。随着醋浸渍时间增加,鲜蚕豆和热处理鲜蚕豆总抗氧化能力先增加后降低,干蚕豆和热处理干蚕豆的总抗氧化能力先减少后增加,这与黄酮含量的变化趋势一致。干蚕豆中植酸含量较高,是鲜蚕豆的2 倍,醋浸渍1 d 干蚕豆和鲜蚕豆植酸含量分别降低了41.70%和70.40%,但随着浸渍时间的延长植酸含量并未有显著变化。综上所述,以鲜蚕豆为醋浸渍原料,可以较好地保留其营养成分,提高其清除自由基能力和总抗氧化能力,而且与干蚕豆相比,鲜蚕豆生育期短,农田复种指数和种植业经济效益较高。
[1] 韩 涛,李丽萍,张玉白,等.醋豆加工过程中物质含量的变化及醋豆产品的感官评价[J].食品与发酵工业,2001,27(6):39-44.
[2] 刘曼西,陈 芬.醋浸后大豆成分的变化及其营养学意义[J].食品与发酵工业,2004,30(2):66-71.
[3] 陈 芬,李 莉,陈鸣丽,等.醋豆与大豆中脂肪酸含量的比较及营养学意义[J].生物技术,2008,18(1):73-75.
[4] 李雪琴,苗笑亮,裘爱泳.蚕豆蛋白的提取分离及相对分子质量的测定[J].无锡轻工大学学报,2003,22(6):71-74.
[5] 李雪琴,裘爱泳.蚕豆中的生物活性成分研究进展[J].粮食与油脂,2002(7):34-35.
[6] GB/T 6195-1986 水果、蔬菜维生素C 含量测定法(2,6-二氯靛酚滴定法)[S].
[7] 弓志青,刘春泉,李大婧.不同品种板栗贮藏过程中总酚与抗氧化活性研究[J].中国食品学报,2011,11(1):45-50.
[8] 孙丽萍,田文礼,朱晓丽.蜂花粉总黄酮检测方法的研究[J].食品科学,2007,28(1):262-265.
[9] 崔 莉,刘春泉,李大婧,等.发酵莴苣茎叶功能活性研究[J].核农学报,2011,25(3):523-528.
[10] 李利敏,沈建福,吴晓琴.8 种油茶蒲提取物中活性物质含量及其抗氧化能力的比较研究[J].中国粮油学报,2013,28(1):41-47.
[11] 余 安,王承明.超声辅助提取花生粕中植酸工艺优化[J].食品科学,2010,31(10):179-183.
[12] 王镜岩,朱圣庚,徐长发.生物化学[M].北京:高等教育出版社,2002:461.
[13] SERPIL Y,YU O.Effects of preparation procedures on ascorbic acid retention in pickled hot peppers[J].International Journal of Food Sciences and Nutrition,2003,54(4):291-296.
[14] 赵晓丹,胡小松.醋浸对大蒜主要营养成分含量及分布的影响[J].食品科技,2008,33(12):89-91.
[15] 郭 鸰,姜淑娟,贾振宝,等.大豆发芽过程中抗氧化活性研究[J].食品工业科技,2008,29(5):262-264.
[16] SEOK J K,SHIN J Y,CHO M H,et al.Antioxidant activity and isoflavone profile of rhynchosia nolubilis seeds pickled in vinegar[J].Food Sci Biotechnol,2007,16(3):444-450.
[17] KYE M C,JIN H L,HAN D Y,et al.Changes of phytochemical constituents (isoflavones,flavanols,and phenolic acids)during cheonggukjang soybeans fermentation[J].Journal of Food Composition and Analysis,2011(24):402-410.
[18] EOM K Y,KIM J S,CHOI H S,et al.Changes in isoflavone and some characteristics of choking of germinated soybeans during pickling in vinegar[J].J Korean Soc Food Sci Nutr,2006,35(3):359-365.
[19] HANJ S,HONG H D,KIM S R.Changes in isoflavone content and mass balance during soybean processing[J].Food Sci Biotechnol,2007,16(3):426-433.
[20] KIM J S,KIM H D,KIM S R.Changes of isoflavone contents in soybean ciltivars pickled in persimmon vinegar[J].Korean J Food Sci Technol,2004,36(5):833-836.
[21] CHUNG H L,LIN Y,JIN Z X,et al.Relative antioxidant activity of soybean isoflavones and their glycosides[J].Food Chemistry,2005(90):735-741.
[22] 陈 芬,万国华,徐国海.醋浸后大豆异黄酮的变化及其营养学意义[J].湖北职业技术学院学报,2005,8(4):71-73.
[23] 张 盛,景 浩.食醋中主要抗氧化成分的分析研究[J].农产品加工,2012(2):75-78.
[24] BANG H P,CHOI O K,CHO G S,et al.The change of compasitions and antioxidant effect in soybean cultivars pickled in persimmon vinegar[J].Korean J Food and Nutr,2006,19(4):398-409.
[25] QIN Y,JIN X N,PARK H D.Comparison of antioxidant activities in black soybean preparations fermented with various microorganisms[J].Agricultural Sciences in China,2010,9(7):1065-1071.
[26] SEO J H,JEONG Y J.Comparison of functional properties of black soybean pickled in vinegar[J].J Korean Soc Food Sci Nutr,2011,40(2):171-176.
[27] 吴新民,丁巧丽.豆粕中抗营养因子及抗营养机理的研究进展[J].浙江畜牧兽医,2004(4):14-16.
[28] 吴 非,李红梅.生物法失活豆乳中抗营养因子的研究[J].食品工业科技,2008,29(7):65-68.
[29] VELLINGIRI V,HANS K B.Effect of certain indigenous processing methods on the bioactive compounds of ten different wild type legume grains[J].J Food Sci Technol,2012,49(6):673-684.
[30] HAGIR B E,SAMIA M A,WISAL H I,et al.Content of antinutritional factors and HCl-extractability of minerals from white bean(Phaseolus vulgaris)cultivars,influence of soaking andor cooking[J].Food Chemistry,2007(100):362-368.
[31] GERTRUD L M,KARIN W,THAO P T P,et al.High hydrostatic pressure influences antinutritional factors andin vitroprotein digestibility of split peas and whole white beans[J].LWT-Food Science and Technology,2013(51):331-336.

