肥大细胞在实验性末端回肠炎发病中的变化及其意义
王 为,周国华,匡卫国,黄 毅,冷明芳,唐齐林
(解放军第一六九医院,湖南师范大学附属湘南医院消化内科,湖南 衡阳 421002)
肥大细胞(Mastocyte MC)是机体的主要免疫细胞,是胃肠道黏膜免疫系统的重要成分之一,也是其免疫功能的重要节点。神经-免疫-内分泌网络调节中通过MC 释放的细胞因子参与黏膜免疫调节过程,参与人体多种生理和病理功能调节[1]。关于肥大细胞在肠道黏膜免疫方面作用的研究是近年来学者们所关注的热点之一,我们以往研究证实,SD 大鼠行回肠末端-盲肠侧侧吻合术可建立实验性末端回肠炎模型,且造模组比缝线组炎症程度更明显。本研究拟通过观察该动物模型回肠末端肥大细胞的变化,以探讨其在末端回肠炎发病机制中的意义。
1 材料与方法
1.1 主要试剂和仪器RPMI 1640 培养基(美国Gibco 公司)、胎牛血清(杭州四季青生物工
程材料有限公司)、MTT(SIGMA 公司)、Tunel试剂盒(美国Promega 公司)、凋亡DNA 提取试剂盒(北京普利莱基因技术有限公司)、SD 大鼠肥大细胞分离液(中国医学科学院生物工程研究所)、RNaseDNA 分子量标准物(华美生物工程公司)、Hank's 液(晶美生物技术有限公司)EB (Sigma 公司)、紫外分光光度计(美国Perkim Elmer 公司,Lambda25 型)、810 型凝胶成像系统(上海山富科学仪器有限公司)、100 目不锈钢细胞筛(上海丰行筛网制造有限公司)、400 目尼龙网(上海丰行筛网制造有限公司)、荧光倒置显微镜(日本Olymus 1X71 型)。
1.2 实验动物及分组
选用雄性清洁级SD 大鼠60 只,体重为250 ~350 克/只,饲养场所、动物均由南华大学动物实验部提供,实验期间提供足够的SD 大鼠普通饲料及自来水,动物室保持在22℃,自动通风。实验动物随机分为3 组:对照组、缝线组、造模组,每组各20只。
动物模型的制作:术前禁食12 小时,用3%戊巴比妥钠0.3 ~0.4mL 腹腔麻醉。在无菌条件下行腹部手术,剖腹寻找回盲部,分别分离回肠末端及结肠起始部,在回肠距回盲瓣3cm 处及结肠起始部分别作长约1cm 的切口,采用回肠末端与盲肠侧侧吻合术(使回盲瓣去功能化,造成结肠-回肠反流),术后关腹,缝合切口,用碘伏消毒。缝线组除在末端回肠距回盲部3cm 处作一长等同于上述吻合口的切口并手术缝合外,其余均与造模组相同。术后两天禁食不禁水,第三天恢复进食,但进食量约为平时量的1/3,术后一周进食量约为平时量的3/4[16-17],后给予平时进食量。分别于术后2、8 周,禁食不禁水12 小时后分批脱颈椎处死动物并取材。手术均由普外科高年资主治医师主刀。
1.3 检测指标及方法
1.3.1 肥大细胞的原代分离并甲苯胺蓝法鉴定
将肥大细胞置于预冷的含体积分数10%胎牛血清的RPMI1640 培养液中,100 目不锈钢细胞筛研磨后400 目尼龙网过滤,滤液离心洗涤1 次,离心半径8cm(以下同),500r/min 离心10min,制成肥大细胞单细胞悬液。将悬液滴至玻片上风干,用1% pH 3.5 的甲苯胺蓝染液染约20s,然后用95%酒精分色、水洗并镜下观察。
1.3.2 肥大细胞计数
将细胞悬液加入SD 大鼠肥大细胞分离液,2000r/min 离心20min,小心吸取界面细胞,洗涤1次后重新悬浮在适量培养液中,为纯化的肥大细胞悬液。2g/L 台盼蓝染色,活细胞计数>95%,纯度>97%。调整细胞含量为1 ×106/mL,计算每只SD大鼠肥大细胞总数。
1.3.3 肥大细胞脱颗粒程度判断
4 个视野不见脱颗粒的肥大细胞为(—),4 个视野见4 个以下为轻度,一个视野见10 个以上为重度,介于轻度和重度之间为中度。
1.3.4 肥大细胞增殖率的检测
将生长在对数期的MC 细胞,在96 孔板中分别以1.0 ×104/mL 接种,每种细胞设三复孔,每孔中含有200(l 的培养基。其中96 孔板的四周只加入培养基,置于CO2培养箱内37(C 培养72 小时。加入10(l 的5mg/mL MTT;37(C 培养4 小时后,1200rpm/min 离心10 分钟;弃上清,加入100(l 的DMSO 溶解;微型振荡器振荡15 分钟,测490nm 光吸收值,即MTT 法检测细胞存活率。
1.3.5 肥大细胞凋亡检测(TUNEL 法)
将生长在对数生长期的MC 细胞,接种爬片,置于CO2培养箱内37(C 培养72 小时。先浸入4%多聚甲醛5min,用PBS 浸洗,加100μL 平衡液,湿盒平衡10min,制备Tunel 反应混合液,然后用1(l rTDT+1(l 生物素标记的DUTP +98(l 平衡液混匀,将TUNEL 反应混合液加在切片上,37℃温育90min(阴性对照片、TUNEL 混合液中不加TDT),接着用PBS洗5min 连续3 次,终止液室温阻断10min,37℃温育90min,加POD 转化剂,37℃温育30min,最后用PBS洗5min 连续3 次。荧光显微镜下拍照记录结果。
1.3.6 肥大细胞细胞DNA 琼脂糖凝胶电泳
按说明书操作,采用凋亡DNA 提取试剂盒提取凋亡小分子DNA。15g/L 琼脂糖凝胶电泳,SYBR Green-1 染色,可见光凝胶分析系统观察并拍照保存其结果。
1.4 统计学处理
所有实验结果应用SPSS 18.0 统计软件建立数据文件并进行统计分析,计量资料用均数±标准差表示,计数资料采用χ2检验,两组均数比较用t 检验,多组均数比较采用单因素方差分析,组间多重比较用SLD-t 检验,等级资料比较用秩和检验,以α =0.05 为检验水准。
2 结果
2.1 甲苯胺蓝染色后呈现出肥大细胞的典型特征:细胞核被染成深蓝色,胞浆见大量紫红色的颗粒。
2.2 SD 大鼠肥大细胞计数的比较
SD 大鼠造模2、8 周后,肥大细胞数明显减少(F2周=63667.0,P2周=0.000;F8周=65363.0,P8周=0.000);且缝线组、造模组与对照组及缝线组与造模组均有减少t2周缝线= 298. 627,P2周缝线<0. 001;t2周造模=350.072,P2周造模<0.001;t8周缝线=812.740,P8周缝线<0. 001;t8周造模=314. 732,P8周造模<0. 001;t2周造模=8781.082,P2周造模<0.001;t8周造模=106.670,P8周造模<0.001);同组在2 周与8 周肥大细胞数进行比较,结果为缝线组、造模组均减少(t缝线=39.183,P缝线<0.001;t造模=55.347,P造模<0.001);而对照组无明显变化(t =1.143,P >0.05)(见表1)。
2.3 SD 大鼠肥大细胞脱颗粒程度的比较
SD 大鼠造模后2、8 周肥大细胞脱颗粒程度的变化结果经秩和检验,差异有统计学意义,经进一步组间的多重比较,结果为缝线组、造模组与对照组及缝线组与造模组脱颗粒程度均有加重(P <0.05)。且造模组脱颗粒程度较其余两组更重(P <0.05)(见表2)。
2.4 SD 大鼠肥大细胞增殖情况的比较
SD 大鼠在2、8 周时增殖率逐渐降低(F2周=104.8,P2周=0.0000;F8周=309.8,P8周=0.0000);三组间多重比较,2 周缝线组、造模组与对照组均有下降(t2周缝线=34.310,P2周缝线<0.01;t2周造模=11.186,P2周造模<0.01);而缝线组与造模组相似(t2周缝线与造模=1.493,P2周缝线与造模>0.05)(见表3)。
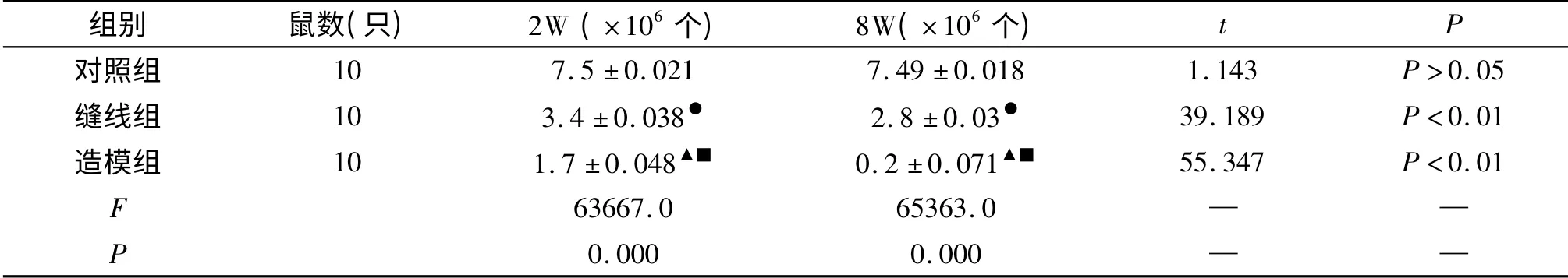
表1 SD 大鼠肥大细胞计数的比较

表2 SD 大鼠肥大细胞脱颗粒程度的比较

表3 SD 大鼠肥大细胞的增殖情况的比较
2.5 SD 大鼠肥大细胞凋亡(TUNEL 法检测)情况的比较

图1 TUNEL 细胞凋亡图
细胞形态改变为卵圆形,细胞核皱缩、固缩或核碎裂凋亡的改变,细胞核染色质致密程度逐步增加,图中细胞偏圆,染色亮的为凋亡细胞。以下TUNEL检测肥大细胞凋亡图可观察到:与对照组相比,缝线组和造模组在第2 周时,可见少量的凋亡肥大细胞,第8 周时,缝线组和造模组均可见大量的凋亡肥大细胞,且造模组的凋亡细胞明显多于缝线组。肥大细胞呈现出随着组织炎症的加重,肥大细胞凋亡数越多(见图1)。
2.6 SD 大鼠肥大细胞凋亡DNA 梯度条带特征
将对照组、缝线组及造模组2、8 周大鼠回肠肥大细胞,进行细胞小分子DNA 琼脂糖凝胶电泳,结果表现为典型的“梯形”(200bp、400bp)条带,但造模组200bp 条带较缝线组为明显,表明造模组的细胞凋亡更为显著(见图2)。
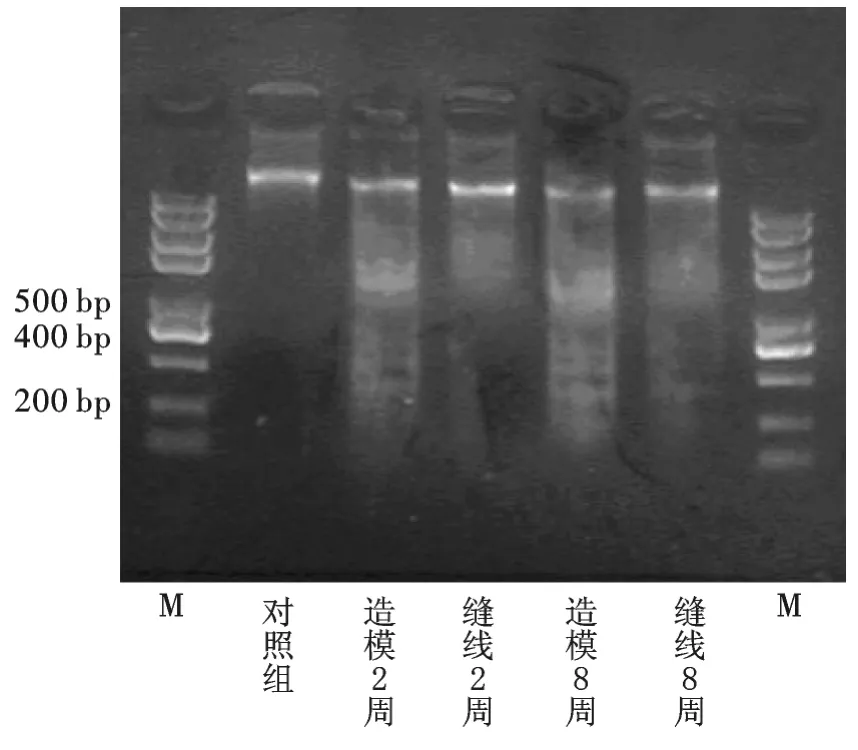
图2 细胞凋亡DNA 梯度条带图
3 讨论
肥大细胞(Mast cell,MC)是机体内重要的效应性和调节性免疫细胞,与巨噬细胞、树突状细胞、自然杀伤细胞等共同构成机体的第一道防线[1]。MC含有特殊胞质颗粒,贮存有炎症介质,在与细菌相互作用时,可释放颗粒中新合成的炎症介质,促使嗜中性粒细胞等炎性细胞聚集,增强对细菌的清除功能,这一过程称之为脱颗粒[2]。另外,由于MC 广泛分布于皮肤、呼吸系统、消化系统、泌尿系统等,参与多种生理病理过程,因此MC 的生存与凋亡以及由其调节的MC 形态和数量的变化与多种病理生理过程息息相关[3]。
正常的MC 多呈圆形或卵圆形,细胞核小,呈圆形或椭圆形细胞质中充满大小一致、染成蓝紫色的颗粒,均匀分布在核周围,组织中的MC 数目在一定情况下是相对恒定的。在发生持续性炎症的组织中,MC 的数量呈现出递减的趋势,形态也逐渐出现多样化的改变,且随着时间的延长和炎症程度的加重,变化越明显[3]。本实验中,模、缝线组MC 呈圆形、梭形、不规则形等多种形态改变;术后缝线组、造模组与对照组相比细胞数量减少,缝线组与造模组有差异;这说明,在末端回肠炎的发病过程中肥大细胞的形态和数量有明显的变化,并与炎症程度有关,即炎症程度越重,肥大细胞形态越不规则且数量越少。
MC 中的颗粒是用来识别和判断MC 功能状态的常用手段之一,MC 胞质颗粒内含有多种生物活性物质,如组织胺、5-羟色胺、蛋白多糖、中性蛋白酶、白三烯、前列腺素、血小板活化因子及多种白细胞介素(IL)等多种炎性介质,引发平滑肌收缩、腺体分泌增加,毛细血管扩张和通透性增强,从而导致组织损伤、坏死和炎症蔓延,多种方式可诱导MC 的脱颗粒过程,其脱颗粒的分子机制是一个由多种蛋白质分子介导的,各个环节受到精确调控的复杂过程,MC 的这种脱颗粒反应,既是机体的一种防御反应,也是速发型变态反应和炎症等病理反应的基础,MC 的脱颗粒程度与炎症反应呈正相关[2]。本实验中,缝线组、造模组与对照组及缝线组与造模组比较脱颗粒程度均加重,且造模组脱颗粒程度较其余两组更重,表明肥大细胞的脱颗粒程度与组织炎症相关,即炎症反应越明显,脱颗粒程度越严重。
MC 中细胞因子影响着MC 的增值与凋亡,MC激活后通过旁分泌机制产生IL3、IL4、SCF,影响着MC 的存活。IL-3 不仅调节肥大细胞前体的生长和功能,还调节成熟MC 的生长和功能,SCF 显示抑制凋亡,IL-4 诱导人肠道MC 的增殖、释放炎性介质及细胞因子的产生。因为MC 主要位于血管外组织,所以它的数目主要通过局部MC 的增生与凋亡来调节。MC 通过释放细胞因子参与炎症反应,因此,其凋亡程度随着炎症反应加重[4]。通过MC 凋亡的检测可以反映疾病的发生和发展情况,本实验中,术后2 周,可见少量凋亡肥大细胞,第8 周时,缝线组和造模组均可见大量凋亡肥大细胞,且造模组的凋亡细胞明显多于缝线组。本研究结果证实:在实验性末端回肠炎的发病过程中,随着组织炎症的加重,肥大细胞的凋亡数越多。
MC 的主要功能是通过释放其颗粒和内容物产生多种活性介质而起作用的[3,5],目前已证实激活的MC 可以释放约40 多种作用不同的介质,但末端回肠炎发病相关的具体介质种类及其作用机制仍不清楚。另有文献报道[6-7],通过减少MC 的脱颗粒反应,阻止与MC 紧密联系的神经纤维的形成,能够明显减低肠道痛觉过敏,减少由炎症引起的肠道疼痛反应。若深入研究其作用机制肯定有助于阐明末端回肠炎的发病机制,并为其提供更广阔的治疗前景。
[1]JTrivedi NH,Guentzel MN,Rodriguez AR,st. Mast cells:multitalented facilitators of protection against bacterial pathogens[J]. Expert Rev Clin Immuno1,2013,9(2):129-138.
[2]Ord T,Ord D,Kuuse S,Plaas M,st. Trib3 is regulated by 1L-3 and affects bone marrow-derived mast cell survival and functional[J].Cell Immunol,2012,280(1):68-75.
[3]Harvima IT,Nilsson G. Mast ce11s as regulators of skin in flammation andimmunity[J].Acta Derm Venereol,2011.91:644-650.
[4]Jamur MC,Oliver C.Origin,maturation and recruitment of mast cell precursors.Front Biosci(Schol Ed)2011;3:1390-1406 .
[5]Tripodo C,Gri G,Piccaluga PP,et al. Mast ce11s and Th17 cells contribute to the lymphoma-associated pro-inflammatory microenvironment of angioimmunoblastic T-ce11 lymphoma[J]. Am J Pathol,2010,177:792-802.
[6]De Filippis D,L,Cipriano M,et al. Palmitoylethano lamide reduces granuloma 一induced hyperalgesia by modulation of mast cell activation in rats[J].Molecular Pain,2011 ,7(3):1-9.
[7]Chatterjea D,Wetzel A,Mack M,et al. Mast cell degranulation mediates compound 48 /80 一induced hyperalgesia in mice[J]. Biochem Biophys Res Commun ,2012 ,425 (2):237-243.

