肾茶水提取物对大鼠腺嘌呤肾功能衰竭模型的肾功能影响
张少贵,黄荣桂,郑兴中
2.福建医科大学 附属第二医院肾脏病研究室,泉州362000
慢性肾功能衰竭(chronic renal failure,CRF)是一组进行性肾单位毁损,从而使肾脏的排泄功能、内环境稳定功能和内分泌功能紊乱为特征的临床综合群。透析和肾脏移植是治疗该病的重要手段,但受治疗费用及其他因素限制。因此,非透析疗法特别是中药治疗CRF已为国内外医学专家所重视。本研究采用腺嘌呤灌胃法建立大鼠CRF模型,观察肾茶对CRF大鼠尿液尿酸、血清肌酐(creatinine,Cr)、尿素氮(blood urea nitrogen,BUN)、丙二醛(malondialdehyde,MDA)含量和肾小球滤过率(glomerular filtration rate,GFR)及对肾脏病理学改变的影响,探讨肾茶水提取物对腺嘌呤致CRF大鼠的肾脏保护作用及其可能的机制,为中西医结合防治、延缓CRF提供依据。
1 材料与方法
1.1 材料
1.1.1 动物 清洁级雄性SD大鼠40只,体质量200~220g[上海斯莱克实验动物有限责任公司,许可证号:SCXK(沪)2013-0005]。
1.1.2 药物肾茶[Clerodendranthusspicatus(Thunb.)C.Y.Wu ex H.W.Li]药材又名猫须草,购自泉州市医药分公司,产地福建同安,经福建中医药大学药学院金琪漾教授鉴定,为唇形科肾茶属多年生草本植物。取肾茶粗粉150g加蒸馏水10倍量,浸泡1h后,在70℃水浴提取2h后,滤过,滤液于旋转蒸发器减压浓缩制成剂量1mL相当于1g生药的肾茶水提取物供用。严格按照提取操作规程,保证药物质量稳定。尿毒清颗粒冲剂(批号20130904,广州康臣药业有限公司)。
1.1.3 试剂 腺嘌呤(河南新乡拓新生化科技有限公司),蒽酮、菊粉(美国Sigma公司),尿酸、BUN、Cr及MDA等测定试剂盒(南京建成生物工程研究所),兔抗碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)试剂盒(福州一冠生物科技有限公司)。
1.2 方法
1.2.1 动物分组及造模、给药途径 SD大鼠40只适应性饲养1周后,按体质量分层随机分为5组,由于预试验正常大鼠各项指标稳定,故安排5只为正常对照组。即正常对照组(n=5),模型对照组(n=8),肾茶低剂量组 (n=8),肾茶高剂量组(n=8),阳性对照组(即尿毒清组,n=8)。除正常对照组等体积蒸馏水灌胃,其他各组按200mg/kg体质量腺嘌呤灌胃造模逐渐诱发CRF。除正常对照组和模型对照组给予等体积蒸馏水灌胃外,各治疗组相应予肾茶2.5、5.0g·kg-1·d-1、尿毒清1.81g·kg-1·d-1灌胃,均连续给药4周。治疗17d将大鼠放入代谢笼中,收集8h尿液,测尿酸含量,4周后采血,测定GFR,并处死大鼠,进行各项指标测定。
1.2.2 主要观察指标 (1)测定尿液尿酸含量;(2)治疗4周后,大鼠戊巴比妥钠溶液麻醉,经股动脉采血,测定血清BUN、Cr和MDA,均按试剂盒操作步骤分别测定;(3)测定GFR,采用蒽酮法测定菊糖含量,用注射器从股动脉取血,不保留动脉插管,避免取微量血时插管存在死腔,影响血样品[1];(4)病理组织学检查:中性10%福尔马林溶液固定,经脱水、石蜡包埋,常规H-E染色,光镜观察;(5)免疫组织化学检测:石蜡切片常规脱蜡入水,高压抗原修复(bFGF),3%H2O2阻断内源性过氧化氢酶,滴加适当比例稀释的一抗(1∶160)和二抗(1∶320),DAB显色,镜下观察。在高倍镜(×200)下随机选择20个肾小球和20个视野肾小管-间质,根据染色面积和强度进行半定量评分。染色强度标准:基本不着色者0分,着色淡者1分,适中者2分,深者3分;染色面积标准:无染色或微弱染色为0,染色面积<25%为1,25%~50%为2,50%~75%为3,>75%为4。两者得分相加为最终值。
2 结 果
2.1 治疗第17d尿尿酸水平 造模第17d,各组尿尿酸水平见表1,其中模型对照组较正常对照组显著减少(P<0.01),肾茶高剂量组较模型对照组及肾茶低剂量组显著增加(P<0.01)。
2.2 治疗4周血清Cr、BUN水平 肾茶各剂量治疗组血Cr、BUN值显著低于模型对照组(P<0.01,表1)。
2.3 治疗4周菊粉清除率和血清MDA含量 肾茶高剂量组肾菊粉清除率明显高于模型对照组(P<0.05)。肾茶各剂量治疗组血清 MDA含量显著低于模型对照组(P<0.05,表1)。
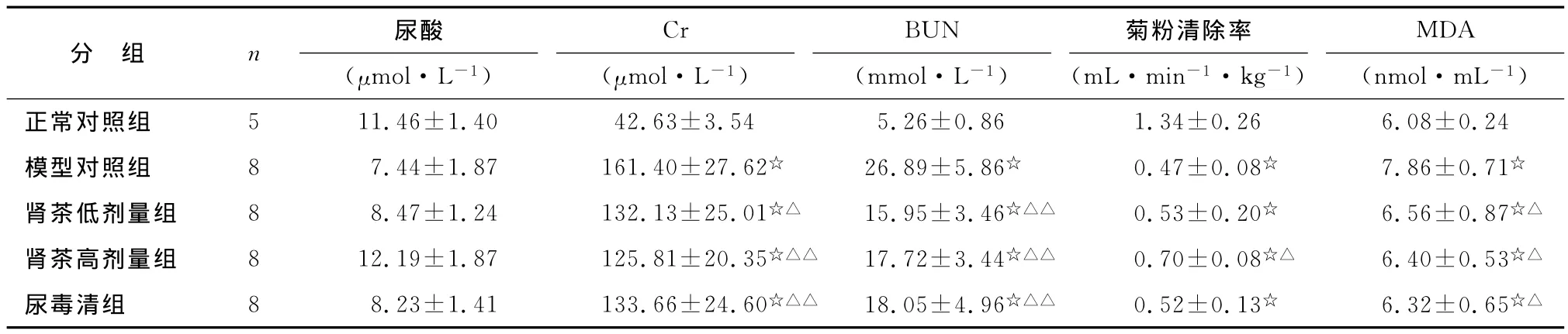
表1 治疗4周各组血清肌酐、尿素氮、菊粉清除率和血清MDA含量比较Tab 1 The effects of C.Spicatus on Scr,BUN,the inulin clearance rate and the MDA
2.4 肾脏病理学观察 光镜:肾茶高剂量组大鼠肾代偿性增大较模型对照组减轻,呈蚤咬肾状,模型对照组呈大白肾状。与正常对照组相比,模型对照组光镜下见区域性肾单位萎缩、消失,肾小球肿胀明显,肾小管破坏严重,部分破坏消失或极度扩张和萎缩,肾间质及肾小管内见大量尿酸结晶沉积;间质内有大量炎症细胞浸润,伴纤维增生、肉芽形成;肾茶高剂量组肾单位萎缩、消失、纤维增生面积较小,肾小球轻度肿胀,肾小管扩张和萎缩较小,管腔中尿酸结晶沉积较少,近曲及远曲小管坏死程度减轻,可见少量炎症细胞浸润。肾茶低剂量组与尿毒清组均有一定的改善(图1)。
免疫组织化学检测结果:bFGF在正常对照组肾小管及肾间质细胞中表达较少;在模型对照组肾小管及肾间质细胞中bFGF的表达明显增加(P<0.01);而在肾茶高剂量组上述增加的表达受到明显抑制(P<0.05,图2,3)。
3 讨 论
肾茶又名猫须草,其主要活性成分有迷迭香酸(RsA)、熊果酸,其他有黄酮、香豆素、三萜类化合物及肌醇等200多种化合物。药理作用主要有抗炎、免疫调节、抗氧化、抗凝、抗感染、利尿等。近年来已有应用单味肾茶及其复方制剂治疗慢性肾炎及肾功能不全的实验和临床研究报道[2-3]。本研究发现,第17d肾茶治疗组能增加CRF模型大鼠尿酸排泄,4周后降低血清BUN、Cr及MDA含量,改善肾脏组织病理异常。因此,肾茶能提高大鼠机体的抗氧化能力,减轻自由基对肾小球的损伤和肾脏组织病理异常,具有明显改善CRF大鼠肾功能的作用。
文献报道,RsA是较强的黄嘌呤氧化酶抑制剂,RsA类似物咖啡酸也有较强的黄嘌呤氧化酶抑制作用[4]。而黄嘌呤氧化酶是嘌呤转变成尿酸过程中的关键酶。RsA可通过黄嘌呤氧化酶的竞争性抑制作用减少嘌呤转变为尿酸,减轻其在肾小管的沉积,改善肾脏对体内尿酸的排泄。肾茶还具有利尿作用,使尿液尿酸排泄增多[5-6]。本研究以菊粉清除率为指标显示,高剂量肾茶治疗可以改善GFR和降低血清Cr、BUN,改善肾功能。
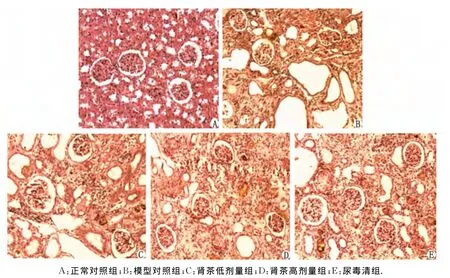
图1 肾脏H-E染色病理学改变( ×100)Fig 1 The histopathology of the renal constitution examined(H-E ×100)

图2 bFGF免疫组织化学表达Fig 2 The expression of bFGF in the kidneys

图3 各组肾组织bFGF蛋白表达Fig 3 The expressiong of bFGF in the kidneys
CRF时测定MDA含量常可反映机体内脂质过氧化的程度,间接反映细胞受自由基攻击的严重程度[7]。肾茶抗氧化的主要活性成分为 RsA[8],可与不饱和脂肪酸竞争性结合脂质过氧化物,终止脂质过氧化的连锁反应。研究表明,RsA能清除过量活性氧自由基,抑制iNOS和COX-2的表达,从而减少NO和PEG2的产生,具有很强的抗氧化作用[9-11]。近年来,有研究报道,肾茶及其主要成分RsA能有效抑制糖尿病肾病大鼠肾组织脂质过氧化产物MDA的产生,抑制其氧化损伤过程[12]。本实验结果也显示,肾茶能有效地减少脂质过氧化产物MDA的产生,抑制CRF的进展。
研究表明,bFGF可以促进成纤维细胞增生和胶原纤维合成[13]。而成纤维细胞是肾间质纤维化的主要效应细胞,在肾间质纤维化中起重要作用[14]。在CRF患者肾间质单核细胞和小管上皮细胞胞质中,bFGF表达明显增强。本研究显示,高剂量肾茶治疗可减少肾脏组织bFGF的表达,延缓、减轻肾脏组织纤维化的程度。
2011年,Mohamed等对肾茶标准化的50%乙醇提取物进行毒性评价,大鼠单剂量5 000mg·kg-1·d-1灌胃,观察14d,未见毒性反应及死亡;亚急性毒性试验,大鼠以5 000mg·kg-1·d-1剂量灌胃,连续28d,给药组与对照组各项指标比较,均无明显差别[15]。Muhammad等用沙门氏菌微粒体试验和小鼠骨髓微核测试均证明,肾茶水提取物不会致突变,不构成基因毒性风险[16]。因此肾茶水提取物毒性小,使用安全,特别适用于健肾、改善肾功能。本研究为肾茶进一步开发利用提供科学依据。
[1]Huang W C,Wu J N.Blunted renal responses to atrial natriuretic peptide and its reversal by unclipping in one-kidney,one clip Goldblant hypertensive rats[J].JHypertension,1997,15(2):181-189.
[2]谢丽萍,向彩春,史 伟,等.猫须草治疗慢性肾小球肾炎蛋白尿43例临床研究[J].江苏中医,2012,44(2):21.
[3]王立强,盂萍萍,智 利,等.肾茶提取物防治大鼠慢性肾功能衰竭的实验研究[J].中国医药科学,2011,1(1):33-35.
[4]尚雁君,黄才国,蒋三好,等.迷迭香酸对黄嘌呤氧化酶的抑制作用[J].第二军医大学学报,2006,27(2):191.
[5]Yuliana N D,Khatib A,Link-Struensee A M,etal.Adenosine Al receptor binding activity of methoxy flavonoids from Orthosiphon stamineus[J].PlantaMed,2009,75(2):132-136.
[6]黄荣桂,沈文通,郑兴中,等.肾茶对尿路结石的治疗作用[J].福建医科大学学报,1999,33(4):402-405.
[7]Templar J,Kon S P,Milligan T P,etal.Increased plasma malodialdehyde levels in glomerular disease as determined by a fully validated HPLC method[J].NephrolDialTransplant,1999,14(4):946.
[8]刘耕陶.丹参的7种酚类成分对生物膜过氧化损伤的保护作用[J].中国药理学与毒理学杂志,1992,6(1):77.
[9]Yoshimasa Nakamura,Yoshimi Ohto,Akira Murakami.Superoxide scavenging activity of roismarinic acid from perilla frutescens britton Var.acuta f.viridis[J].JAgricFood Chem,1998,46(11):4545-4550.
[10]Kelm M A,Nair M G,Strasburg G M,etal.Antioxidant and cyclooxygennase inhibitory phenolic compounds from Ocimum santum Linn[J].Phytomedicine,2000,7(1):7-13.
[11]Hsu C L,Hong B H,Yu Y S,etal.Antioxidant and antiinflammatory effects of orthosiphon aristatus and its bioactive compounds[J].JAgricFoodChem,2010,58(4):2150-2156.
[12]刘广建,黄荣桂,郑兴中,等.肾茶对糖尿病大鼠肾脏的保护作用及其机制研究[J].中国中西医结合肾病杂志,2007,8(1):32-34.
[13]韦 颖,樊均明,潘丽萍,等.碱性成纤维细胞生长因子对人肾成纤维细胞的影响[J].中华肾病杂志,2002,18(2):135-136.
[14]Jocks T,Zahner G,Freudenberg J,etal.Prostaglandin Elreduces the glomerular mRNA expression of monocytechemoattractant protein-1in anti-thymocyte antibody-induced glomerular injury[J].JAmSocNephro,1996,7:897-905.
[15]Mohamed E A,Lim C P,Ebrika O S,etal.Toxicity evaluation of a standardised 50%ethanol extract ofOrthosiphon stamineus[J].JEthnopharmacol,2011,133(2):358-363.
[16]Muhammad H,Gomes-Carneiro M R,Poca K S,etal.Evaluation of the genotoxicity of Orthosiphon stamineus aqueous extract[J].JEthnopharmacol,2011,133(2):647-653.

