血清HE4、CA-125和ROMA指数在盆腔恶性肿瘤中的诊断价值
沈 菁,黄 毅,陈 雯,徐如梅,吴文冰
宫颈癌、子宫内膜癌和卵巢癌是妇科常见的三大盆腔恶性肿瘤,其中卵巢癌因发病隐匿、早期诊断率低而致死率极高,子宫内膜癌则有发病率上升和年轻化的趋势。CA-125作为传统妇科盆腔恶性肿瘤的筛查指标,在许多妇科盆腔良性疾病如炎症、子宫内膜异位症、盆腔良性肿瘤患者以及非妇科恶性肿瘤患者血清中也可升高,特异性较差。人附睾蛋白4(HE4)是一种新型的妇科肿瘤标志物,在卵巢癌、子宫内膜癌组织中高表达,而在癌旁组织、正常组织及良性肿瘤中水平低。笔者回顾性分析2013年6月-2014年7月行手术治疗妇科盆腔肿瘤患者201例的肿瘤标志物检测结果,评价HE4、CA-125和ROMA指数在妇科盆腔肿瘤中的诊断价值。
1 对象与方法
1.1 对象 201例患者年龄为(45.2±15.6)岁(12~83岁)。患者诊断均经病理证实,其中恶性肿瘤63例,包括卵巢癌32例(浆液性腺癌18例、黏液性腺癌5例、子宫内膜样腺癌4例以及非上皮性卵巢癌5例),子宫内膜癌23例,宫颈癌8例;良性肿瘤138例,包括卵巢良性肿瘤108例(黏液性囊腺瘤18例、浆液性囊腺瘤18例、交界性囊腺瘤5例、成熟型囊性畸胎瘤29例、子宫内膜样囊肿33例、单纯性囊肿5例),子宫良性疾病30例(子宫肌瘤12例、子宫肌腺症8例、子宫内膜息肉10例)。选择健康体检女性30例为对照组,年龄(38.6±10.2)岁(22~60岁),均无心、肝、肺、胃等重要脏器疾病或妇科疾患,无肿瘤家族史。
1.2 检测方法 患者均术前采集空腹静脉血3~4mL,离心分离血清待测。血清HE4和CA-125检测采用电化学发光法,试剂盒均购自罗氏诊断试剂公司,检测仪器为罗氏Modular E170电化学发光仪。HE4和CA-125试剂盒参考区间分别为0~140pmol/mL和0~35U/mL,其中任一指标高于参考范围定为阳性。将血清HE4和CA-125值输入卵巢癌风险预测模型分析软件,自动计算相应的ROMA指数:
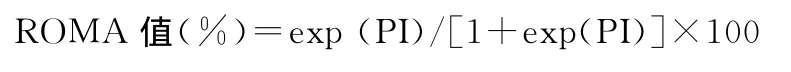
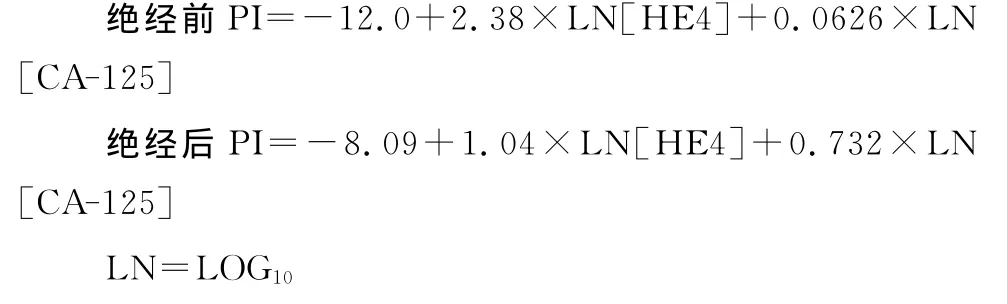
以罗氏Elecsys检测特异性为75%时,绝经前妇女ROMA值≥11.4%患上皮卵巢癌风险高;绝经后妇女ROMA值≥29.9%患上皮卵巢癌风险高。
1.3 统计学处理 应用SPSS 19.0软件进行统计学分析,计量资料为非正态分布,应用中位数及上下四分位数的形式表示,各组间比较采用非参数Kruskai-Wallis H秩和检验,再采用非参数 Mann-Whitney U检验进一步两两比较;计数资料组间比较采用χ2检验;采用受试者工作特征(ROC)曲线,计算曲线下面积(AUG)。P<0.05为差别有统计学意义。
2 结 果
2.1 血清HE4和CA-125检测值及分布 经非参数Kruskai-Wallis H秩和检验,各组患者血清HE4和CA-125水平差别有统计学意义(P<0.01);以非参数Mann-WhitneyU检验做组间两两比较,卵巢癌组和子宫内膜癌组血清HE4的表达水平明显高于其他各组、卵巢癌组血清CA-125的表达水平明显高于除子宫内膜癌组的其他各组、卵巢良性肿瘤组及子宫良性疾病组血清CA-125的表达水平明显高于对照组(P<0.05,表1)。

表1 各组患者血清HE4、CA-125检测值的比较Tab 1 The comparison of HE4and CA-125levels in different groups
2.2 血清 HE4、CA-125和ROMA指数诊断卵巢癌的效能评价 以108例卵巢良性肿瘤组为参照组,32例卵巢癌为恶性肿瘤组,并根据绝经与否将患者进一步细分为绝经前组与绝经后组,ROMA值依据1.2的公式予以计算,HE4、CA-125和ROMA值对卵巢癌诊断效能结果见表2。
以卵巢良性肿瘤和对照组为参照时,HE4诊断卵巢癌的ROC曲线下面积为0.919(95%CI为0.854~0.984);CA-125诊断卵巢癌的 ROC 曲线下面积为 0.814(95%CI为 0.708~0.920);ROMA指数诊断卵巢癌的ROC曲线下面积为0.921(95%CI为0.857~0.985,图1)。

表2 血清HE4、CA-125和ROMA指数诊断卵巢癌效能的比较Tab 2 The comparison of diagnostic efficiency for HE4 ,CA-125and ROMA index in patients with ovarian cancer%
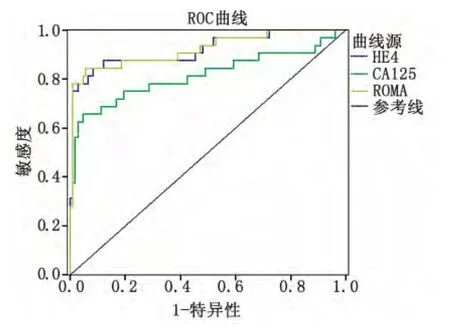
图1 HE4、CA-125和ROMA指数诊断卵巢癌的ROC曲线Fig 1 ROC curve analysis of HE4,CA-125and ROMA index for diagnosis of ovarian cancer
2.4 血清HE4和CA-125诊断子宫内膜癌的效能评价 以30例子宫良性疾病组为参照组,23例子宫内膜癌为恶性肿瘤组,HE4、CA-125单项检测和HE4+CA-125联合检测对子宫内膜癌诊断效能的比较见表3。以子宫良性疾病组和正常对照为参照时,HE4诊断子宫内膜癌的ROC曲线下面积为0.916(95%CI为0.842~0.99);CA-125诊断子宫内膜癌的ROC曲线下面积为0.731(95%CI为0.602~0.859,图2)。

图2 HE4、CA-125诊断子宫内膜癌的ROC曲线Fig 1 ROC curve analysis of HE4and CA-125 for diagnosis of endometrial cancer

表3 血清HE4和CA-125诊断子宫内膜癌效能的比较Tab 3 The comparison of diagnostic efficiency for HE4and CA-125in patients with endometrial cancer %
3 讨 论
妇科盆腔恶性肿瘤中,卵巢癌与子宫内膜癌的诊断目前主要依据三种检测手段:(1)经阴道超声检查(TUV)。TUV可用于检查女性的生殖器官(包括子宫、卵巢、宫颈及阴道),尽管应用较普遍,但是却不能准确检测出该肿块是良性还是恶性。(2)诊断性刮宫。这是目前子宫内膜癌最有价值的诊断手段,但其是盲目性操作,可能出现漏诊或诊断过度。(3)检测相关肿瘤标志物CA-125的血清学。作为一种广泛用于妇科盆腔恶性肿瘤的筛查指标,CA-125在上皮性卵巢恶性肿瘤细胞中存在高度表达。但临床研究发现,其对早期上皮性卵巢癌与子宫内膜癌的灵敏度不足[1-2],且在卵巢囊肿、子宫肌瘤、子宫内膜异位症等其它妇科良性疾病中均有异常表达,特异性方面也欠理想。有鉴于此,有必要引入新的检测手段,以提高卵巢癌与子宫内膜癌的诊断效能。
发现并应用新的相关血清肿瘤标志物因其操作的简便易行,一直是国内外广大科研工作者致力研究的热点。HE4基因由Kirchhoff等在附睾上皮细胞中发现,在正常卵巢、上呼吸道和胰腺呈低表达,在卵巢恶性肿瘤中则表达上调[3]。研究表明,HE4对卵巢癌具有很高的特异性,可用于卵巢癌的早期诊断[4-5]。此外,还有研究显示 HE4可作为子宫内膜癌早期诊断新的血清标志物[2,6]。但关于 HE4在子宫内膜癌的发生、发展中的机制研究不多。赵莹珺等研究阐明了HE4基因转录活性主要是由转录因子Sp1与位于-71和-48的Egr-1位点结合所介导[7]。转录因子Sp1可以受到某些组织特异因子的调控,通过这些因子与Sp1形成复合物的形式促进或阻碍Sp1与其识别位点结合,从而实现启动因子调控的组织特异性[8]。笔者的检测显示,HE4在子宫内膜癌患者血清中高表达,认为HE4基因转录活性的异常可能是由于Sp1受到子宫内膜癌组织特异性因子的影响,造成其高表达。
对201例妇科盆腔肿瘤患者血清HE4和CA-125的检测显示,卵巢癌组血清HE4和CA-125的水平均明显高于宫颈癌组、其它盆腔良性疾病组(卵巢良性肿瘤组、子宫良性疾病组)和对照组(P<0.01);子宫内膜癌组血清HE4水平亦明显高于宫颈癌组、其它盆腔良性疾病组和对照组(P<0.01),但其CA-125水平与其它盆腔良性疾病组相比较无显著性差异(P>0.05)。进一步分析发现,盆腔良性疾病组的血清CA-125水平明显升高,与对照组相比较具显著性差异(P<0.05),而血清HE4水平与对照组接近,提示HE4对卵巢与子宫内膜良恶性疾病的鉴别诊断价值高于CA-125。
将血清HE4和CA-125值输入卵巢癌风险预测模型分析软件,计算得出的ROMA指数是鉴别卵巢良恶性肿瘤的另一项良好指标。3个指标中,HE4对卵巢癌的特异性、阳性预测值和准确性最高,其中绝经前的特异性、阳性预测值高达100%;绝经前CA-125对卵巢癌的敏感性最高;ROMA指数对卵巢癌的敏感性和阴性预期值最高,但和HE4和ROMA指数相比,并未表现出明显优势。为进一步判断HE4、CA-125和ROMA指数对卵巢癌的诊断效能,本研究以卵巢良性肿瘤+健康人为参照,绘制ROC曲线,发现三者诊断卵巢癌的ROC曲线下面积分别为0.919、0.814和0.921,以ROMA指数的诊断效能为最高,这与文献报道一致[9]。
本研究还显示,HE4在诊断子宫内膜癌的特异性、阳性预期值以及准确性方面均明显高于CA-125(P<0.05),且HE4检测子宫内膜癌的ROC曲线下面积较CA-125高。而CA-125在子宫良性疾病组特别是子宫肌腺症中存在较高水平的表达,这与国内外研究基本一致[2,6,10],提示 HE4诊断子宫内膜癌的价值较高。血清HE4、CA-125联合检测的敏感性高于任一项单独检测,表明联合检测对子宫内膜癌辅助诊断价值更高。
综上所述,血清HE4作为妇科盆腔恶性肿瘤筛查的新标志物,在对卵巢癌和子宫内膜癌的特异性方面明显优于CA-125,具有更好的鉴别诊断价值,且与CA-125联合检测有助于提高子宫内膜癌的诊断率;ROMA指数的应用有助于提高对卵巢癌的诊断效能。
[1]Duffy M J,Bonfrer J M,Kulpa J,etal.CA-125in ovarian cancer:european group on tumour markers guidelines for clinical use[J].IntJGynecolCanner,2005,15(5):679-691.
[2]Moore R G,Brown A K,Miller M C,etal.Utility of a novel serum tumor biomarker HE4in patients with endometrioid adenocarcinoma of the uterus[J].GynecolOncol,2008,110(2):196-201.
[3]Kirchhoff C,Habben I,Ivell R,etal.A major human epididymis-specific cDNA encodes a protein with sequence homology to extracellular proteinase inhibitors[J].BiolRepord,1991,45(2):350-357.
[4]Lenhard M,Stieber P,Hertlein L,etal.The diagnostic accuracy of two human epididymis protein 4(HE4)testing systems in combination with CA-125in the differential diagnosis of ovarian masses[J].ClinChemLabMed,2011,49(12):2081-2088.
[5]Kalapotharakos G,Asciutto C,Henic E,etal.High preoperative blood levels of HE4predicts poor prognosis in patients with ovarian cancer[J].JOvarianRes,2012,5(1):20.
[6]Bignotti E,Ragnoli M,Zanotti L,etal.Diagnostic and prognostic impact of serum HE4detection in endometrioid carcinoma patients[J].BrJCancer,2011,104(9):1418-1425.
[7]赵莹珺,杨剑峰,朱景德.人卵巢癌相关候选基因 HE4(WEDC2)的转录调控主要由Sp1与位于271和248的Egr21位点结合所介导[J].肿瘤,2004,24(26):517-525.
[8]Hung C Y,Yang W B,Wang S A,etal.Nucleolin enhances internal ribosomal entry site(IRES)-mediated translation of Sp1 in tumorigenesis[J].BiochimBiophysActa,2014,1843(12):2843-2854.
[9]陈 燕,林莺莺,郑瑜宏,等.血清 HE4、CA-125和ROMA指数评估卵巢癌风险性的初步评价[J].中华免疫学杂志,2013,2(29):168-174.
[10]张双革.人附睾蛋白4对子宫内膜癌的风险评估研究[J].国际妇产科学杂志,2013,4(5):466-469.

