牙龈卟啉单胞菌促进动脉粥样硬化的机制研究
潘盛波,雷 浪,李厚轩,闫福华
2.南京大学医学院 附属口腔医院,南京 210008
牙周感染与动脉粥样硬化(atherosclerosis,AS)密切相关。流行病学研究和动物实验均显示,牙周感染能够加速AS的形成[1-2]。牙周炎进展过程中,细菌及其代谢产物可以进入血液,形成低水平的菌血症和内毒素血症。在血管壁中,宿主防御系统可能利用 Toll样受体(toll like receptors,TLRs)等模式识别受体,识别侵入的牙周致病菌及其代谢产物,激活多种促炎转录因子的激活,产生先天免疫反应,导致组织局部炎症反应发生[3]。目前,AS被认为是一种炎症性疾病,AS血管局部肿瘤坏死因子-α(tumor necrosis factorα,TNF-α)、单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)、白细胞介素-1β(interleukin-1β,IL-1β)等炎症因子表达上调,血管局部表现为炎症反应[4-5]。牙龈卟啉 单 胞 菌 (Porphyromonasgingivalis,P.gingivalis)能够刺激主动脉内皮细胞、脐静脉内皮细胞、血管平滑肌细胞以及巨噬细胞促炎细胞因子的表达[6]。载脂蛋白E基因敲除(apolipoprotein E-deficient,ApoE-/-)小鼠由于脂质代谢障碍,在普通饮食下即可形成高脂血症,是建立AS理想的动物模型[7]。本研究拟进一步分析TLR通路在P.gingivalis菌血症促进ApoE-/-小鼠AS进展过程中的作用,进一步揭示牙周病和心血管疾病间的相关机制。
1 材料与方法
1.1 材料P.gingivalis33277(美国 ATCC公司);脑心浸出液(brain heart infusion,BHI)、酵母提取物(英国Oxoid公司);苏丹Ⅳ染料(美国Sigma公司);TNF-α、MCP-1和IL-1β酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)试剂盒(美国eBioscience公司);TNF-α和 MCP-1多克隆抗体(美国Santa Cruz公司);免疫组织化学试剂盒(中国迈新生物技术开发有限公司);核因子-κB(nuclear factor-κB,NF-κB)、TLR-2、TLR-4 和GAPDH多克隆抗体(美国Cell Signaling Technology公司);RIPA裂解液、BCA蛋白浓度测定试剂盒、HRP标记二抗、ECL化学发光试剂盒(中国碧云天生物技术有限公司);脱脂奶粉(美国BD公司);凝胶电泳迁移率实验(electrophoretic mobility shift assay,EMSA)试剂盒、细胞核和细胞质蛋白抽提试剂盒、BCA蛋白浓度测定试剂盒、生物素3′末端DNA标记试剂盒(美国Thermo Fisher Scientific公司)。
1.2 方法
1.2.1 细菌培养P.gingivalis在含 37g/L BHI、5g/L 酵 母 提 取 物、5mg/L 氯 化 血 红 素 和0.2mg/L甲萘醌的培养基中厌氧条件下培养。
1.2.2 动物饲养 6周龄 ApoE-/-小鼠(18只)[北京大学医学部动物中心,许可证号SCXK(京)2011-0012],在无特异致病菌、恒温、恒湿、12h光照和12h黑暗以普通饲料饲养4周。至10周龄时,分为对照组(9只)和P.gingivalis感染组(9只)。对照组尾静脉注射50μL的磷酸盐缓冲液(phosphate buffered solution,PBS);P.gingivalis感染组尾静脉注射50μL含107个P.gingivalis细菌的PBS,每周1次,共10周。
1.2.3 标本收集 注射细菌第10周时,接种P.gingivalis后24h,小鼠禁食过夜,异氟烷吸入麻醉,眶后静脉取血后,实施安乐死,解剖分离主动脉树(从主动脉近心端到髂动脉),其中3只的主动脉树用于主动脉树苏丹Ⅳ染色,其他6只的主动脉树分3段分别用于免疫组织化学、免疫印迹、凝胶电泳迁移率实验检测。
1.2.4 主动脉树苏丹Ⅳ染色 小鼠主动脉树纵向剖开,固定于橡胶板上,4%的多聚甲醛固定24h,70%乙醇漂洗5min,0.5%苏丹Ⅳ(由35%乙醇和50%丙酮混合液配制)染色6min,80%乙醇脱染5min。数码相机拍照,采用Image-Pro plus 6.0软件测量分析。
1.2.5 血清炎症因子检测 血液标本肝素抗凝,4℃、3 000r/min离心5min,收集上层血浆。按照ELISA试剂盒说明书的实验操作步骤测定血液中TNF-α、MCP-1和IL-1β水平。
1.2.6 免疫组织化学染色 主动脉近心端1cm组织经固定、脱水、浸蜡和包埋制作石蜡切片,5μm连续切片后,脱蜡、水化和抗原修复,3%H2O2封闭内源性过氧化物酶,非免疫性动物血清封闭非特异性抗原,一抗TNF-α(1∶50)和 MCP-1(1∶50)4℃孵育过夜,加生物素化的二抗孵育,加SAB-HRP复合物,DAB显色,苏木精复染,最后脱水、透明、封片并拍照,图片采用Image-Pro plus 6.0软件分析。
1.2.7 免疫印迹检测 RIPA裂解液主动脉组织抽提蛋白,BCA蛋白浓度测定试剂盒测定蛋白浓度;聚丙烯酰胺凝胶电泳,每个上样孔加40μg蛋白样品,浓缩胶80V电泳20min,分离胶120V电泳60min;将电泳分离后的蛋白湿转法转膜到NC膜上;转膜后,以5%脱脂奶粉封闭NC膜,加一抗TLR-2(1∶1000)、TLR-4(1∶1 000)和 GAPDH(1∶1 500)4℃ 孵育过夜,加 HRP标记的二抗37℃孵育1h,用ECL化学发光法显色,最后扫描分析条带。
1.2.8 凝胶电泳迁移率检测 抽提主动脉组织核蛋白并测定浓度;用生物素3′末端DNA标记试剂盒将DNA探针标记上生物素;样品制备:样品体系包括DNA探针、待测核蛋白、NF-κB抗体、反应体系和上样缓冲液的混合液;将样品混合液加到上样孔里,进行非变性胶电泳;电泳后用湿转法进行转膜;转膜后用紫外交联仪进行交联;交联后的膜在封闭液中封闭后,加辣根过氧化物酶标记的链亲和素孵育,后加ECL化学发光试剂进行显色,扫描分析条带。
2 结 果
2.1 斑块面积变化 ApoE-/-小鼠主动脉树苏丹Ⅳ染色显示,P.gingivalis感染组斑块面积较对照组增加;量化分析显示,P.gingivalis感染组斑块面积百分比为(37.2±1.97)%,高于对照组(23.1±2.23)%(P<0.05,图1)。
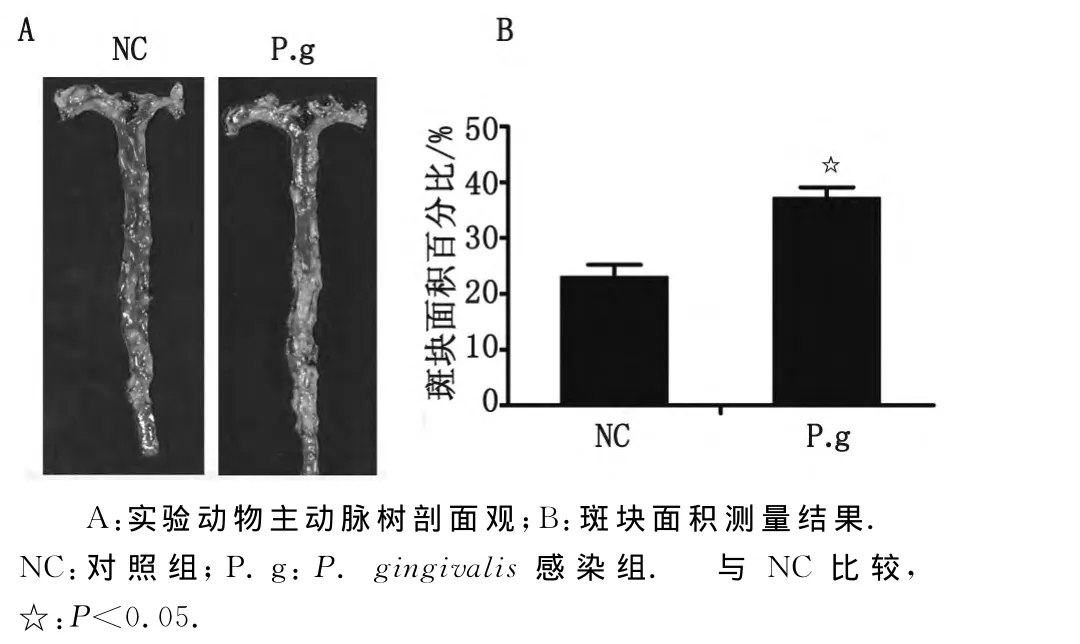
图1 主动脉粥样斑块形成Fig 1 Atherosclerotic plaque in aortic tree
2.2 血清炎症因子水平的变化 ELISA法检测血浆标本炎症因子水平,结果显示:P.gingivalis感染组 TNF-α水平为(348.09±17.97)pg/mL,显著高于对照组(202.46±16.62)pg/mL;P.gingivalis感染组 MCP-1水平为(755.34±41.53)pg/mL,明显高于对照组(510.99±15.87)pg/mL;P.gingivalis感染组IL-1β水平为(126.65±27.45)pg/mL,显著高于对照组(59.95±13.70)pg/mL(P<0.05)(图2)。
2.3 ApoE-/-小鼠主动脉组织炎症因子水平 免疫组织化学染色主动脉组织切片显示:P.gingivalis感染组主动脉血管壁TNF-α和 MCP-1均较对照组表达增加(图3)。

图2 血液炎症因子水平Fig 2 Proinflammatory cytokines in blood
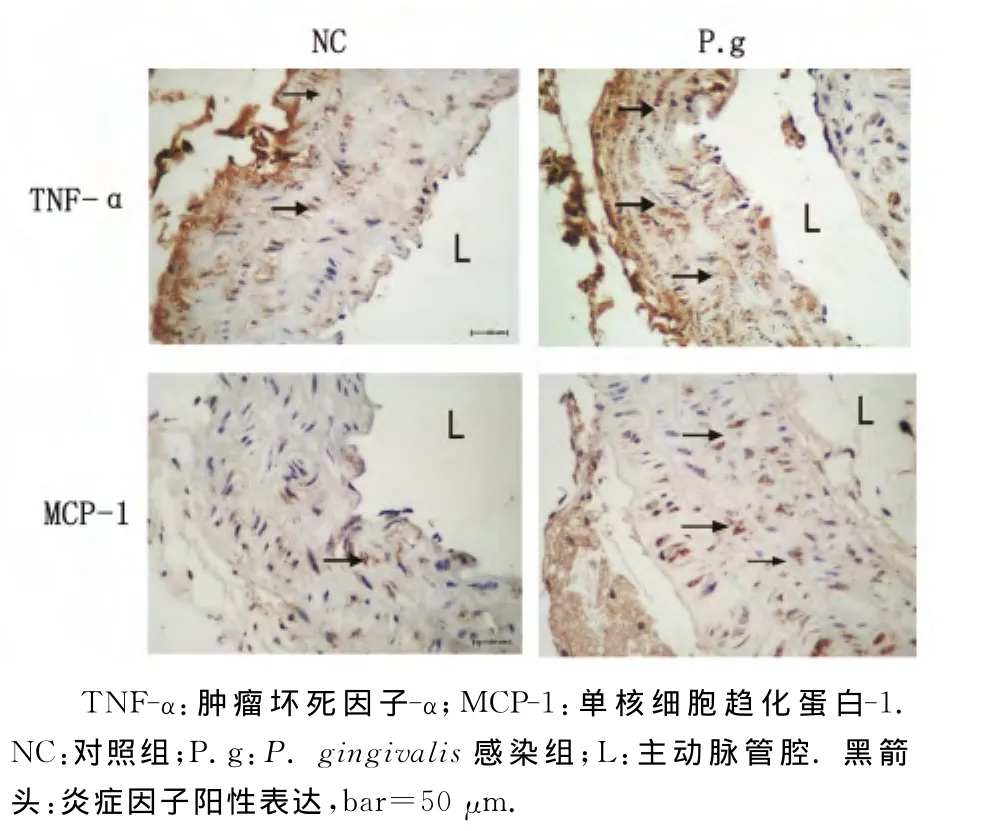
图3 主动脉组织炎症因子水平Fig 3 Expression of inflammatory cytokines in vascularwall
2.4 ApoE-/-小鼠主动脉组织 TLR-2、TLR-4蛋白表达水平和NF-κB活化水平 免疫印迹法检测显示:P.gingivalis感染组主动脉组织中TLR-2、TLR-4蛋白表达显著高于对照组(P<0.05,图4A)。EMSA检测主动脉组织中NF-κB的活化水平,结果显示:P.gingivalis感染组明显高于对照组(P<0.05,图4B)。
3 讨 论
牙周感染与心血管疾病密切相关,能加速AS的形成。ApoE-/-小鼠静脉注射P.gingivalis后,主动脉AS的形成加速[8];同样,高脂血症小鼠口腔接种P.gingivalis后 ,无名动脉AS的形成加速[9],提示牙周炎和牙周炎形成的菌血症均会促进AS进展加速。然而,前述研究未深入研究牙周致病菌促进AS的机制。本结果显示,牙周致病菌通过TLRs/NF-κB通路,促进全身的炎症反应,并且加重血管组织中的炎症反应,从而加速ApoE-/-小鼠AS的形成。
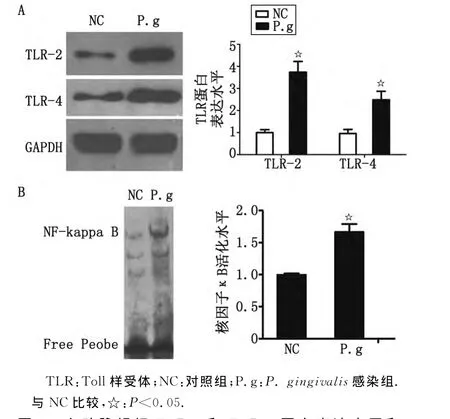
图4 主动脉组织TLR-2和TLR-4蛋白表达水平和NF-κB活化水平Fig 4 Protein expression of TLR-2、TLR-4and NF-κB activity in in aortic tissues
在炎症发生和进展过程中,TNF-α、MCP-1和IL-1β等促炎细胞因子能够活化和趋化免疫细胞,参与炎症反应。在人和动物的动脉粥样斑块中,均可观察到这些炎症细胞因子表达的上调,说明其参与 AS形成[10-11]。本实验观察到,P.gingivalis感染组血液中 TNF-α、MCP-1和IL-1β水平较对照组增加,主动脉组织中TNF-α和 MCP-1表达上调。炎症因子促进AS形成的可能机制是 MCP-1能趋化血液中的单核细胞向血管壁迁移,并转入内膜下分化为巨噬细胞;TNF-α和IL-1β能够活化内皮细胞、巨噬细胞和血管平滑肌细胞,进一步加重炎症反应和 AS的形成[12]。
TLRs是一组病原体相关分子型识别受体,能识别细菌、病毒和寄生虫等外界微生物的细胞壁、细胞膜或者纤毛等的保守序列,即病原体相关性分子型(pathogen associated molecule patterns,PAMPs),在微生物感染反应的固有免疫信号转导中起重要作用。在肺炎支原体促进AS的研究中,发现血管壁TLRs表达上调[13]。本实验结果进一步显示,P.gingivalis感染组主动脉组织中 TLR-2和TLR-4蛋白表达增加,这与Gibson等的结果一致[14];Liu等报道 TLR-2-/-ApoE-/-小鼠 AS明显减少[15]。因此,推测P.gingivalis感染激活TLR-2和TLR-4的表达,通过级联信号传导,激活下游转录因子,激活细胞核内的基因转录,引发机体固有免疫炎症反应,活化免疫细胞,加重AS。
NF-κB是主要的炎症反应的转录因子,调控许多细胞因子、趋化因子、黏附分子、急性反应蛋白、生长因子等的表达。在人类AS病损的内皮细胞、巨噬细胞、平滑肌细胞中均能检测到活化的NF-κB[16],NF-κB参与 AS形成的各个阶段。本实验观察到,P.gingivalis感染组主动脉组织中NF-κB活性增加,其可能机制是P.gingivalis依赖TLRs途径,介导NF-κB的活化。
本实验发现,血管壁的内皮细胞、单核细胞和中性粒细胞等防御系统的成分利用P.gingivalis感染,通过TLR识别血液中的牙周致病菌P.gingivalis,激活将信号转导给NF-κB,使转录因子p65亚单位进入细胞核内,与炎症细胞因子基因中的转录序列结合,启动多种炎症细胞因子的表达。各种炎症因子发挥相应的生物学效应,活化、趋化免疫细胞,促进血管局部和全身的免疫炎症反应,加速AS形成。
[1]Lockhart P B,Bolger A F,Papapanou P N,etal.Periodontal disease and atherosclerotic vascular disease:does the evidence support an independent association?a scientific statement from the American Heart Association[J].Circulation,2012,125(20):2520-2544.
[2]Teles R,Wang C Y.Mechanisms involved in the association between periodontal diseases and cardiovascular disease[J].OralDis,2011,17(5):450-461.
[3]Hayashi C,Gudino C V,Gibson F C 3rd,etal.Review:Pathogen-induced inflammation at sites distant from oral infection:bacterial persistence and induction of cell-specific innate immune inflammatory pathways[J].MolOralMicrobiol,2010,25(5):305-316.
[4]Libby P.Inflammation and cardiovascular disease mechanisms[J].AmJClinNutr,2006,83(2):456-460.
[5]Libby P.Inflammation in atherosclerosis[J].Arterioscler ThrombVascBiol,2012,32(9):2045-2051.
[6]Gibson F C 3rd,Yumoto H,Takahashi Y,etal.Innate immune signaling and Porphyromonas gingivalis-accelerated atherosclerosis[J].JDentRes,2006,85(2):106-121.
[7]Massaro D,Massaro G D.Apoetm1Unc mice have impaired alveologenesis,low lung function,and rapid loss of lung function[J].AmJPhysiolLungCellMolPhysiol,2008,294(5):991-997.
[8]Li L,Messas E,Batista E L Jr,etal.Porphyromonas gingivalis infection accelerates the progression of atherosclerosis in a heterozygous apolipoprotein E-deficient murine model[J].Circulation,2002,105(7):861-867.
[9]Hayashi C,Viereck J,Hua N,etal.Porphyromonas gingivalis accelerates inflammatory atherosclerosis in the innominate artery of ApoE deficient mice[J].Atherosclerosis,2011,215(1):52-59.
[10]Libby P,Ridker P M,Hansson G K.Progress and challenges in translating the biology of atherosclerosis[J].Nature,2011,473(7347):317-325.
[11]Ma S,Guo J,You X,etal.Expressions of interleukin-1beta and interleukin-6within aortas and uteri of rats with various severities of ligature-induced periodontitis[J].Inflammation,2011,34(4):260-268.
[12]Packard R R,Lichtman A H,Libby P.Innate and adaptive immunity in atherosclerosis[J].SeminImmunopathol,2009,31(1):5-22.
[13]Moghimpour B F,Vallejo J G,Rezaei N.Toll-like receptor signaling pathways in cardiovascular diseases:challenges and opportunities[J].IntRevImmunol,2012,31(5):379-395.
[14]Gibson F C 3rd,Hong C,Chou H H,etal.Innate immune recognition of invasive bacteria accelerates atherosclerosis in apolipoprotein E-deficient mice[J].Circulation,2004,109(22):2801-2806.
[15]Liu X,Ukai T,Yumoto H,etal.Toll-like receptor 2plays a critical role in the progression of atherosclerosis that is independent of dietary lipids[J].Atherosclerosis,2008,196(1):146-154.
[16]de Winther M P,Kanters E,Kraal G,etal.Nuclear factor kappaB signaling in atherogenesis[J].ArteriosclerThromb VascBiol,2005,25(5):904-914.

