完全经胸彩超引导的经皮房间隔缺损封堵术5例报道
曹 华,陈良万,张贵灿,陈 强,丘智煌,卢 衡
房间隔缺损是一种常见的先天性心脏病,其发病率为所有先天性心脏病的10%~15%,传统的治疗方式为体外循环下心内直视修补[1]。近年来,随着经皮封堵技术及经胸小切口封堵技术的完善,部分房间隔缺损患者可取得满意的效果[2-5]。2014年9-10月,笔者采取不需要X线设备、完全经胸彩超引导经皮房间隔缺损封堵术用于治疗中央型房间隔缺损病例5例,取得良好效果。
1 对象与方法
1.1 对象 5例中,男性3例,女性2例,年龄(21.3±9.6)岁(14~38岁),体质量(45.3±7.9)kg(35~50kg),房 间 隔 缺 损 直 径 (20±8)mm(16~28mm),患者详情见表1。5例患者均由心脏彩超明确诊断为单纯中央型房间隔缺损,并伴有轻度肺动脉高压;不合并其他心内畸形。心电图均提示:窦性心律。胸片提示:双肺未见明显实变。
1.2 手术方法 5例均采取静吸复合麻醉。患者平卧位右胸垫高30°,经胸超声心动图观察房间隔缺损的形态及位置,多个切面测量房间隔缺损的直径,房间隔缺损测量的最大直径再加上4~6mm作为选择的封堵伞的直径大小。封堵伞经肝素盐水浸泡后安置于输送鞘管内。全身肝素化(1mg/kg),右股静脉穿刺,留置穿刺静脉鞘管,置入多功能导管(图1A)。在超声引导下,将多功能导管经下腔静脉进入右心房(图1B),再由右心房经房间隔缺损进入左心房,经该导管置入加硬导丝,彩超定位明确加硬导丝进入左心房(图1C)。退出多功能导管,沿加硬导丝,置入封堵输送鞘管,彩超定位输送鞘管进入左心房后(图1D),退出内芯及加硬导丝,经输送鞘管缓慢送入封堵伞,小心推送钢丝。在经胸彩超实时引导下,将左心房侧封堵伞打开(图1E),旋转输送鞘管,使得左房侧封堵伞与房间隔平行,并往回拉紧左房侧封堵伞,再打开右心房侧伞(图1F)。当封堵伞夹住房间隔缺损边缘后,彩超确认堵闭伞牢固,无残余分流,对上腔静脉、下腔静脉、肺静脉、冠状静脉窦开口及二、三尖瓣结构和功能无影响后,撤出推送鞘管,释放封堵伞。
术后送重症监护室,清醒后拔除气管插管。术后给予口服潘生丁或阿司匹林抗凝治疗6月。
1.3 结果 5例患者均顺利完成封堵手术。手术时间(47.5±5.6)min(40~60min),封堵伞型号为22~34号。术后住院天数(2.0±0.7)d(1~3d)。5例患者均予心脏彩超及心电图复查,无封堵伞移位、房水平残余分流,完全性房室传导阻滞及血栓相关并发症等(表1)。
2 讨 论
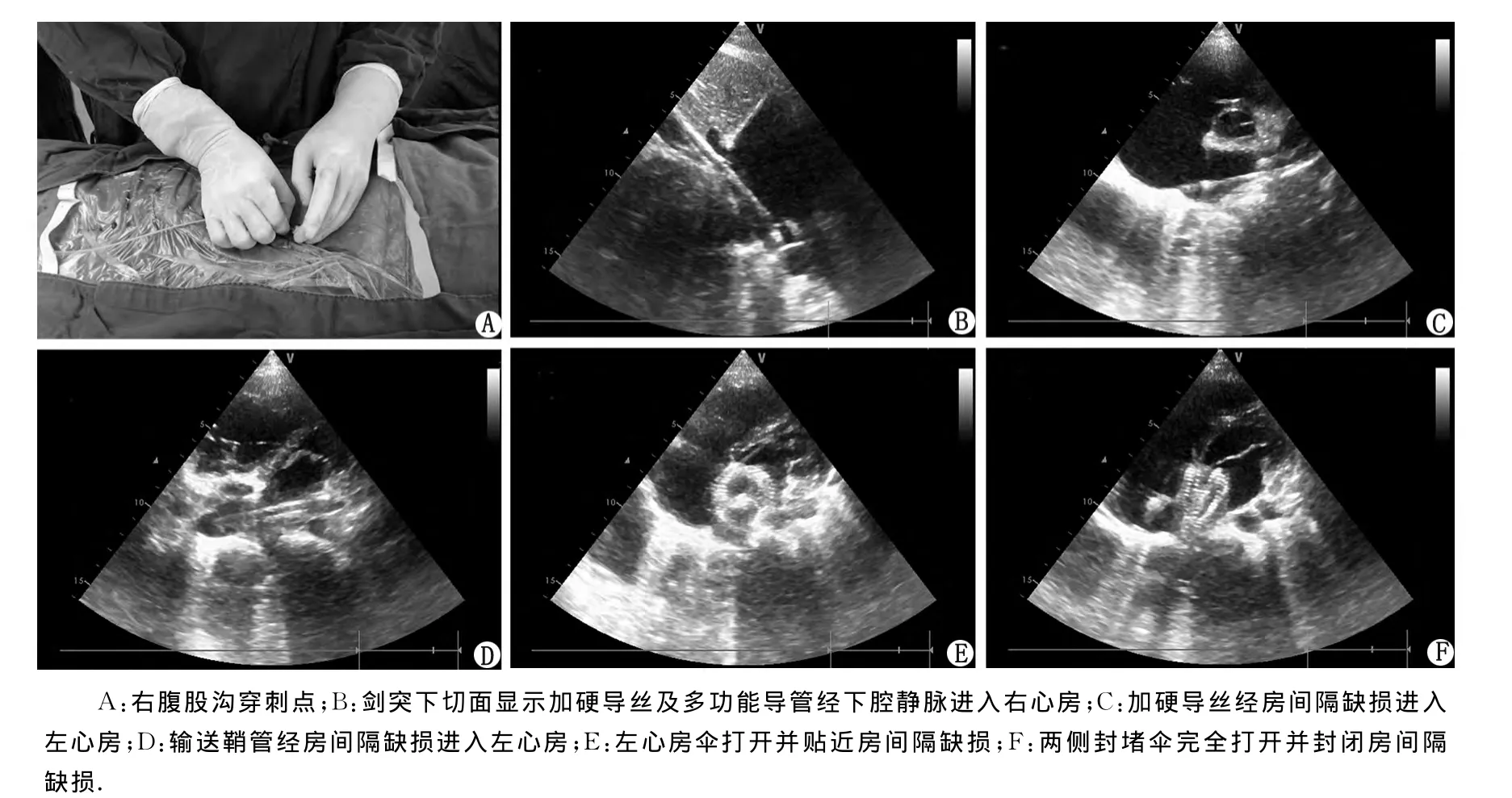
图1 经皮房间隔缺损封堵术Fig 1 Percutaneous transcatheter closure of atrial septal defect
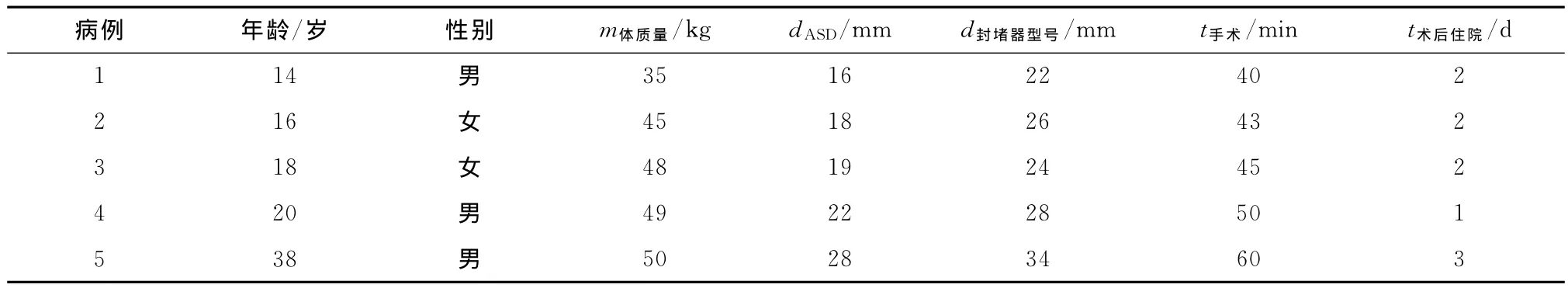
表1 5例患者的临床资料及手术治疗结果Tab 1 Clinical data of 5patients in our procedure
房间隔缺损是一种常见的先天性心脏病,传统体外循环下心内直视停跳或不停跳下修补术已证明取得满意的手术效果。但是,体外循环不可避免存在可能对机体及心肌的损伤,而且不管采取胸骨正中切口、胸骨下段小切口及右前胸弧形切口,均会遗留较大的手术疤痕[1]。虽然经皮封堵技术日臻完善并已取得满意的手术效果,但治疗过程中医患双方都需暴露在X射线下;同时该技术必须配备大型、价格昂贵的X射线设备,使得目前一般基层医院尚无法普及。另外,国内开展这一技术多在介入手术室,一旦发生封堵伞脱落,将难以处理[2-3]。近年来,国内多家心脏外科中心开展经胸微创封堵术,该技术综合了经皮封堵法术及外科手术操作的优缺点。该技术完全避开体外循环,只需要右前胸小切口,术后恢复快,迎合了广大患者的美观要求;同时手术径路短,操作方便,完全避开X射线辐射,扩大了封堵的适宜证。该手术由外科医生操作,一旦封堵失败,能及时在手术室快速转为体外循环手术,而不需要在介入手术室及外科手术室之间转诊[4-6]。笔者在经胸微创先天性心脏病封堵术的基础上,借鉴经皮封堵技术经验,在手术室完成不需要X线设备、完全经胸彩超引导下经皮房间隔缺损封堵术。该技术不需要X线设备引导,仅有右侧腹股沟一个穿刺创口,达到与介入封堵术同等的效果,实现真正的微创和美容的目的。由于X线对医患双方均有潜在的伤害[9-10],这项技术特别适用于那些担心潜在X线损害并且追求微创效果的患者。在目前国内杂交手术室尚未普及的条件下,由外科医师实施该技术,既避免了可能的X射线辐射伤害,又实现真正意义的微创,同时又可解决封堵伞脱落的并发症。
成功完成该手术首先应该选择合适的病例。笔者选择的病例是中央型房间隔缺损,缺损的边缘充足,容易进行封堵手术。选择较大年龄的患者,血管直径较大,便于置入输送鞘管。其次,经胸心脏彩超在手术过程中有至关重要的作用,必须由经验丰富的彩超医师术中参与。虽然有报道经胸心脏彩超准确率不如经食道彩超准确,笔者根据以往丰富的临床经验认为[6-7],对于一般的患者经胸心脏彩超可以获得与经食道彩超一样的图像效果,同时简化了操作流程[11-14]。最后,该手术必须由外科医师完成,最好有开胸手术及经胸微创封堵手术经验,甚至要有完成大血管介入手术的经验。在没有X射线辅助定位,外科医师的空间立体思维以及和彩超医师的实时交流尤为显得重要。根据初期的体会,笔者认为该手术操作存在以下技术难点:(1)置入多功能导管时,可由彩超探及下腔静脉,引导多功能导管进入右房(如图1所示),并通过调整导管前端方向,引导进入左房,该操作在剑突下切面容易完成;(2)置入加硬导丝及输送鞘管时,动作必须轻柔,同时必须彩超实时定位,防止损伤大血管或心房;(3)释放左房伞后,应注意左房伞是否与房间隔平行,必要时可以通过旋转输送鞘管调节。
本研究还存在以下不足之处:首先,入组病例偏少,且病例具有选择性,目前尚不能做到广泛普及,今后笔者将进一步探索相关的病例入组、手术操作、围术期监护问题;其次,该术式对于术者要求高,除了必须具有丰富的临床经验,还需要多学科配合,学习周期长。但是,该技术较以往多项技术都具备有优势,同时由外科医师操作,更具备有发展的优势,具有较好的临床前景。
综上所述,笔者认为完全经胸彩超引导经皮房间隔缺损封堵术是安全、可行的,它摆脱了体外循环,同时实现真正的微创、美观。该手术可经胸超声引导或经食道超声引导,不需要大型放射设备,即使封堵不成功,可立即转入外科手术治疗,解决外科医生的后顾之忧。
[1]Kirklin J W,Barratt-Boyes B G.Atrialseptaldefectandpartialanomalouspulmonaryvenousconnection[M].In:Cardiac surgery,2nd ed.Churchill Livingstone,New York,1993:609-644.
[2]Yew G,Wilson N J.Transcatheter atrial septal defect closure with the Amplatzer septal occluder:five-year follow-up[J].CatheterCardiovascInterv,2005,64:193-196.
[3]Zanchetta M,Rigatelli G,Pedon L.Transcatheter atrial septal defect closure assisted by intracardiac echocardiography:3-year follow-up[J].JIntervCardiol,2004,17:95-98.
[4]Zeng X J,Chen X F,Cheng D,etal.Peratrial closure of atrial septal defects without cardiopulmonary bypass[J].AsianCar-diovascThoracAnn,2007,15:191-193.
[5]Li H,Sheng LJ,Wang Z J,etal.Intraoperative device closure of large secundum atrial septal defects;a safe alternative to transcatheter closure[J].EuropeanJournalofCardio-thoracicSurgery,2008,33:1055-1060.
[6]Chen Q,Cao H,Zhang G C,et,al.Safety and feasibility of intra-operative device closure of atrial septal defect with transthoracic minimal invasion[J].EurJCardiothoracSurg,2012,41(1):121-125.
[7]Chen Q,Chen L W,Cao H,etal.Intraoperativ device closure of atrial septal defects with inferior vena cava rim deficiency:a safe alternative to surgical repair[J].IranJPediatr,2011,141(3):631-636.
[8]Zhang H,Chen Q,Chen L W,et,al.Intraoperative device closure of atrial septal defects in the older population[J].IntJ CardiovascImaging,2011,6:123.
[9]Golding S J.X-rays can harm you and others[J].AcadRadiol,2012,19(6):772.
[10]Archer B R.Recent history of the shielding of medical x-ray imaging facilities[J].HealthPhys,2005,88(6):579-586.
[11]Mesihovi'c-Dinarevi'cS,Begi'cZ,Halimi'cM,et,al.The reliability of transthoracic and transesophageal echocardiography in predicting the size of atrial septal defect[J].ActaMed Acad,2012,41:145-153.
[12]Zanjani K S,Zeinaloo A,Malekan-Rad E,et,al.Transcatheter atrial septal defect closure under transthorasic echocardiography in children[J].IranJPediatr,2011,21(4):473-478.
[13]Erdem A,Sarltas T,Zeybek C,etal.Transthoracic echocardiographic guidance during transcatheter closure of atrial septal defects in children and adults[J].IntJCardiovascImaging,2013,29:53-61.
[14]张贵灿,陈良万,邱罕凡,等.微创外科房间隔缺损封堵术的超声心动图评价[J].福建医科大学学报,2008,42:433-435.

