苦参素对食管癌Eca-109细胞BIP和CHOP mRNA表达的影响*
曹 珊,周慧茹,朱艳琴
1)河南中医学院基础医学院 郑州450046 2)河南中医学院第二临床医学院 郑州450002
#通讯作者,女,1956年11月生,硕士,教授,研究方向:肿瘤病理及中医药防治,E-mail:jc.zyqin@163.com
食管癌是消化系统常见肿瘤,特别是食管鳞状细胞癌[1]。目前,中药防治食管癌的研究已经取得了一定的成果,但苦参素促进人食管癌Eca-109 细胞凋亡分子机制的研究尚未见报道。该实验通过观察不同剂量的苦参素对体外培养的人食管癌Eca-109 细胞内质网应激(endoplasmic reticulum stress,ERS)途径标志蛋白免疫球蛋白重链结合蛋白(immunoglobulin heavy chain binding protein,BIP)和C/EBP 环磷酸腺苷反应元件结合转录因子同源蛋白(CAAT/enhancer binding protein homologous protein,CHOP)mRNA 表达的影响,探讨其促进Eca-109 细胞凋亡可能的作用靶点,为苦参素临床应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞 食管癌Eca-109 细胞由郑州大学公共卫生学院王凯娟教授馈赠。
1.1.2 主要药品与试剂 苦参素注射液(上海第一生化药业有限公司产品),批号001244,规格2 g/L、2 mL/支;5-氟尿嘧啶(上海旭东海普药业有限公司产品),批号071001,规格2 g/L、10 mL/支;DMEM、胰蛋白酶(美国Gibco 公司产品);胎牛血清(杭州四季青公司产品);二甲基亚砜(上海化学试剂厂产品);碘化丙啶(PI,美国Sigma 公司产品);逆转录试剂盒、实时定量试剂盒、总RNA 提取试剂(日本TaKaRa 公司产品);引物由上海捷瑞生物技术公司设计并合成。
1.1.3 主要仪器 CO2恒温培养箱(德国Heraeus公司),FACS Calibur 流式细胞仪(美国BD 公司),FLUOVIEW FV100 共聚焦荧光显微镜(日本Olympus 公司),PCR 扩增仪(德国Whatman Biometra 公司),实时定量PCR 仪(美国Applied Biosystem公司)。
1.2 Eca-109 细胞的培养、传代 Eca-109 细胞常规培养于体积分数10%胎牛血清、青霉素、链霉素的RPMI 1640 培养液中,在37℃、体积分数5% CO2和充分湿度条件下培养,每3~4 d传代1 次,取对数生长期细胞用于实验。
1.3 实验分组与给药 实验细胞分为空白对照组、5-氟尿嘧啶组和苦参素组。其中苦参素组按药物剂量不同分为苦参素高剂量(2.0 g/L)、中剂量(1.0 g/L)、低剂量(0.5 g/L)3组;5-氟尿嘧啶组用药剂量为2 g/L;空白对照组仅加入等体积的培养液,不加药物。培养48 h 后,收集细胞。
1.4 Eca-109 细胞增殖能力的MTT 法检测 取对数生长期细胞,制备细胞悬液。调整细胞浓度为1×104mL-1,接种于96 孔培养板内,每孔200 μL,预培养24 h。按1.3 实验分组分别加入不同剂量药物,每组设6 个复孔,培养48 h 后,加入MTT 液(5 g/L)20 μL/孔,继续培养4 h,去上清,加入二甲基亚砜150 μL/孔,振荡10 min,上酶标仪于490 nm处测吸光度值(A 值)。实验重复3 次。
1.5 Eca-109 细胞凋亡率的Annexin V-PI 法检测按试剂盒说明操作如下。各组用PBS 洗涤,2.5 g/L胰蛋白酶消化2~3 min,转移至离心管中,加入培养液,混匀后1 000 r/min 离心4 min,弃上清,加PBS重悬细胞,调整细胞浓度为1×106mL-1,取0.5 mL上述细胞悬液,1 000 r/min 离心4 min,弃上清,加0.5 mL Binding Buffer 重悬细胞,加入1 μL 荧光标记的Annexin V 试剂,混匀后避光室温下孵育20 min,加入5 μL PI,混匀后避光4℃条件下孵育5 min,加入500 μL Binding Buffer,上流式细胞仪检测凋亡率。实验重复3 次。
1.6 Eca-109 细胞BIP 和CHOP mRNA 相对表达量的实时荧光定量PCR 检测 引物设计如下。βactin 上游引物序列5'-CTACAATGAGCTGGTGTGG-3',下游引物序列5'-TAGCTCTTCTTCAGGGAGGA-3',产物大小180 bp;BIP 上游引物序列5'-TCTAG GTGAACGACCCCTAAC-3',下游引物序列5'-GT TCTCTCAATTTTCTCCCAAC-3',产物大小648 bp;CHOP 上游引物序列5'-CGCCTTCAACGACGAGTTC CTG-3',下游引物序列5'-GCTGTTCTTATCCAC CGACTTC-3',产物大小503 bp。提取每组细胞总RNA,逆转录合成cDNA。PCR 反应体系为10 μL:SYBR Green ⅠMixture 5 μL,上游引物0.25 μL,下游引物0.25 μL,模板cDNA 1 μL,ddH2O 3.3 μL,Rox 0.2 μL。反应条件:95℃预变性10 min;95℃变性30 s,58℃退火40 s,72℃延伸40 s,共45 个循环。每个样本的RNA 含量均根据各自的β-actin 含量进行标准化,采用2-ΔΔCt法计算BIP 和CHOP mRNA 的相对表达量。实验重复3 次。
1.7 统计学处理 采用SPSS 13.0 进行统计分析。各组间A 值、凋亡率、BIP 和CHOP mRNA 相对表达量的比较采用单因素方差分析,组间两两比较采用LSD-t 检验。检验水准α=0.05。
2 结果
2.1 苦参素对Eca-109 细胞增殖能力和凋亡率的影响 结果见表1。与空白对照组比较,高、中、低剂量的苦参素和5-氟尿嘧啶均可抑制Eca-109 细胞增殖,促进Eca-109 细胞凋亡。
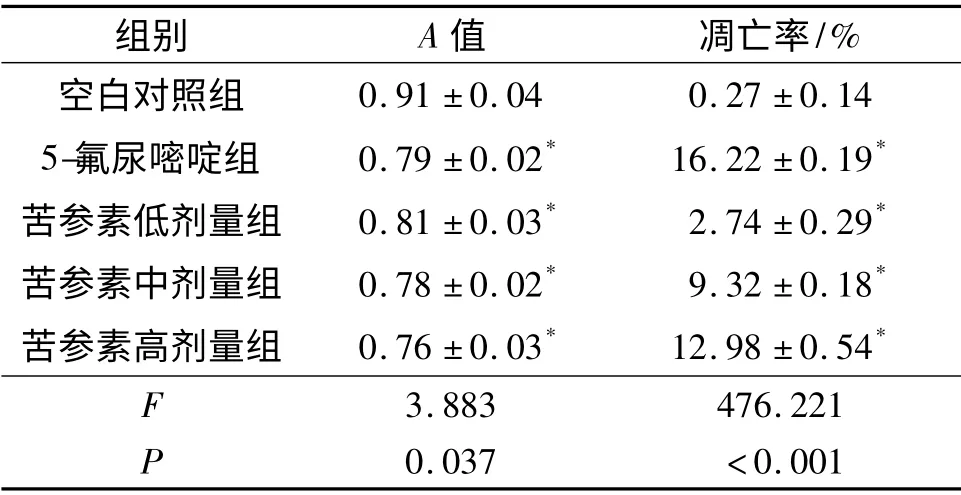
表1 各组Eca-109 细胞A 值和凋亡率的比较(n=3)
2.2 苦参素对Eca-109 细胞BIP 和CHOP mRNA表达的影响 结果见表2。与空白对照组比较,高、中、低剂量的苦参素和5-氟尿嘧啶均可下调BIP mRNA 表达,上调CHOP mRNA 表达。

表2 各组Eca-109 细胞BIP 和CHOP mRNA 相对表达量的比较(n=3)
3 讨论
内质网是细胞内蛋白质合成、折叠的重要场所。低氧、葡萄糖饥饿、氧化和糖基化作用紊乱等刺激,可使未折叠或错误折叠的蛋白质积聚于内质网内,导致ERS。此时,细胞通过启动未折叠蛋白反应,降低蛋白质合成速率、上调内质网伴侣蛋白表达来增加内质网的蛋白处理能力、减轻内质网负担,以恢复细胞内环境的稳态,从而对细胞起到保护作用[2-3]。BIP 又称葡萄糖调节蛋白78,是葡萄糖调节蛋白的主要成员,亦是驻留于内质网腔内的内质网标志分子伴侣,常作为ERS 的标志物,在辅助蛋白质折叠、调节ERS 跨膜信号蛋白活性等方面发挥着重要的作用。研究[4-5]表明,BIP 可结合未折叠的多肽链,具有协调蛋白质正确折叠和装配的功能,可抑制蛋白质聚集并降低错误折叠蛋白质的分泌,促进细胞存活。正常情况下,BIP 与RNA 依赖性蛋白激酶样内质网激酶、肌醇需求酶1、转录激活因子6 结合,使这3 种蛋白处于无活性状态,而ERS 发生时,BIP释放这3 种蛋白,从而导致3 种蛋白的激活,继而诱导ERS 下游靶基因的表达[6],包括CHOP。CHOP是ERS 凋亡途径的关键因子,在ERS 诱导细胞凋亡中发挥促凋亡作用,在一定程度上反映细胞凋亡的水平。ERS 发生时CHOP 可通过转录抑制抗凋亡因子Bcl-2 的表达引起细胞凋亡。CHOP 介导的凋亡参与肿瘤、糖尿病、帕金森病等诸多疾病的发生和发展过程。研究[7]证实抗肿瘤药物可通过上调CHOP的表达来诱导肿瘤细胞凋亡,同时CHOP 的过表达在增敏化疗药物中也起到了关键作用。因此,CHOP凋亡通路与肿瘤发生及治疗的研究越来越受到关注。
苦参素是氧化苦参碱和极少量氧化槐果碱的混合物,是从豆科植物苦豆草的种子苦豆子或豆科植物苦参的根中提取的一种生物碱。苦参素具有抗病毒、抗炎、调节免疫等作用,对中枢神经系统、心血管系统亦有明显的药理作用。近年来研究[8]发现苦参素具有明显的抑制肿瘤、调节肿瘤细胞周期及诱导肿瘤细胞分化等作用。该实验结果证实苦参素可促进Eca-109 细胞凋亡,进一步支持苦参素抑制Eca-109 细胞增殖的理论;实时荧光定量PCR 检测发现空白对照组细胞BIP mRNA 高表达,提示ERS参与Eca-109 细胞增殖过程。肿瘤组织由于生长过快,营养供应相对不足,而高表达的BIP 可拮抗内质网相关性细胞凋亡,使Eca-109 细胞在缺氧、酸中毒等微环境下得以耐受及生存。该研究中苦参素组细胞BIP mRNA 表达下调,提示苦参素抑制Eca-109细胞增殖的药理作用与调控ERS 有关;苦参素组细胞CHOP mRNA 高表达,表明苦参素可放大ERS 凋亡信号,通过CHOP 转录激活诱导Eca-109 细胞凋亡,但CHOP 诱导凋亡的下游信号机制还需要进一步研究。
[1]赫捷,邵康.中国食管癌流行病学现状、诊疗现状及未来对策[J].中国癌症杂志,2011,21(7):501
[2]Chakrabarti A,Chen AW,Varner JD.A review of the mammalian unfolded protein response[J].Biotechnol Bioeng,2011,108(12):2777
[3]Cao SS,Kaufman RJ.Unfolded protein response[J].Curr Biol,2012,22(16):R622
[4]Sato M,Yao VJ,Arap W,et al.GRP78 signaling hub a receptor for targeted tumor therapy[J].Adv Genet,2010,69:97
[5]Walter P,Ron D.The unfolded protein response:from stress pathway to homeostatic regulation[J].Science,2011,334(6059):1081
[6]常晓东,甘华,杜晓刚,等.内质网应激在高脂血症引起肾脏损害中的作用[J].西安交通大学学报:医学版,2010,31(1):79
[7]曹洁,杨朝霞,沈薇,等.内质网应激在软脂酸钠诱导的脂肪变性L02 肝细胞凋亡中的作用[J].第三军医大学学报,2011,33(18):1935
[8]朱艳琴,王凯娟.苦参素注射液对Eca-109 细胞周期及CyclinD1、CDK4 蛋白表达的影响[J].郑州大学学报:医学版,2008,43(6):1082

