俄罗斯卡尔梅克共和国发酵蔬菜中细菌多样性研究*
侯强川,郭壮 ,张家超,孙天松
(内蒙古农业大学乳品生物技术与工程教育部重点实验室,内蒙古呼和浩特,010018)
发酵蔬菜是以蔬菜为原料,通过自然发酵或人工接种益生菌发酵的方式得到的一大类食品,其产品主要包括泡菜、酸菜、酱菜、腌菜等。发酵蔬菜不仅保留了蔬菜原来的营养价值,同时在有益微生物的作用下,其还能产生多种人体必须的氨基酸和脂肪酸,增加了蔬菜的营养价值,延长了蔬菜的保质期。
既往研究表明,乳酸菌对于发酵蔬菜的发酵成熟起着至关重要的作用[1-3],分离筛选品质优良的乳酸菌菌株是发酵蔬菜工业化生产所必不可少的。除此之外,发酵蔬菜中微生物的种类和数量对发酵蔬菜的风味和质量具有极其重要的影响[4]。全面深入地分析发酵蔬菜中微生物的多样性和菌群组成对于掌握发酵蔬菜风味物质的产生和变化规律,营养物质的生成机理以及科学地预测产品保质期具有重要的意义。
传统检测发酵蔬菜中微生物组成最常用的是基于纯培养的方法,但受培养条件的限制,该方法并不能完全揭示产品中微生物菌群的组成。之前有研究表明,自然界中只有不到1%的微生物可培养[5],这表明单纯以纯培养的方式研究发酵蔬菜中微生物的组成,结果往往是低估了产品中微生物的多样性。伴随分子生物学的发展,越来越多的基于非培养的微生物检测方法和技术如DGGE/TGGE技术、克隆文库分析法、SSCP技术、基因芯片技术等被广泛应用于发酵蔬菜微生物检测中。这些新技术的使用使人们对于自然界中99%以上不可培养微生物的研究成为可能。随着罗氏454公司新一代高通量焦磷酸测序仪的面世,我们获得了一种全新认识微生物世界的途径,454焦磷酸测序技术具有测序通量大、快速、成本低等优点,近年来该技术在各类食品微生物检测中的应用越来越广泛,如奶酪[6-7],开菲尔[8-9],酒精饮料[10]等发酵食品。
本研究以采集自俄罗斯卡尔梅克共和国埃利斯塔市郊的2份发酵蔬菜为研究对象,通过纯培养的方法结合16S rRNA测序技术对其中分离出的乳酸菌进行了准确的鉴定和分型,同时采用454焦磷酸测序技术分析了样品中细菌构成的多样性。以期为发酵蔬菜工业化生产菌株的筛选做前期菌株储备,同时也为全面掌握发酵蔬菜中细菌的组成和改进发酵蔬菜的制作工艺提供有益的参考。
1 材料与方法
1.1 材料与试剂
本实验的2份发酵蔬菜样品Ru12、Ru13采集自俄罗斯埃利斯塔市郊,MRS液体培养基、MRS固体培养基、10%脱脂乳培养基等参照文献[11-13]制备,M17固体培养基(CM0785B)和M17液体培养基(CM0817B)由英国OXOID公司提供,PCR引物由上海桑尼生物科技有限公司合成。Taq酶(DR001C)由宝生物工程(大连)有限公司提供。
1.2 仪器与设备

表1 实验所用的主要仪器Table 1 The main equipment in this study
1.3 菌株培养分离及鉴定方法
1.3.1 乳酸菌的分离纯化
无菌条件下,用灭菌枪头吸取500 μL发酵液于4.5 mL的生理盐水(0.85%,w/v)中,以十倍稀释法对其进行梯度稀释后,吸取200 μL稀释度为10-5、10-6、10-7的稀释液涂布于已准备好的M17和MRS固体平板培养基上。将涂布的平皿放入厌氧培养罐中(气体条件:CO2∶H2∶N2=10∶10∶80),并置于 30 ℃培养48~72 h,菌落形成后观察其形态。依据之前报道中乳酸菌的菌落形态特征,将疑似为乳酸菌的菌落做标记,并在无菌操作台中用接种针或接种环挑取标记好的菌落分别相应接种于MRS和M17液体培养基中,30℃厌氧培养24 h。继续传代后挑取适量菌体进行革兰氏染色试验(涂片、固定、染色、脱色),在显微镜下仔细观察并记录细胞形态和细菌排列方式。将革兰氏染色阳性的菌株暂定为乳酸菌[14],并进一步纯化培养保存。
1.3.2 乳酸菌基因组DNA提取及16S rRNA测序
将纯化好的菌株采用CTAB法提取总DNA[15]。并利用PCR扩增其16S rRNA基因片段。扩增引物采用通用引物:
正向引物为27F:5'-AGAGTTTGATCCTGGCTCAG-3’;
反向引物为1495R:5'-CTACGGCTACCTTCTTACGA-3’。
PCR反应体系见表2:

表2 PCR反应体系(25μL)Table 2 PCR reaction system(25μL)

取5 μL PCR产物和2 μL上样缓冲液(6×Loading Buffer)混合,采用1.0%琼脂糖凝胶进行电泳检测,电压5 V/cm,电泳液为0.5×TBE。电泳30 min后用凝胶成像仪观察结果,片段长度约1 500bp的阳性产物经纯化后送上海桑尼生物技术有限公司进行测序。测定的序列用BLAST在GenBank中搜索相近序列(http://www.ncbi.nlm.nih.gov/blast/)。将测序菌株与标准菌株的16S rDNA序列首先使用ClustalX[16]将序列进行完全比对,如果菌株与模式菌株的同源性大于99%,则可鉴定此菌株与模式菌株为同一菌株,然后用Neighbor-joining法[17]取得序列的进化距离。使用MEGA5软件[18]作出系统进化树,数据自展重抽样次数1 000次。所得菌株16S rRNA序列全部提交GenBank数据库。
1.4 454焦磷酸测序材料的获取和数据分析方法
1.4.1 基因组DNA提取
采用破碎法提取2份样品中基因组DNA。具体步骤如下:将采集的原始样品在漩涡振荡器上振荡30 s混匀,取800 μL样品于1.5 mL灭菌 EP管中。12 000 g离心10 min,弃去上清液,沉淀中加1 mL PBS缓冲液,漩涡振起。12 000 g离心10 min,弃去上清,沉淀加800 μL Tris-EDTA缓冲液,漩涡振匀后转至装有玻璃珠的破碎管中,在破碎仪上破碎3次。在破碎液中加入60 μL SDS,振匀后在4℃放置5 min。12 000 g离心10 min,转移上清液到新的1.5 mL灭菌 EP管中。加入100 μL NaCl溶液(5 mol/L),80 μL CTAB(1%,pH=8.0),65 ℃水浴 20 min。加 V(酚)∶V(三氯甲烷)∶V(异戊醇)=25∶24∶1至约1.5 mL处,颠倒混匀,静置1 min,重复3次。4℃,12 000 g离心10 min。吸取上清液转移至新的1.5 mL灭菌EP管中,加入等体积的三氯甲烷异戊醇,室温12 000 g离心5 min。收集上清液,加入0.1倍体积的醋酸钠(3 mol/L),颠倒混匀,加入1倍体积的冰异戊醇,轻柔混匀后静置20 min。12 000 g离心5 min,弃去上清液,加500 μL 70%的乙醇洗涤沉淀。弃去上清液,沉淀自然风干。沉淀加50 μL Tris-EDTA缓冲溶液回溶,冷藏备用。
1.4.2 基因组DNA扩增及焦磷酸测序
DNA扩增采用的是细菌16s rDNA V1-V3区通用引物。具体的PCR扩增引物:
正向引物为27F:5'-AGAGTTTGATCCTGGCTCAG-3’;
反向引物为533R:5'-TTACCGCGGCTGCTGGCAC-3’。
反应体系见表3:
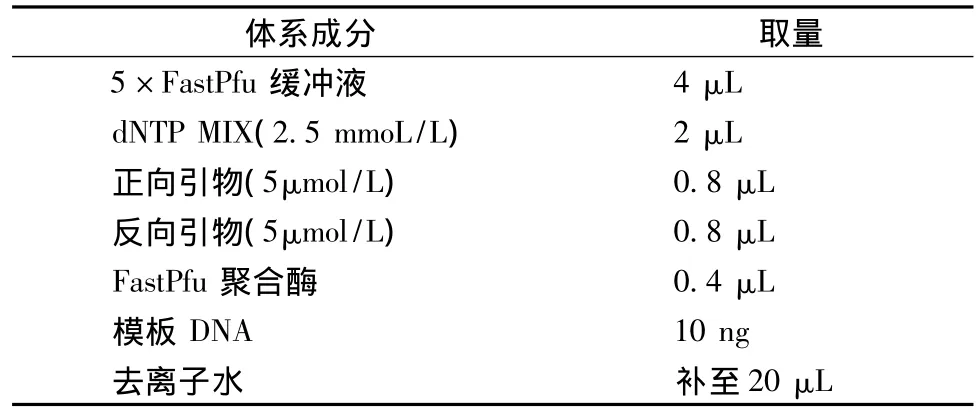
表3 PCR反应体系(20 μL)Table 3 PCR reaction system(20μL)
PCR反应产物用2%琼脂糖凝胶电泳检测合格后用于测序,焦磷酸测序按照454 Roche GS-FLX的标准流程进行。454焦磷酸测序结果已上传到MG-RAST网站,Ru12和Ru13样品编号分别为4552295.3和4552296.3。
1.4.3 数据分析
根据以下标准对原始测序序列进行筛选:
(1)长度筛选(筛选出原始序列中长度大于300 bp的序列)。
(2)引物匹配(blastn 的方法,W=4,e=0.1,找到序列上与引物匹配的片段,确定上下游引物的位置)。
(3)可变区筛选(找到引物位置后,认为两端引物之间的片段为可变区,选出其中长度大于300 bp的片段)。
(4)tag匹配(tag按照样本-tag编号筛选,不允许错配,且必须为首7位)。
(5)质量控制(整条序列上质量大于20的碱基所占比例须高于93%)。
经过以上5步筛选,认为提取出的序列是长度、质量、引物、tag均有效的高质量序列。通过序列的聚类以给定相似度0.97水平上划分操作分类单元(operational taxonomic units,OTUs),选取每一 OTU 的代表性序列进行注释。使用本地BLAST的方法比对,采用Ribosomal Database数据库。
2 结果与分析
2.1 分离菌株的鉴定
采集自俄罗斯卡尔梅克共和国埃利斯塔市郊的2份发酵蔬菜样品共分离鉴定出19株乳酸菌,分属于植物乳杆菌属(14株)、片球菌属(3株)和明串珠菌属(2株),其中Ru12样品分离鉴定出11株,Ru13样品为8株。对这些分离株进行16S rDNA序列分析并构建系统发育树,参见图1。通过BLAST序列比对分析和系统进化树分析可知:所有19株菌初步归于三大群,其中有7株菌与Lactobacillus plantarum(T)AJ965482同源性在99%以上,将其归属为Lactobacillus plantarum;有1株菌与 Lactobacillus brevis ATCC 367同源性为100%,将其归属为Lactobacillus brevis;有2株菌与Lactobacillus delbrueckii(T)ATCC 11842同源性在99%以上,将这2株菌归属为Lactobacillus delbrueckii;有1株菌与 Lactobacillus helveticus(T)AM113779同源性在99%以上,将其归为Lactobacillus helveticus;有 1株菌与 Lactobacillus kefiranofaciens AM113782同源性在99%以上,将其归属为Lactobacillus kefiranofaciens;有 2株菌与 Lactobacillus kefiri(T)AJ621553同源性在99%以上,将这2株菌归属为Lactobacillus kefiri;有1株菌与Leuconostoc lactis(T)AB023968同源性在99%以上,将其归属为Leuconostoc lactis;有1株菌与 Leuconostoc mesenteroides(T)ATCC 8293同源性为100%,将其归属为Leuconostoc mesenteroides;有2株菌与Pediococcus ethanolidurans AY956789同源性大于99%,将这2株菌归属为Pediococcus ethanolidurans;有1株菌与Pediococcus pentosaceus ATCC 25745同源性大于99%,将其归属为Pediococcus pentosaceus。对于上述分离菌株的生物学特性还需要后续的实验进行分析和验证,从而进一步筛选适合发酵蔬菜工业化生产的菌株。

图1 19株待测菌株与参考菌株16S rDNA序列系统发育树Fig.1 Phylogenetic tree of the 16S rDNA of reference strains and nineteen isolates
2.2 样品中细菌丰度和多样性分析
通过454焦磷酸测序,Ru12发酵蔬菜共得到10 869条高质量序列,Ru13样品为12 204条,经过PyNAST alignment和100%序列鉴定聚类(sequence identity clustering)分析后,共得到2 664条代表性序列。继而在97%相似度水平上划分OTU,Ru12和Ru13样品分别发现148个和123个细菌OTU。
由图2可知,2份发酵蔬菜的稀疏曲线均未进入平台期,这表明随着测序量的增加新的种系型有可能被发现,但同时Shannon曲线已经饱和,表明随着测序量的增加细菌的多样性已经不再随之发生变化。
对于一个试验中至少需要多少条高质量的16S rRNA序列才能满足后续的科研分析一直是科研人员比较关心的问题。既往研究表明,如果只是在门的水平上分析样品中微生物组成,那么几百条高质量的454焦磷酸测序序列就足够了,而如果要检测样品中多数优势微生物的菌群结构,几千条序列足以达到实验目的[19]。本实验中2个样品测序量都已到达一万以上,结合以往的经验,在该测序水平上测序结果已能够充分揭示2份样品中细菌的组成。
通过chao1指数对样品的丰度进行比较,Ru12和Ru13两份样品的chao1指数分别为233.8和171.0,表明Ru12样品中细菌的丰度比Ru13样品要高。通过simpson指数对样品的多样性进行比较分析,Ru12和Ru13两份样品的simpson指数分别为0.527和0.534,这表明2份样品中细菌的多样性差别不大。
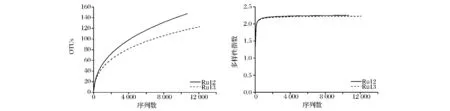
图2 两份发酵蔬菜样品的稀疏曲线和Shannon曲线Fig.2 Rarefaction analysis and shannon diversity index of two fermented vegetable simples
2.3 样品中细菌相对含量的比较分析
通过在97%相似度上划分OTU,每一OTU选取出现次数最多的序列为代表性序列,采用本地BLAST的方法进行注释,在门的水平上,两份样品都主要由硬壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)组成,在Ru12样品中,上述门类细菌的含量分别为96.26%、3.66%、0.04%、0.02%,在Ru13样品中,其含量分别为 97.64%、2.27%、0.07%、0.02%,参见图3、图4。

图3 两份发酵蔬菜样品中细菌的组成Fig.3 Compositions of bacteria in two fermented vegetable samples
由图3、图4可知,在属的水平上,2份样品中含量最高的细菌属主要包括乳杆菌属(Lactobacillus)、乳球菌属(Lactococcus)、弧菌属(Vibrio)、片球菌属(Pediococcus)、肠球菌属(Enterococcus)、克鲁维菌属(Kluyvera)等。在Ru12样品中这些菌属的相对含量依次为 89.41%、3.95%、3.14%、1.61%、0.64%、0.08%,在Ru13样品中的相对含量依次为93.65%、3.69%、1.69%、0.7%、0.08%、0.21%。由此可见,在2份样品中,占据支配地位的菌属都是乳杆菌属(Lactobacillus),其次为乳球菌属(Lactococcus)和弧菌属(Vibrio)。上述实验结果也与乳酸菌分离鉴定中分离到的乳杆菌属的数量占到绝大多数的结果相吻合。通过上述结果我们还发现了一个有意思的现象,在2份样品中弧菌属(Vibrio)都占据了其中相当大的比例,而该菌属的很多种类是具有致病性的,对于样品中弧菌属的来源我们还需进一步研究。
Ji[20]等采用454焦磷酸测序技术对韩国传统发酵蔬菜Kimchi中的微生物组成进行了分析,结果发现在Kimchi中最主要的细菌属依次为明串珠菌属(Leuconostoc)、乳杆菌属(Lactobacillus)和魏斯氏菌属(Weissella),而明串珠菌属(Leuconostoc)和魏斯氏菌属(Weissella)在本文所研究的样品中相对含量都很低。这说明不同地区、不同发酵蔬菜种类中微生物的构成存在很大差异,可能正是这些微生物构成的差异造就了不同发酵蔬菜所特有的口感和风味。
3 结论
本研究通过对采集自俄罗斯卡尔梅克共和国埃利斯塔市郊的2份发酵蔬菜采用纯培养结合16S rRNA序列比对分析的方法,共从2份样品中分离出19株乳酸菌,并对其进行了准确的鉴定和分型,鉴定结果为7株Lactobacillus plantarum;1株Lactobacillus brevis;2株Lactobacillus delbrueckii;1株Lactobacillus helveticus;1株Lactobacillus kefiranofaciens;2株Lactobacillus kefiri;1株Leuconostoc lactis;1株Leuconostoc mesenteroides;2株Pediococcus ethanolidurans;1株Pediococcus pentosaceus。同时运用454焦磷酸测序技术,本研究从宏基因组水平分析了2份发酵蔬菜样品中细菌的丰度和多样性,发现隶属于硬壁菌门(Firmicutes)的乳杆菌属(Lactobacillus)和乳球菌属(Lactococcus)是2份样品中的优势菌属,这也证实了之前通过纯培养方法得到的部分研究结论。此外,通过454焦磷酸测序技术我们对发酵蔬菜中细菌的丰度和多样性有了一个更加全面深入的认识。例如,我们在研究中还发现了样品中部分有害菌属的存在,这是之前研究未曾报道的现象。上述研究成果对于发酵蔬菜工业化生产的发展具有积极的促进作用。

图4 两份发酵蔬菜样品中细菌相对含量的比较Fig.4 Relative abundance of bacteria in two fermented vegetable samples
[1] Park J M,Shin J H,Lee D W,et al.Identification of the lactic acid bacteria in kimchi according to initial and overripened fermentation using PCR and 16S rRNA gene sequence analysis[J].Food Science and Biotechnology,2010,19(2):541-546.
[2] Shin M S,Han S K,Ryu J S,et al.Isolation and partial characterization of a bacteriocin produced by Pediococcus pentosaceus K23-2 isolated from Kimchi[J].Journal of Applied Microbiology,2008,105(2):331-339.
[3] Kim M,Chun J.Bacterial community structure in kimchi,a Korean fermented vegetable food,as revealed by 16S rRNA gene analysis[J].International Journal of Food Microbiology,2005,103(1):91-96.
[4] Ha J H.Changes of free sugars in Kimchi during fermentation Jae-Ho Ha,Wooderck S.Hawer,Young-Jin Kim and Young-Jung Nam[J].Changes,1989,21(5):633-638.
[5] Amann R I,Ludwig W,Schleifer K H.Phylogenetic identification and in situ detection of individual microbial cells without cultivation[J].Microbiological Reviews,1995,59(1):143-169.
[6] Quigley L,O'Sullivan O,Beresford T P,et al.Highthroughput sequencing for detection of subpopulations of bacteria not previously associated with artisanal cheeses[J].Applied and Environmental Microbiology,2012,78(16):5 717-5 723.
[7] Masoud W,Takamiya M,Vogensen F K,et al.Characterization of bacterial populations in Danish raw milk cheeses made with different starter cultures by denaturating gradient gel electrophoresis and pyrosequencing[J].International Dairy Journal,2011,21(3):142-148.
[8] Dobson A,O'Sullivan O,Cotter P D,et al.High-throughput sequence-based analysis of the bacterial composition of kefir and an associated kefir grain[J].FEMS Microbiology Letters,2011,320(1):56-62.
[9] Leite A M O,Mayo B,Rachid C,et al.Assessment of the microbial diversity of Brazilian kefir grains by PCR-DGGE and pyrosequencing analysis[J].Food Microbiology,2012,31(2):215-221.
[10] Jung M J,Nam Y D,Roh S W,et al.Unexpected convergence of fungal and bacterial communities during fermentation of traditional Korean alcoholic beverages inoculated with various natural starters[J].Food Microbiology,2012,30(1):112-123.
[11] 小崎道雄,内村泰,岡田早苗.乳酸菌実験マニュアル[J].东京:朝倉書店,1992:36-59.
[12] 辨野義己.乳酸菌の分類[J].微生物,1990,6:3-14.
[13] Sneath P H A,Mair N S,Sharpe M E,et al.Bereys manual of systematic bactetiology.Vol.2[M].Williams 8L Wilkins,1986.
[14] 凌代文.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999.
[15] F奥斯伯,R布伦特(颜子颖,王海林,译).精编分子生物学实验指南[M].北京:科学出版社,1998.
[16] Thompson J D,Gibson T J,Plewniak F,et al.The CLUSTAL_X windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools[J].Nucleic Acids Research,1997,25(24):4 876-4 882.
[17] Saitou N,Nei M.The neighbor-joining method:a new method for reconstructing phylogenetic trees[J].Molecular Biology and Evolution,1987,4(4):406-425.
[18] Tamura K,Dudley J,Nei M,et al.MEGA4:molecular evolutionary genetics analysis(MEGA)software version 4.0[J].Molecular Biology and Evolution,2007,24(8):1 596-1 599.
[19] Hamady M,Knight R.Microbial community profiling for human microbiome projects:Tools,techniques,and challenges[J].Genome Research,2009,19(7):1 141-1 152.
[20] Jung J Y,Lee S H,Kim J M,et al.Metagenomic analysis of kimchi,a traditional Korean fermented food[J].Applied and Environmental Microbiology,2011,77(7):2 264-2 274.

