脐橙中6种功效成分RP-HPLC检测方法的建立
勾中智,徐维盛,刘静,易有金,杨月欣,*
(1.湖南农业大学食品科技学院,湖南长沙410128;2.中国疾病预防控制中心营养与食品安全所,北京100050;3.北京市科学技术研究院北京市营养源研究所,北京100069)
脐橙,属无患子目、芸香科、柑橘属类水果[1]。柑橘类水果富含多种活性成分,对人体健康有预防和保健的作用,目前已经从柑橘中鉴定出的类黄酮物质有60多种[2],主要包括:黄酮类、黄酮醇类、黄烷酮类以及花色苷类,其中黄烷酮类含量最高,约占类黄酮总量的80%[3],柠檬苦素类化合物柠檬苦素及诺米林也具有较高的含量。目前,柑橘类水果中黄酮类及柠檬苦素类功效成分的检测方法主要包括高效液相色谱法[4-9]、超高效液相色谱技术(UPLC)[10-11]、液-质联用技术(LC-MS)[12-15]、液-核联用技术(LC-NMR)[16]等。目前柚皮苷、橙皮苷、柚皮素、橙皮素、柠檬苦素、诺米林等6种黄酮类和柠檬苦素类物质的同时检测方法尚未见文献报道,本文首次建立了该6种功效成分同时检测的RP-HPLC检测方法,并测定了其在脐橙中的含量,获得了满意的结果。
1 材料与方法
1.1 仪器
Agilent 1260型高效液相色谱仪,DAD检测器,四元梯度泵,Chemical station色谱工作站:美国安捷伦公司;ME235S型分析天平:德国Sartorius集团;EYECA OSB-2100型旋转蒸发仪:上海爱朗仪器有限公司;SHB-Ш型循环水式多用真空泵:郑州长城科工贸有限公司;YKKY DX-208型低温循环机:北京长流科学仪器公司;KQ-500 DE型数控超声波清洗器:昆山市超声仪器有限公司。
1.2 标准品与样品
柚皮苷(批号:15495000-20917)、橙皮苷(批号:14140000-10428),均购于 Dr.Ehrenstorfer GmbH;柚皮素(批号:CDHJ-STA-02206006)、橙皮素(批号:CDHJSTA-67900000)、柠檬苦素(CDHJ-STA-28543004)、诺米林(批号:CDHJ-STA-77000000)均购于上海诗丹德生物技术有限公司;赣南脐橙和秭归脐橙由江西省脐橙工程技术研究中心提供;美国新奇士脐橙购于北京新发地水果市场。
1.3 试剂
乙腈(色谱纯,Fisher Chemical);磷酸(分析纯,北京化学试剂公司);甲醇(分析纯,北京化学试剂公司);二甲基亚砜(分析纯,天津光复化学试剂公司);实验用水为双蒸水。
1.4 方法
1.4.1 样品提取
脐橙去皮,将可食部分匀浆处理,称取5.0 g,按照1∶10(g/mL)料液比加入80%甲醇水和二甲基亚砜(v∶v=1 ∶1),超声辅助提取,提取 30 min,过滤,滤渣重复提取一次,合并两次滤液,用80%甲醇水和二甲基亚砜(v∶v=1∶1)定容于100 mL容量瓶中,作为供试品溶液,使用前过0.45 μm滤膜。
1.4.2 色谱条件
色谱柱:色谱柱:Agilent Eclipse XDB C18(4.6×250 mm,5 μm);流动相:A 相:0.1%磷酸水;B 相:乙腈,梯度洗脱:梯度洗脱,A相:0.1%磷酸水;B相:乙腈,洗脱程序:23%B 等度(0~5 min);23%~55%B 线性变换(5 min~10 min);55%B 等度(10 min~25 min);检测波长:波长切换技术,0~13 min:285 nm;13 min~25 min:210 nm。柱温:30℃;流速:1.0 mL/min;进样量:10 μL。
1.4.3 标准品溶液配制
1.4.3.1 单一标准溶液的配制
分别精密称取柚皮苷、橙皮苷、柠檬苦素、诺米林各4.0 mg分别置于25 mL容量瓶中,橙皮素、柚皮素各4.0 mg分别置于100 mL容量瓶中,用80%甲醇水和二甲基亚砜(v∶v=1∶1)溶解,配制成浓度分别为160、40 μg/mL 单一标准溶液。
1.4.3.2 混合标准溶液的配制
分别精密称取柚皮苷、橙皮苷、柠檬苦素、诺米林各8.0 mg,橙皮素、柚皮素各2.0 mg分别置于500 mL容量瓶中,用80%甲醇水和二甲基亚砜(v∶v=1∶1)溶解,配制成与单标浓度相同的混标溶液。
1.4.4 系统适用性
取浓度分别为160.0、40.0 μg/mL的6种标准物质单标、混标溶液,分别量取10 μL注入高效液相色谱仪,进样分析,采用单标、混标通过保留时间(±5%)及用标样增高法对待测样品中的检测成分进行定性分析,以对称因子为指标,考察色谱系统适用性。
1.4.5 线性与范围
按1.4.3.2项下方法配制混合标准品溶液,精密吸取 0.1、1、3、5、7、10 mL 至 10 mL 容量瓶中,并用 80%甲醇水和二甲基亚砜(v∶v=1∶1)的溶液定容至刻度,获得6个不同浓度的系列标准溶液,精密量取10 μL注入高效液相色谱仪,进样分析。
1.4.6 精密度试验
量取浓度分别为160 μg/mL(柚皮苷、橙皮苷、柠檬苦素、诺米林)及40 μg/mL(橙皮素、柚皮素)的混合标准溶液10 μL注入高效液相色谱仪,按1.4.2项下色谱条件进样分析,重复进样5次,以色谱峰面积为指标考察仪器精密度。
1.4.7 重复性试验
取1#赣南脐橙5 g,加入混合标准品溶液5 mL,按照1.4.1项下方法提取,获得供试品溶液,分别量取10 μL注入高效液相色谱仪,按1.4.2项下色谱条件进样分析,计算6份样品峰面积的RSD值,考察重复性试验。
1.4.8 溶液稳定性试验
取同一份对照品溶液,室温静置,分别于第0、2、4、6、8、12、24 h,量取 10 μL 注入高效液相色谱仪,按1.4.2项下色谱条件进样分析,分别计算不同时间点色谱峰面积的RSD值,考察样品溶液稳定性。
1.4.9 回收率试验
取浓度分别为160 μg/mL(柚皮苷、橙皮苷、柠檬苦素、诺米林)及40 μg/mL(橙皮素、柚皮素)的混合标准溶液,稀释100倍作为小标溶液,按外标法计算获得1#赣南脐橙中该6种功效成分的含量,均匀取样3份,每份5 g,分别定量加入混合标准品溶液5.0 mL,按照1.4.1项下方法提取,量取10 μL注入高效液相色谱仪,按1.4.2项下色谱条件进样分析,测定样品的回收率。
1.4.10 定量限与检测限
按1.4.3.1项下方法配置单一标准溶液,采用逐级稀释法,按S/N为10计算定量限(LOQ),按照S/N=3计算检测限(LOD)。
2 结果
2.1 系统适用性
脐橙中6种功效成分HPLC检测色谱图见图1所示。

图1 标准品及样品HPLC色谱图Fig.1 HPLC chromatogram of standards and samples
结果表明,6种标准品在16 min内能完全分离,且理论塔板数均> 3000,分离度R均>1.5,各目标物质峰的对称性也较好,各标准品化合物的保留时间具有较好的重现性(±5%)。
2.2 线性与范围
以对照品溶液浓度为横坐标(X),以色谱峰面积为纵坐标(Y),绘制标准曲线,计算回归方程及相关系数 R2。结果表明,在浓度 2 μg/mL~266 μg/mL 浓度范围内,柚皮苷、橙皮苷、柚皮素、橙皮素、柠檬苦素、诺米林等6种成分均具有良好的线性,结果见表1。
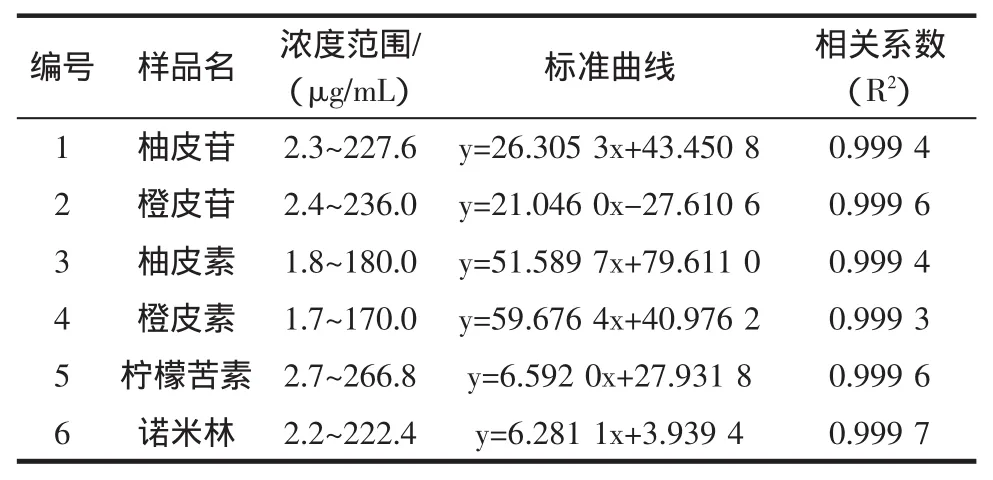
表1 6种功效成分化合物的线性范围、回归方程及相关系数Table 1 Linear ranges,regression equations and correlation coefficients of 6 functional components
2.3 精密度
6种标准品柚皮苷、橙皮苷、柚皮素、橙皮素、柠檬苦素、诺米林5次重复进样峰面积RSD值分别为0.68%、0.94%、0.29%、0.29%、0.62%、0.16%,均<2%,结果表明精密度良好。
2.4 重现性
6份样品6种对照品柚皮苷、橙皮苷、柚皮素、橙皮素、柠檬苦素、诺米林峰面积的RSD值分别为:0.37%、0.59%、0.77%、0.58%、0.94%、0.56%,均<2%,表明重复性良好。
2.5 溶液稳定性
6种标准品柚皮苷、橙皮苷、柚皮素、橙皮素、柠檬苦素、诺米林24 h内峰面积RSD值分别为1.62%、0.37%、1.43%、0.91%、1.25%、1.38%,均<2%,表明6种功效成分在24 h内溶液稳定性良好。
2.6 回收率试验
6种功效成分的平均回收率在94.6%~111.9%,结果表明6种功效成分均具有良好的回收率,结果见表2。

表2 回收率检测结果Table 2 Recoveries of the 6 kinds of functional components
2.7 定量限与检测限
经计算,柚皮苷、橙皮苷、柚皮素、橙皮素、柠檬苦素、诺米林的定量限分别为 1.59、0.74、0.62、0.40、0.47、4.77 ng;检测限分别为:0.48、0.22、0.18、0.12、0.14、1.43 ng。
2.8 含量测定
1#赣南脐橙、2#秭归脐橙、3#新奇士脐橙样品的含量结果见表3。

表3 脐橙中功效成分含量测定结果Table 3 Determination results of functional components in navel orange mg/kg
结果表明3种脐橙中黄酮类物质中含量最高为橙皮苷,顺序为赣南脐橙>秭归脐橙>新奇士脐橙,其中赣南脐橙高达 3302.3 mg/kg,3种脐橙中新奇士脐橙中柠檬苦素含量较高,达到176.64 mg/kg,秭归脐橙中诺米林含量较高,达到125.3 mg/kg。
3 结论与讨论
3.1 样品的提取制备
目前黄酮类物质提取超声辅助提取法采用较多,均已取得较高的提取率[7,9-10];本论文选择超声辅助提取,考虑到柠檬苦素类物质特殊的溶解性能。选80%甲醇水和二甲基亚砜(v∶v=1∶1)为提取溶剂,采用四因素三水平(提取液体积分数、提取时间、料液比和提取次数)正交试验,确定最佳提取方法:80%甲醇和二甲基亚砜(v∶v=1∶1),超声提取时间 30 min,料液比1∶10,提取次数2次。
3.2 检测波长的选择
利用二极管阵列检测器对6种功效成分进行扫描,结果显示:柚皮苷、橙皮苷、柚皮素、橙皮素在285 nm波长均有最大特征紫外吸收,柠檬苦素、诺米林在200 nm~400 nm波长范围内没有特征紫外吸收,为末端吸收,经HPLC方法学考察,本论文最终选择双波长切换技术,使得各种化合物均在其最大紫外吸收波下检测,其色谱响应值最大,获得了满意的结果。
3.3 流动相的选择
由于选择的6种功效成分结构类型差异较大,等度洗脱分析时间较长,导致色谱峰柱效降低,为提高柱效节约时间,本实验选择梯度洗脱程序。流动相分别实验了乙腈、甲醇与0.05%、0.1%、0.5%三个不同浓度的甲酸水、磷酸水的不同配比,考察了流动相对样品分离度及柱效的影响。实验结果表明,乙腈、甲醇均可实现6种功能成分的分离,但乙腈洗脱能力较强,可节约时间,提高柱效,故选择乙腈为有机相。水相中酸的加入可有效抑制化合物色谱峰的拖尾现象,改善色谱峰峰型,提高色谱峰对称性,但流动相的pH过低会降低色谱柱的使用寿命,综合考虑色谱峰柱效及色谱柱的pH耐受范围,选择0.1%磷酸水为水相,对该6种黄酮类和柠檬苦素类化合物在16 min内均达到基线分离,且均具有较高的柱效。
3.4 结论
本论文建立了同时检测4种黄酮类功效成分(柚皮苷、橙皮苷、柚皮素、橙皮素)及2种柠檬苦素类功效成分(柠檬苦素、诺米林)的RP-HPLC检测方法,方法学验证结果表明,建立的方法可靠、准确,可用于脐橙类水果中柚皮苷、橙皮苷、柚皮素、橙皮素、柠檬苦素、诺米林等6种功效成分的含量测定。
[1] 国家药典委员会.中华人民共和国药典[S].北京:化学工业出版社,2005:132
[2] 贾冬英,姚开,谭敏,等.柚果皮中生理活性成分研究进展[J].食品与发酵工业,2002,27(11):74-77
[3] 吴桂苹,苏学素,焦必宁,等.柑橘活性成分检测技术研究进展[J].食品与发酵工业2006,32(9):116-117
[4] Nogata Y,Sakamoto K,Shiratsuchi H,et al.Flavonoid composition of fruit tissues of citrus species[J].Bioscience,Biotechnology and Biochemistry,2006,70(1):178-192
[5] GoulasV,Manganaris G A.Exploring the phytochemical content and the antioxidant potential of citrus fruits grown in Cyprus[J].Food Chemistry,2012,131:39-47
[6] Ramful D,Tarnus E,Aruoma O I,et al.Polyphenol composition,vitamin C content and antioxidant capacity of Mauritian citrus fruit pulp[J].Food Research International,2011,44(7):2088-2099
[7] 徐维盛,李东,刘静,等.果酒中11种酚类化合物反相高效液相色谱检测方法的建立[J].卫生研究,2013,42(3):163-170
[8] 刘亮,戚向阳,董绪燕,等.高效液相色谱法测定柑橘中的柠檬苦素类似物[J].食品与发酵工业,2007,34(4):130-132
[9] 孙崇德,陈昆松,陈青俊,等.柑桔果实中天然柠檬苦素和诺米林的提取、鉴别与检测[J].中国食品学报,2004,4(1):7-10
[10]廖春燕,朱海东.超声波法提取橘皮中黄酮物质的研究[J].四川食品与发酵,2007,43(3):32-34
[11]李志辉,肖晖,孟军华,等.超高效液相色谱法同时测定柑橘属类药材中4种黄酮类成分[J]中国医院药学杂志,2012,32(20):1683-1684
[12]孟鹏,郑宝东.超高效液相色谱法快速并同时检测金柑中柠檬苦素和诺米林[J]中国食品学报,2013,12(2):17-18
[13]周大勇,徐青,薛兴亚,等.高效液相色谱-电喷雾质谱法测定枳壳中黄酮苷类化合物[J].分析化学,2006,34(特刊):31-35
[14]Manners G D,Breksa A P,Schoch T K,et al.Analysis of bitter limonoids in citrus juices by atmospheric pressure chemical ionozation and electrospray ionization liquid chro-matography-mass spectrometry[J].J Agric Food Chem,2003,51(6):3709-3714
[15]贾强,白杨,马燕,等.枳壳和枳实化学成分的HPLC-ESI-MS分析[J]中草药,2005,36(2):169-172
[16]胡灵.玉环柚柚皮中黄酮类化合物提取-分离及指纹图谱的研究[D]浙江工业大学,2011(4):59-64

