顺铂作用下卵巢癌细胞株CP70中Eps8表达变化研究*
第四军医大学西京医院妇产科(西安710032) 王 冰 杨 勇 辛晓燕
表皮生长因子受体通路底物8(Epidermal growth factor receptor pathway substrate 8,Eps8)为广泛表达的多域信号转导蛋白,调节着细胞两种完全不同的GTP依赖型生物机制:通过Ras/Rac通路影响肌动蛋白骨架的重组,以及通过Rab通路影响受体介导的细胞内吞作用[1]。近年来,许多学者[2,3]应用 RT-PCR(实时荧光PCR技术)、Western blot(蛋白质印迹法)、微阵列技术、基因敲除技术等实验方法发现,Eps8在乳腺癌、宫颈癌、胰腺癌、神经胶质瘤、恶性血液系统疾病等实体肿瘤中表达异常升高,而在正常组织中未见表达或者表达较低。继而通过分子生物实验发现Eps8通过调节细胞肌动蛋白骨架影响肿瘤细胞的转移和侵袭,通过调节胞质中的溶酶体对肿瘤细胞的自噬作用,影响肿瘤的转移。但有关Eps8在卵巢癌方面的研究,国内外报道较少。本实验通过 RT-PCR、Western blot方法检测卵巢癌顺铂敏感细胞株A2780、耐药细胞株CP70、卵巢癌细胞株SKOV3、顺铂耐药株SKOV3/DDP中Eps8在mRNA及蛋白水平的表达情况,发现Eps8在顺铂耐药细胞株CP70中高表达,采用不同浓度DDP(顺铂)处理CP70细胞后检查Eps8蛋白表达变化情况,探讨该蛋白表达的变化与DDP作用于CP70发生耐药之间的关系,以期为卵巢癌治疗提供新的思路。
材料和方法
1 细胞株和主要试剂 A2780、CP70、SKOV3、SKOV3/DDP细胞株由第四军医大学西京医院妇产科实验室长期冻存留种。DDP为山东齐鲁制药厂产品,DMEM/低糖、1640培养基、FBS(胎牛血清)、Penicillin-Streptomycin、胰酶均为 Hyclone产品,逆转录酶(北京天根生物技术有限公司),Real-time PCR试剂盒(南京百斯凯科技有限公司,全式金cat:AQ131-01),TRIZOL(南京百斯凯科技有限公司,全式金cat:ET111-01,lot:H10318),氯仿、异丙醇 (分析纯),RNA溶解液(南京百斯凯科技有限公司,全式金cat:ET111-02,lot:H10323),DEPC(北京博奥拓达科技有限公司 Amresco cat:E174),引物合成(上海生工):hEPS8F5’-GATGTCATTGGGAGGAACTTG-3’,hEPS8R5’-ATAAAGTTCAGCATTGGGGG-3’,hActin F 5’-GATGAGATTGGCATGGCTTT-3’,hActin R 5’-GTCACCTTCACCGTTCCAGT-3’。PMSF(南京沃宏Amresco,cat:329-98-6),cocktail(上海源 叶 生 物 科 技 有 限 公 司 cat:26305-03-3,lot:10557),PBS(pH7.0),脱 脂 奶 粉 (伊 利 cat:66196131T),兔抗人Eps8单克隆抗体(美国Abcam公司),actin(杭州华安生物cat:1854-s),羊抗鼠二抗(南京伯利德生物cat:Abmart M21001L),羊抗兔二抗(上海华安生物cat:HA1001)。
2 方 法
2.1 A2780CP70SKOV3SKOV3/DDP四株卵巢癌细胞中EPS8的mRNA表达水平的检测:收集细胞,PBS离心洗涤2次,弃上清。往细胞沉淀中加入1ml的 Trizol,提取 A2780、CP70、SKOV3、SKOV3/DDP细胞总RNA。取总RNA 1μl进行反转录反应。反应条件为:70℃5min,冰上冷却2min,42℃50min,95℃5min,将反转录产物置-20℃保存备用。取cDNA 2μl作为模板,建立25μl反应体系,反应条件为:95℃3min,95℃30s,55℃20s,72℃20s,共进行40个循环,72℃延伸10min,最后一步溶解曲线反应条件:95℃15s,60℃15s,20min升温,95℃15s。采用RQ=2-△△CT进行计算相对表达量,以内参基因actin为标准。CT值指反应管内的荧光信号到达设定的阈值时所经历的循环数。数据分析用的是EXCEL,作图用的是Graphpad prism 5软件,主要是利用t检测是否有显著性差异。
2.2 Western blot:检测卵巢癌细胞株中 EPS8的蛋白表达水平:取对数生长期的细胞,去除培养液,4℃预冷的PBS清洗2次,加入蛋白裂解液100μl,冰上裂解30min,于4℃下12000rpm离心15min后,吸取上清液,BAC法测定蛋白浓度,将离心后的上清加入loading buffer,100℃5min,然后放于-80℃保存。将蛋白样品与SDS蛋白上样缓冲液混合后于100℃处理5min,每孔上样100μg细胞总蛋白,电泳时浓缩胶电压为70V;当溴酚蓝品进入浓缩胶时,电压为110V;待溴酚蓝到达胶底部后,将蛋白电转至PVDF膜,丽春红染色,封闭液室温封闭1h后,加入适量的一抗,4℃孵育过夜。以内参基因actin为标准,TBST清洗后,加入相应二抗室温孵育1h,TBST洗膜后,用ECL Reagent显色,应用Alpha Innotech系统对PVDF膜进行扫描及图像分析。
2.3 DDP处理后 Western blot检测卵巢癌细胞CP70中Eps8的蛋白表达水平:CP70细胞种于6孔板内,加入不同浓度(0μM、10μM、20μM、40μM)DDP并于24h和48h后收集细胞。实验步骤同上。
2.4 统计学方法:以SPSS17.0统计分析软件进行统计学处理。数据以均数±标准差(mean±SD)表示。P<0.05为具有统计学差异,P<0.01为具有统计学显著差异。
结 果
1 实时荧光定量PCR结果 在4株卵巢癌细胞中,Eps8在顺铂耐药细胞株CP70中的mRNA表达最高,而在顺铂敏感株A2780中mRNA的表达最低:耐药株CP70中Eps8mRNA是敏感株A2780的117倍,差异有统计学意义(图1)。
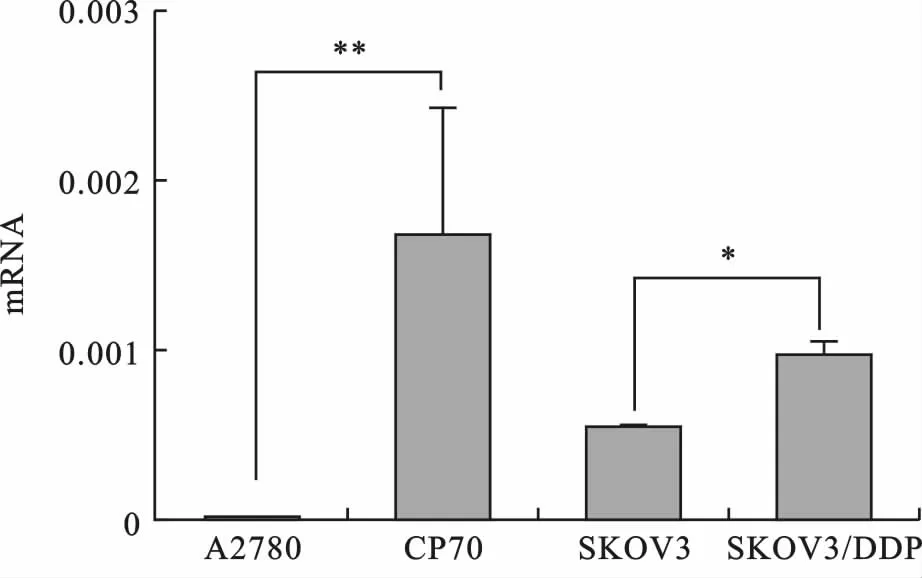
图1 实时荧光定量PCR-数据分析
2 Western blot结果 在内参蛋白表达一致的情况下,卵巢癌顺铂耐药细胞株CP70中Eps8蛋白表达明显高于其他三种细胞株(图2)。
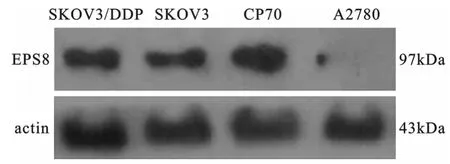
图2 WB检测EPS8蛋白表达变化
3 顺铂处理后Eps8的表达变化 实验以Eps8高表达的卵巢癌顺铂耐药细胞株CP70为研究对象,采用不同浓度(10μM、20μM、40μM)的顺铂处理细胞24h、48h,以不加顺铂为空白对照组(Control)。Western blot结果表明,随着顺铂浓度的逐渐增加,Eps8的蛋白水平表达增高,随着顺铂作用时间的延长,Eps8的蛋白表达呈现明显增强趋势(图3~4)。

图3 DDP处理24h后EPS8蛋白表达水平

图4 DDP处理48h后EPS8蛋白表达水平
讨 论
Eps8作为接受器型的酪氨酸激酶受体(RTKS),受表皮生长因子受体(EGFR)以及其他RTKS磷酸化而激活。Eps8与EGFR结合后,细胞的DNA合成和癌化能力增加[4]。Eps8也是一个肌动蛋白骨架。Maria等[5]在多形胶质细胞瘤(GBM)的三种不同细胞株中进行2D和3D实验,发现通过损伤细胞骨架的突出结构,可以达到抑制肿瘤侵袭的作用。而通过siRNA沉默Eps8,可以消除肿瘤细胞的迁移和侵袭能力。研究证实,Eps8可以调节表皮生长因子EGF依赖的小G蛋白Rac的活性,进而调控细胞骨架肌动蛋白的构建和重排[6]。Eps8还调节Rab5的活性,参与受体介导的细胞内吞作用,影响Ras和Rac之间的信号转导[7]。此外,Eps8还参与多种肿瘤细胞的增殖和转移,增强促有丝分裂信号的释放,导致肿瘤细胞的恶变[8]。Thilo Welsch等[9]发现内源性 Eps8在转移性胰腺癌细胞株AsPC-1和Capan-1中定位于大泡溶酶体中,并且高表达。Eps8的异位表达增加了溶酶体的大小。结构功能分析显示,调节溶酶体改变的区域位于Eps8的氨基酸184~535片断。值得注意的是,此片断包含2个类似分子伴侣介导的细胞自噬作用所需要的KFERQ序列。此外,Eps8与Hsc70和LAMP-2的共同免疫沉淀反应物是细胞自噬作用下降的关键因素。这些研究说明,在人类的一些肿瘤细胞中,Eps8通过定位于溶酶体,进而调节细胞的自噬作用,促进了癌症肿瘤细胞的转移。Yao等[10]应用基因表达序列分析技术和cDNA阵列比较基因组杂交技术对乳腺癌细胞进行分析,结果发现,Eps8是一个肿瘤相关蛋白。有文献报道,光辉霉素(Mithramycin)通过抑制Src的表达,从mRNA水平及蛋白水平减少了Eps8的表达,从而降低了人类上皮癌细胞的增殖和迁移能力[10]。Gan[11]等应用蒽环类抗肿瘤药物 DNR(柔红霉素)作用于急性髓系白血病细胞株KGla,结果发现,DNR对KGla细胞的增殖有明显抑制作用,Eps8的mRNA及蛋白表达均呈下降趋势,因此推测DNR对于KGla细胞的杀伤抑制作用的机制之一可能是降低Eps8的表达。DDP是铂类化疗药物中最早被合成出来的,与光辉霉素、DNR同属于细胞周期非特异性药物,其作用机理主要是顺铂与DNA单链内两点或双链发生交叉联结,抑制癌细胞的DNA复制过程,导致细胞凋亡[12]。本实验应用 RT-PCR、Western blot技术从mRNA水平和蛋白水平检测Eps8在卵巢癌细胞株中的表达。结果发现,在4株卵巢癌细胞中,耐药细胞株CP70中Eps8mRNA和蛋白表达最高,而和它配对的顺铂敏感细胞株A2780中Eps8mRNA和蛋白也有表达,相对较低。同样的趋势出现在SKOV3和SKOV3/DDP这对细胞中。为了进一步明确Eps8与卵巢癌顺铂耐药之间关系,实验设计了不同剂量、不同作用时间的顺铂作用于高表达Eps8的顺铂耐药细胞株CP70,结果发现,顺铂处理CP70细胞后,Eps8的蛋白表达量增高,且和DDP作用的时间及剂量有依赖性,即DDP可诱导CP70细胞中Eps8表达的上调。因此推测,Eps8可能在卵巢癌顺铂耐药形成机制中发挥重要作用。
综上所述,Eps8的表达情况一定程度上反应了卵巢癌细胞对顺铂的化疗敏感性,这就为我们研究卵巢癌顺铂化疗耐药提供了一条新思路,Eps8是否可以成为一个新型肿瘤化疗耐药的临床检测指标,为临床化疗方案的选择及评价预后提供有效依据?本研究为进一步探索Eps8在卵巢癌化疗耐药中的作用提供了实验依据,也为卵巢癌的基因治疗提供新的思路。
[1] Sekerkováa G,Dihoa M R,Ilijicb E,et al.Postsynaptic
enrichment of Eps8at dendritic shaft synapses of unipolar brush cells in rat cerebellum[J].Neuroscience,2007,145:116-129.
[2] Chu PY,Liou JH,Lin YM,et al.Expression of Eps8 correlates with poor survival in oral squamous cell carcinoma[J].Asia Pac J Clin Oncol,2012,8(4):e77-e81.
[3] 熊文艳,陆志刚,涂三芳,等.Eps8在恶性血液肿瘤细胞株中的表达分析[J].山东医药,2011,51(12):9-11.
[4] Jiang Z,Guis,ZhangY.Analysis of differential gene expression in plurihormonal pituitary adenomas using beadbased fiber-optic arrays[J].J Neurooncol,2012,108:341-348.
[5] Maria Grazia Cattaneo,Elisa Cappellini,Lucia M.Vicentini.Silencing of Eps8blocks migration and invasion in human glioblastoma cell lines[J].Experimental Cell Research,2012,318(15):1901-1912.
[6] Goh WI,Lim KB,Sudhaharan T,et al.mDial and WAVE2 proteins interact directly with IRSp53in filopodia and are involved in filopodium formation[J].J Biol Chem,2012,287:4702-4714.
[7] Bashir M,Kirmani D,Bhat HF,et al.P66shc and its downstream Eps8and Racl proteins are upregulated in e-sophageal cancers[J].Cell Commun Signal,2010,8:13.
[8] Wang H,Pate IV,Miyazaki H,et al.Role for EPS8in squamous carcinogensis[J].Carcinogenesis,2009,30:165-174.
[9] Thilo Welsch,Alexander Younsia,Andrea Disanzab,et al.Eps8is recruited to lysosomes and subjected to chaperone-mediated autophagy in cancer cells[J].Experimental Cell Research,2010,316(12):1914-1924.
[10] Yao J,Weremowicz S,Feng B,et al.Combined cDNA array comparative genomic hybridization and serial analysis of gene expression analysis of breast tumor progression[J].Cancer Res,2006,66(8):4046-4076.
[11] Maa MC,Lai JR,Lin RW,et al.Enhancement of tyrosyl phosphorylation and protein expression of Eps8by v-Src[J].Biochim Biophys Acta,1999,1450(3):341-351.
[12] Kurzeder C,Sauer G,Deissler H.Molecular targets of ovarian carcinomas with acquired resistance to platinum/taxane chemotherapy[J].Curr Cancer Drug Targets,2006,6(3):207-227.

