辛伐他汀对大鼠冠脉微栓塞后微小血管再生影响的实验研究
曾 凯,王 永,陈美华,欧阳秋芳(福建中医药大学附属福建省第二人民医院心内科,福州 350003;福建中医药大学附属福建省第二人民医院超声科;通讯作者,E-mail:fjzengkai@6.com)
冠脉微栓塞(coronary microembolization,CME)是临床上十分常见的病理生理过程,严重地影响患者的心功能及预后。CME的本质是心肌微小血管栓塞及微循环灌注障碍[1],故更有针对性的干预切入点应是恢复心肌组织的血流灌注。恢复血流灌注常用的方法主要有各种干细胞移植、各种生长因子干预及某些药物刺激等。上述方法有别于外科搭桥手术及其他血管重建术,但其目标仍然是重建有效心肌血供,故被形象的称为“诱导性心脏自身搭桥”或“治疗性心肌血管再生”[2]。
动物试验发现他汀类药物具有促血管再生及改善心肌微循环的效应[3]。血管再生包括血管再生(angiogenesis)和血管发生(vasculogenesis),他汀类对这两个过程均有重要的影响[4];他汀类改善心肌微循环障碍主要是继发于甲烃戊酸通路的中间产物异戊烯类的生物合成减少,甲烃戊酸的合成减少可以使Akt(丝氨酸-苏氨酸激酶)磷酸化而激活,从而使eNOs活性和稳定性增加,使心肌NO的水平升高[5]。基于此假设,本实验拟建立一种稳定的大鼠CME模型,旨在探讨辛伐他汀干预对CME后心肌微小血管保护与微小血管再生的影响及可能机制。
1 材料与方法
1.1 实验动物
SPF级SD大鼠40只,雌性,体重(300±20)g,由福建医科大学实验动物中心提供,实验动物及实验步骤符合国家实验动物管理条例。
1.2 实验材料
辛伐他汀原药粉(广州南新公司),NO试剂盒(南京建成生物医学工程研究所),Ⅷ因子相关抗原多克隆抗体,PE、TRITC标记的山羊抗大鼠的二抗(北京中山生物技术有限公司),盐酸氯胺酮(江苏恒瑞医药股份有限公司)。
1.3 实验仪器
TKR-200C小动物呼吸机由江西省特力麻醉呼吸设备公司提供;多功能生理记录仪BL-420E型由成都泰盟仪器厂提供,GE SYSTEMⅤ超声心动图仪及5-MHZ多平面经食道超声探头由美国GE公司提供;IMAGE PRO 4.0显微镜结合计算机显微图像分析系统由日本Olympus公司提供。
1.4 研究方法
1.4.1 CME模型建立 选用SPF级大鼠,从每只尾静脉取血2 ml凝固成血栓,CS501-3C恒温箱37℃过夜烘干,后取玻璃研磨器研磨,38 μm滤网滤过使之成为较均匀颗粒。电子天平称重8 mg血栓颗粒供每只动物实验备用。次日在大鼠腹腔注射戊巴比妥钠50 mg/kg麻醉后,取仰卧位,术区备皮消毒,气管插管,呼吸机辅助通气。取第2肋间水平横切口,剪断胸骨,切开心包,暴露主动脉根部,取已称好的血栓颗粒溶于0.5 ml生理盐水中,用1 ml注射针桶吸取血栓悬浮液,使用直径0.5 mm细针刺入心尖部,同时钳夹升主动脉,10 s后松开钳夹的升主动脉,压迫穿刺口止血,关胸复苏。为防止动物术后感染,每天肌注青霉素40万U/只,连续3 d。
1.4.2 分组及干预方案 40只大鼠随机分成5组:对照组(C组)、假手术组(sham组)、CME模型组(M组)、辛伐他汀干预组(ST组)及辛伐他汀加N-硝酸-L-精氨酸甲酯(L-NAME)干预组(STN组),全部模型均制作成功,每组各8只动物。干预方案:ST组CME模型制备后,以辛伐他汀2 mg/kg/d,用生理盐水稀释到5 ml灌胃,每日一次。STN组:模型制备后,以辛伐他汀2 mg/(kg·d)加N-硝酸-L-精氨酸甲酯15 mg/(kg·d)用生理盐水稀释到5 ml灌胃,每日一次。M组:模型制备后,予生理盐水灌胃,每日一次,一次5 ml。sham组:手术方法同M组,自心尖部注入生理盐水替代血栓微粒,术后予生理盐水灌胃,每日一次,一次5 ml。C组:未手术大鼠,予生理盐水灌胃,每日一次,一次5 ml。所有动物均在饲养28 d处死。
1.4.3 主要指标检测 采用Ⅷ因子染色评定单位面积心肌微小血管的密度,免疫荧光检测单位面积心肌微小血管的数量,采用酶联免疫吸附法(ELISA)测定心肌组织匀浆NO含量。严格按照使用说明书进行操作。
1.5 统计学分析
2 结果
2.1 不同组别微小血管密度的变化
Ⅷ因子染色结果显示,术后28 d,sham组与C组比较,微小血管密度差异无统计学意义(P>0.05)。M组与sham组比较,微小血管密度明显减少(P<0.01)。ST组与M组比较,微小血管密度明显增加(P<0.01);STN组与ST组比较,微小血管密度显著减少(P<0.01,见表1)。C组及sham组心肌微小血管密度正常,M组心肌微小血管密度明显降低,ST组辛伐他汀干预后心肌微小血管密度明显多于M组,STN组L-NAME干预后心肌微小血管密度较ST组减少(图1,见第160页)。
表1 冠脉微栓塞后心肌内微小血管密度、微小血管数量、NO含量比较及辛伐他汀干预的影响(±s)Table 1 Density of micro-vessel,num ber of micro-vessel and level of NO in myocardium after coronary microembolization and the invention effect of simvastatin(±s)

表1 冠脉微栓塞后心肌内微小血管密度、微小血管数量、NO含量比较及辛伐他汀干预的影响(±s)Table 1 Density of micro-vessel,num ber of micro-vessel and level of NO in myocardium after coronary microembolization and the invention effect of simvastatin(±s)
与C组和sham比较,*P<0.01;与 M组比较,#P<0.01;与 ST组比较,ΔP <0.01
组别 n 微小血管密度/(/mm2)微小血管数量/(/mm2)NO含量/(mmol/kg)C组8 7.25 ±0.27 0 27.70 ±1.03 sham 组 8 7.32 ±0.19 0 27.75 ±1.28 M组 8 3.32 ±0.16*1.30 ±0.15* 20.87 ±2.23*ST 组 8 5.05 ±0.24#4.49 ±0.57# 26.37 ±1.30#STN 组 8 3.59 ±0.42Δ 3.28 ±0.22Δ 15.38 ±1.41Δ
2.2 不同组别微小血管数量的变化
免疫荧光结果显示,ST组与M组比较,微小血管数量明显增加(P<0.01),STN组与ST组比较,微小血管数量显著减少(P<0.01,见表1)。
与M组相比,ST组辛伐他汀干预后心肌新生微小血管明显增多,STN组L-NAME干预后心肌新生微小血管较ST组减少(图2,见第161页)。
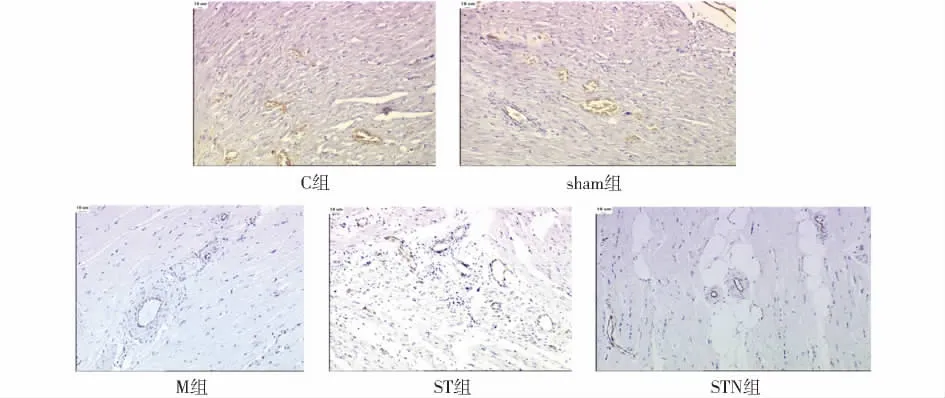
图1 冠脉微栓塞后心肌内微小血管密度比较及辛伐他汀干预的影响(HE染色,bar=100 μm)Figure 1 Effect of simvastatin on density of micro-vessel in myocardium after coronary microembolization (HE,bar=100 μm)

图2 冠脉微栓塞后心肌内微小血管数量比较及辛伐他汀干预的影响(免疫荧光染色×100)Figure 2 Effect of simvastatin on number of micro-vessel in myocardium after coronary microembolization(immunofluorescence,×100)
2.3 不同组别心肌组织匀浆NO含量的变化
术后28 d,sham组与C组比较NO含量差异无统计学意义(P>0.05);M组与sham组比较,NO含量显著下降(P<0.05);ST组与M组比较,NO含量显著增加(P<0.01)。STN组与ST组比较,NO含量显著下降(P <0.01,见表1)。
3 讨论
引起CME的常见原因有斑块自发破裂、经皮冠脉介入治疗(PCI)术中机械损伤致斑块破裂、溶栓术中血栓溶解不全等,CME严重时可引起患者猝死[1,2]。CME发生后慢性过程中心功能仍然持续性或进行性恶化[6]。因此,寻找CME后慢性过程中有效的干预措施显然十分重要。
他汀类药物是当前最强效的降低血清胆固醇或LDL-C的药物,临床广泛应用于高胆固醇血症的治疗及冠心病的一级、二级预防。本实验结果显示,术后28 d,辛伐他汀组与模型组比较,心肌内微小血管密度和新生微小血管数量明显增加。初步证实了CME后辛伐他汀干预可减少心肌微小血管的破坏并增加心肌微小血管及毛细血管的再生。大量研究表明,他汀类药物可促进内皮细胞释放NO,从而达到保护内皮细胞的作用。本研究也进一步证实,经辛伐他汀处理的动物其心肌组织中的NO含量明显升高。NO与内皮细胞的迁移关系密切[7],NO还可以促进内皮祖细胞表面整合素的表达,整合素可支持血管细胞建立的新血管,这在微血管再生中起到关键性的作用[8];同时,NO也可以动员骨髓内皮祖细胞,增加循环EPCs数目,促进微血管的发生[9]。NO为血管内皮生长因子(VEGF)的下游效应器,有调节血管VEGF促血管内皮细胞增殖作用[10]。因此,他汀刺激NO的释放可能就是通过上述机制发挥促进血管新生的作用。
L-NAME是NO的特异性阻断剂之一,我们的研究结果证实,经L-NAME处理的动物,辛伐他汀对CME后新生血管生成的促进作用部分消失,进一步表明辛伐他汀可能是通过NO介导的信号通路来发挥促进血管新生作用的。
综上所述,辛伐他汀可增加冠脉微栓塞后心肌内微小血管密度和新生微小血管数量,而这种作用可能是通过NO介导的。
[1]Su Q,Li L,Liu YC,et al.Effect of metoprolol on myocardial apoptosis and caspase-9 activation after coronary microembolization in rats[J].Exp Clin Cardiol,2013,18(2):161-165.
[2]Chen Z,Qian J,Ma J,et al.Glucocorticoid ameliorates early cardiac dysfunction after coronary microembolization and suppresses TGF-β1/Smad3 and CTGF expression[J].Int J Cardiol,2013,167(5):2278-2284.
[3]Asai J,Takenaka H,Hirakawa S,et al.Topical simvastatin accelerates wound healing in diabetes by enhancing angiogenesis and lymphangiogenesis[J].Am J Pathol,2012,181(6):2217-2224.
[4]Shimada T,Takeshita Y,Murohara T,et al.Angiogenesis and vasculogenesis are impaired in the precocious-aging klotho mouse[J].Circulation,2004,110(9):1148-1155.
[5]Scalia R,Gooszen ME,Joines SP,et al.Simvastatin exerts both anti-inflammatory and cardioprotective effect in apolipoprotein E-deficient mice[J].Circulation,2001,103(21):2598-2603.
[6]Otto S,Seeber M,Fujita B,et al.Microembolization and myonecrosis during elective percutaneous coronary interventions in diabetic patients:an intracoronary Doppler ultrasound study with 2-year clinical follow-up[J].Basic Res Cardiol,2012,107(5):289-294.
[7]Marcelo KL,Goldie LC,Hirschi KK.Regulation of endothelial cell differentiation and specification [J].Circ Res,2013,112(9):1272-1287.
[8]Vaiyapuri S,Hutchinson EG,Ali MS,et al.Rhinocetin,a venomderived integrin-specific antagonist inhibits collagen-induced platelet and endothelial cell functions[J].J Biol Chem,2012,287(31):26235-26244.
[9]Mourino-Alvarez L,Calvo E,Moreu J,et al.Proteomic characterization of EPCs and CECs“in vivo”from acute coronary syndrome patients and control subjects[J].Biochim Biophys Acta,2013,1830(4):3030-3053.
[10]Follin B,Tratwal J,Haack-S rensen M,et al.Identical effects of VEGF and serum-deprivation on phenotype and function of adipose-derived stromal cells from healthy donors and patients with ischemic heart disease[J].J Transl Med,2013,11(1):219.

