富血小板血浆对骨髓间充质干细胞RLA表达的影响
李 林,杜 刚,黄 克,梁红锁,唐 俊,李红波(广西医科大学第三附属医院骨一科,南宁 530031;通讯作者,E-mail:huangke_gx@126.com)
骨髓来源的间充质干细胞(bone mesenchymal stem cells,BMSCs)是体内的一种多功能干细胞,具有自我更新及多向分化潜能,在特定条件下能分化成再生骨、软骨、肌肉、脂肪、骨髓基质等多种组织[1,2]。BMSCs具有低免疫原性,且增殖能力强大,易于从骨髓中分离和体外扩增纯化,便于自体移植,近年来被认为有希望成为制备多种组织工程组织的种子细胞来源。
富集血小板血浆(platelet-rich plasma,PRP)是通过离心自体全血所得到的血小板浓缩物,富含各类生长因子如血小板衍生因子、转化生长因子、血管内皮生长因子等。多项研究[3-6]发现,PRP在体外条件能诱导骨髓间充质干细胞增殖和分化。PRP诱导分化后的骨髓间充质干细胞是否仍然保持低免疫原性?是否还具有免疫调节作用?这是涉及同种异体骨髓间充质干细胞移植的关键问题。本研究旨在探讨PRP对骨髓间充质干细胞免疫原性的影响,为体内试验提供依据。
1 材料及方法
1.1 材料
1.1.1 主要试剂与仪器 L-DMEM培养基(Gibicol公司)、F12-DMEM培养基及胎牛血清(Hyclone公司)、Ficoll淋巴细胞分离液(TBD公司,比重1.077 g/ml)、CD34-PE和 CD45-PE抗体(Santa Cruz公司)、CD105-FITC抗体(BD公司)、RLA-DQ抗体(Abnova公司)、Trizol(Invitrogen公司)、M-MLV反转录试剂盒及MTS试剂盒(Promega公司)、流式细胞仪(FACSCalibu,BD公司)及细胞培养箱(Thermo公司)。
1.1.2 实验动物 普通级健康新西兰大耳白兔,雌性,兔龄约为3个月,由山东省农科院提供,许可证号:SCXK[鲁]20040013。
1.2 方法
1.2.1 家兔来源骨髓间充质干细胞的获取 3%戊巴比妥钠(30 mg/kg)耳缘静脉麻醉,以股骨髁突为穿刺点。无菌条件下采集家兔红骨髓2-5 ml,在华氏管中加入 Ficol1分离液(1.077 g/ml)3 ml,以4℃,3 000 r/min,离心30 min,弃上清,吸中间乳白色样层细胞,即单个核细胞,F12-DMEM洗涤2遍,弃上清,重悬于含10%FBS的F12-DMEM培养液中,按1×105个/ml接种3 ml于六孔板中,置于37℃,5%CO2饱和湿度的CO2培养箱内培养,原代细胞接种48 h后进行首次全量换液,此后每周两次全量换液,待细胞生长铺满至培养板的80%-90%时进行消化传代,以后细胞按常规方法传代、冻存,培养3代后的细胞用于实验。
1.2.2 骨髓间充质干细胞成骨诱导分化 将BMSCs按1×106/孔接种于六孔板中,加入地塞米松(终浓度 0.1 μmol/L),抗坏血酸磷酸盐(终浓度0.05 mmol/L),甘油磷酸钠(终浓度 10 mmol/L),分化成熟的成骨细胞以茜素红染色进行鉴定。
1.2.3 骨髓间充质干细胞表型测定 用胰蛋白酶分别消化BMSCs,用PBS调整细胞密度为1×105个/孔后,分别加入下列鼠抗兔单克隆抗体:CD34-PE,CD45-PE,CD105-FITC,使用直接法标记 CD34和CD45,使用间接法标记CD105,4℃孵育30 min,PBS洗2遍,流式细胞仪检测BMSCs的细胞表面抗原。
1.2.4 富血小板血浆的获取以及浓缩成指定体积分数 3%戊巴比妥钠(30 mg/kg)耳缘静脉麻醉,用装有1 ml枸橼酸钠抗凝剂的注射器抽取静脉血液10 ml,摇匀,置于离心管中,以1 000 r/min的速度离心15 min,吸取全部上清液及交界面以下1-2 mm的红细胞至另一个离心管,再以3 000 r/min的速度离心8 min,弃上清液上3/4,轻轻振荡,以获取血小板血浆。将血小板血浆与激活剂(牛凝血酶及10%的氯化钙混合物)以9∶1的比例混合、振荡,4℃冰箱过夜。待血凝块充分收缩后,重离心10 min,吸取富含复合生长因子的血小板血浆上清液,加入含100 U/ml青霉素、100 mg/L链霉素的无血清L-DMEM培养基,分别稀释成5%和10%两个体积梯度的富血小板血浆备用。
1.2.5 骨髓间充质干细胞与富血小板血浆共培养 将BMSCs细胞以1×106/孔接种于六孔板中,对照组加入200 μl的L-DMEM培养液,实验组分别加入200 μl含5%和10%PRP的L-DMEM培养液,从而建立起BMSCs与PRP的共培养体系,置37℃5%CO2孵箱中培养72 h。
1.2.6 骨髓间充质干细胞RLAⅠ类及RLAⅡ类基因表达 real-time PCR法检测未分化的BMSCs以及与富集血小板共培养后RLA-Ⅰ(R19)和RLA-Ⅱ(DQA)基因的表达情况。
细胞总RNA提取按Trizol说明书进行操作,取2 μg总RNA进行逆转录,引物序列见表1,GAPDH为内参基因,实验在荧光定量PCR仪ABI7500上进行。

表1 骨髓间充质干细胞RLAⅠ类及RLAⅡ类基因引物序列Table 1 The primer sequences of RLAⅠand RLAⅡ in BMSCs
1.2.7 骨髓间充质干细胞RLA-DR基因表达的测定 取与富集血小板共培养的BMSCs细胞进行试验,0.25%胰蛋白酶消化并收集细胞置于含1%牛血清白蛋白的PBS中,洗涤两次,制成浓度为1×106/ml的单细胞悬液。加入荧光素标记的单克隆抗体:PE-RLA-DR抗体10 μl,避光,冰上孵育45-60 min。流式缓冲液洗涤细胞,并将细胞重悬于PBS,3%多聚甲醛固定,同型对照组加入PE-IgG1消除非特异性荧光,流式细胞仪(FCM)检测细胞表面分子RLA-DR的表达。
1.2.8 单项混合淋巴细胞反应(MLR)试验 抽取新鲜兔血,肝素抗凝,PBS等倍稀释,在华氏管中2∶1加入Ficol1 分离液(1.077 g/ml),4 ℃,3 000 r/min,离心30 min,弃上清,吸中间乳白色样层细胞,1 500 r/min,离心10 min,离心2次。加入ddH2O破红细胞,20 s后立即加入等量PBS终止反应,1 500 r/min离心2次即得淋巴细胞,调整细胞浓度为7×105个/ml。
BMSCs长至80%密度时,消化,离心,得到细胞沉淀,浓度调整为1×106/ml,加入丝裂霉素C(终浓度为25 μg/ml),37 ℃孵育30 min,PBS洗涤3次,用培养基调整细胞浓度为7×105个/ml。
兔外周血淋巴细胞(peripheral blood lymphocyte,PBL)与共培养的BMSCs按1∶1进行单向混合淋巴细胞反应,未处理BMSCs作为对照组,5%PRP处理BMSCs作为5%PRP组,10%PRP处理BMSCs作为10%PRP组,同时用2%植物血凝素(phytohaemagglutinin,PHA)刺激PBL增殖作为阳性对照。取96孔细胞培养板,每孔各加入100 μl效应细胞和刺激细胞,每组设三个复孔。置于37℃、5%CO2饱和湿度培养箱培养,共培养72 h。PBL的增殖活性用MTS法测定,具体操作根据CellTiter 96® AQueous One Solution Cell Proliferation Assay说明书进行,计算出每孔的OD值。
1.3 统计学分析
2 结果
2.1 骨髓间充质干细胞形态特征及表面抗原
流式细胞术检测结果显示,分离培养的BMSCs均一性达到95%以上,膜抗原CD34及CD45呈阴性表达,CD105呈阳性表达,在成骨诱导培养基中的细胞经茜素红染色钙结节呈红色(图1,见第161页)。
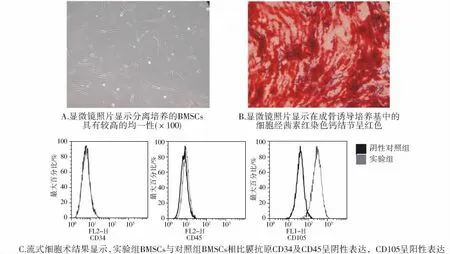
图1 骨髓间充质干细胞的鉴定Figure 1 The identification of BMSCs by microscope and flow cytometry
2.2 富血小板血浆对骨髓间充质干细胞RLA基因表达的影响
real-time PCR结果显示,与对照组 BMSCs相比,5%和10%PRP组BMSCs RLAⅠ类基因(R19)以及RLAⅡ类基因(DQA)表达差异无统计学意义(P >0.05,见表2)。

表2 富血小板血浆对骨髓间充质干细胞RLA基因表达的影响 (n=5)Table 2 Effect of PRP on RLA mRNA expression in BMSCs(n=5)
2.3 富血小板血浆对骨髓间充质干细胞RLA-DR基因表达的影响
流式细胞术检测结果显示,与对照组BMSCs相比,5%和10%PRP组BMSCs RLA-DR表达差异无统计学意义(P >0.05,见图2)。
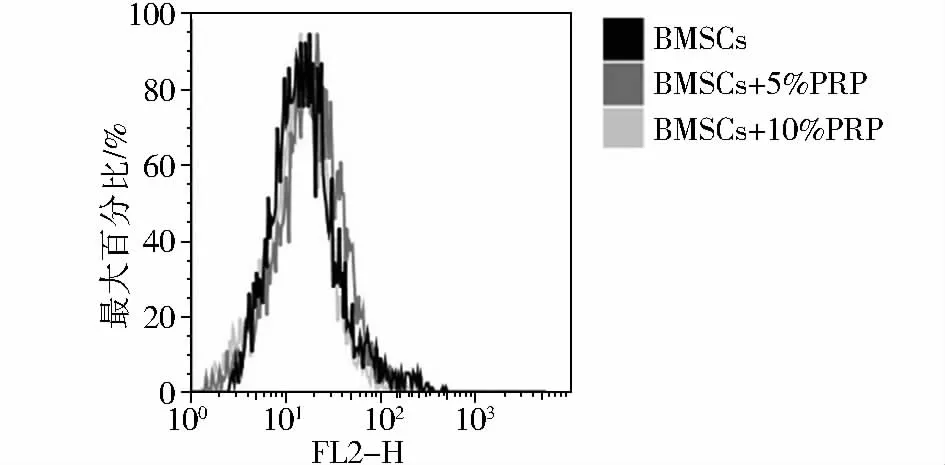
图2 富血小板血浆对骨髓间充质干细胞RLA-DR基因表达的影响Figure 2 The effect of PRP on RLA-DR gene expression in BMSCs
2.4 富血小板血浆对骨髓间充质干细胞MLR结果的影响
MTS试验结果显示,2%PHA可刺激PBL增殖,与对照组BMSCs相比,5%和10%PRP组PBL增殖差异无统计学意义(P>0.05),且BMSCs的存在可抑制PBL增殖(见图3)。

图3 富血小板血浆对骨髓间充质干细胞MLR结果的影响 (n=5)Figure 3 Effect of PRP on MLR results in BMSCs(n=5)
3 讨论
骨髓间充质干细胞近年引起国内外学者关注,除了其强大的体外增殖能力和分化能力外,骨髓MSC免疫原性较小是其重要的原因之一。BMSCs属于未分化的前体干细胞,其表型分化尚不成熟,因此骨髓BMSCs移植同种异体后无排斥反应或反应较弱。Lazarus等[7]将体外培养扩增的不同浓度骨髓BMSCs通过静脉注入志愿者体内,结果发现直至输入量达到5×107均未发生明显的免疫排斥反应,可见BMSCs在临床同种异体移植方面具有广阔的应用前景。
同种异体移植中最重要的途径之一就是静脉移植。血小板是血液的重要组成,自体全血经离心所得到的血小板浓缩物,富含大量的生长因子,如血小板衍生生长因子是多肽生长因子之一,是血小板中释放的促丝裂原,转化生长因子具有刺激细胞从贴壁依赖性生长转变为非贴壁依赖性生长的多功能细胞生长因子,胰岛素生长因子对促进干细胞分化和增殖具有重要作用,这些细胞生长因子为BMSCs生长和分化所必需的[8,9]。分化后的骨髓间充质干细胞的免疫原性是关系到能否把骨髓间充质干细胞当做构建组织工程种子细胞的关键问题。因此探讨PRP诱导分化后BMSCs免疫原性及多种生长因子的干扰下能否保持低免疫原性具有重要的意义。本实验从家兔RLA基因水平研究证实,与富集血小板血浆共培养后,RLA-Ⅰ(P19)和RLA-Ⅱ(DQA)基因表达水平没有显著性变化。
临床同种异体移植要求受体与供体具有较低的排斥反应,RLA-DR表型对于供体免疫原性的关系十分密切,关系到移植的成功与否。为研究与PRP共培养后,BMSCs分化后免疫原性和免疫调节功能,本实验通过FCM检测了BMSCs的RLA-DR表型,观察单向混合淋巴细胞反应,实验结果表明骨髓间充质干细胞分化后不表达RLA-DR,PRP诱导分化后的BMSCs对PBL没有明显的增殖反应。RLA-Ⅱ(DQA)的表达对刺激PBL增殖有着非常重要的作用,尽管分化后BMSCs的RLA-Ⅱ表达轻微增加,可能这种变化较小,不足于改变分化BMSCs的免疫原性。RLA-DR是MHC-Ⅱ类分子的主要抗原之一,与免疫应答密切相关[10],RLA-DR的表达对刺激PBL增殖也有非常重要的作用。BMSCs经PRP诱导分化后,未检测到RLA-DR表达,表明BMSCs在体外有明显的抑制刺激细胞增殖的作用。
我们的研究还发现,5%和10%两个体积梯度的富血小板血浆对骨髓间充质干细胞(BMSCs)免疫原性的改变都很小,两组实验之间没有显著性差异,表明富血小板血浆(PRP)对BMSCs的免疫原性不产生影响。
综上所述,骨髓间充质干细胞低免疫原性的特性,使其成为在组织工程和细胞治疗过程中重要的种子细胞。富血小板血浆含有丰富的生长因子,能诱导骨髓间充质干细胞定向分化和增殖,且不影响其免疫原性,是体外诱导和扩增骨髓间充质干细胞的重要材料,但是究竟是其中哪种因子起作用还需要进一步深入研究。
[1]Kalinina NI,Sysoeva VY,Rubina KA,et al.Mesenchymal stem cells in tissue growth and repair[J].Acta Naturae,2011,3(4):30-37.
[2]张雁云.干细胞免疫学与临床疾病[J].现代免疫学,2011,31(3):185-186.
[3]Yazdani SO,Pedram M,Hafizi M,et al.A comparison between neurally induced bone marrow derived mesenchymal stem cells and olfactory ensheathing glial cells to repair spinal cord injuries in rat[J].Tissue Cell,2012,44(4):205-213.
[4]秦静,赵振林.骨髓间充质干细胞的免疫原性特点及其免疫调节能力[J].现代免疫学,2010,30(6):515-519.
[5]Yoshimi R,Yamada Y,Ito K,et al.Self-assembling peptide nanofiber scaffolds,platelet-rich plasma,and mesenchymal stem cells for injectable bone regeneration with tissue engineering[J].J Craniofac Surg,2009,20(5):1523-1530.
[6]Lu Y,Li B,Wang X,et al.The effect of programmed cryopreservation on immunogenicity of bladder mucosa in New Zealand rabbits[J].Cryobiology,2012,64(1):27-32.
[7]Lazarus HM,Haynesworth SE,Gerson SL,et al.Ex vivo expansion and subsequent infusion of human bone marrow-derived stromal progenitor cells(mesenchymal progenitor cells):implications for therapeutic use[J].Bone Marrow Transplant,1995,16(4):557-564.
[8]Barbet R,Peiffer I,Hutchins JR,et al.Expression of the 49 human ATP binding cassette(ABC)genes in pluripotent embryonic stem cells and in early-and late-stage multipotent mesenchymal stem cells:possible role of ABC plasma membrane transporters in maintaining human stem cell pluripotency[J].Cell Cycle,2012,11(8):1611-1620.
[9]许茹,夏文杰,戎霞,等.人血小板裂解液替代胎牛血清促进骨髓间质干细胞的增殖[J].南方医科大学学报,2011,31(8):1396-1400.
[10]王兰,卢晓风,李胜富,等.成骨分化的骨髓间充质干细胞的免疫原性[J].华西医学,2007,22(4):816-817.

