胚胎中胚层间充质细胞参与小鼠胚胎原始心管的形成
王晶晶,刘慧霞,乔从进,景 雅(山西医科大学组织胚胎学教研室,太原 030001;通讯作者,E-mail:jingya66@hotmail.com)
先天性心脏病是最常见的先天性畸形,亦是新生儿期患病和死亡的主要原因之一。在心管发育早期心肌前体细胞迁移和分化过程中信号调控异常可产生较严重的心脏畸形。条件性心脏GATA4基因敲除后的小鼠,可出现心肌细胞分化不成熟,心腔结构、位置异常等多种畸形[1]。GATA4可以和多种心肌特异性基因的启动子WGATAR序列结合,促进这些基因在心肌和心肌前体细胞的表达和转录[2]。转录因子GATA4、α-平滑肌肌动蛋白(α-SMA)可用来标记心肌细胞的早期分化[3-4],本实验用两种蛋白标记来观察小鼠早期心管形态结构,探讨心肌细胞的迁移和分化。
1 材料和方法
1.1 实验动物
80日龄20只质量均匀健康的中国昆明小鼠经体染标记后于明暗周期条件下规律饲养。2周后,将雌、雄小鼠于晚6∶00合笼,次晨7∶00检查阴栓,有阴栓者记为妊娠0.5 d,妊娠小鼠乙醚麻醉后取材,收集7.5-9 d的小鼠胚胎连同子宫各6只。胚胎连同子宫于固定液中固定24 h,固定液的配制为甲醇∶丙酮∶水 =2∶2∶1(体积比)混匀。
1.2 胚胎连同子宫的包埋
标本经固定、脱水、透明、浸蜡后包埋。包埋要领:子宫的系膜缘朝向包面框内,对系膜缘正对包埋框壁。子宫两断端连线与包埋框长边平行。冷却修块后制作8 μm厚连续石蜡切片,铺于载玻片上。切片注意事项:切蜡块方向始终为从子宫的一侧断端到另一侧断端。
1.3 染色
切片脱蜡,水化后经3%过氧化氢和TENG-T(10 mmol/L Tris,5 mmol/L EDTA,150 mmol/L NaCl,0.25%gelatin,0.05%Tween-20;pH=8.0)(pH7.4 PBS配制)预处理半小时,以减低内源性过氧化物酶的活性和非特异性染色。连续切片进行HE和免疫组织化学染色。免疫组织化学染色所用的抗体为抗转录因子GATA4多克隆抗体(1∶50,武汉博士德生物工程有限公司)、抗α-SMA抗体(1∶1 000,Sigma公司,美国)。
2 结果
小鼠胚胎发育7.5 d,位于神经沟腹侧的生心区域为生心板,原始心管尚未融合(图1A,见第159页)。位于神经沟和原肠之间以及原肠周围的细胞体积较大,细胞排列疏松,细胞间有突起相连,处于低分化状态,此为中胚层间充质细胞(图1B,见第159页)。靠近生心区的间充质细胞分为两部分,靠近内侧的间充质细胞与生心板相延续,靠近外侧的间充质细胞与心包腔的脏壁中胚层相接(图1B,见第159页)。心肌早期分化标记蛋白α-SMA在生心板有较强表达(图1C,见第159页)。
小鼠胚胎发育8 d,原始心管从中间向两边开始融合,在正中矢状切面上不可见间充质细胞与原始心管相延续(图2,见第159页)。小鼠胚胎发育8.5 d,原始心管中部融合的部位明显变长,未融合的头、尾端变短(图3,见第159页)。神经沟与原肠之间及原肠周围的间充质细胞显著增多,同样可见与原始心管及心包腔脏壁中胚层相连接(图3,见第159页)。
小鼠胚胎发育9 d,原始心管各部生长速度不同步,使得心管表面出现膨出和沟(图4Α箭头,见第160页)。在尾端可见壁较薄的血管与心管相连。血管内可见造血干细胞,有的处于分裂状态(图4Α椭圆,见第160 页)。7.5 d,8 d,8.5 d,9 d 四个时期的胚胎都可见到多种切面(图1-4,见第159,160页)。免疫组织化学染色心肌早期分化的蛋白在生心板或原始心管上都有较强表达(图1C,2B,3B,4B,见第159,160 页)。

图1 胚龄7.5 d心脏横切面Figure 1 Transversal sections of the mouse embryonic heart at ED7.5
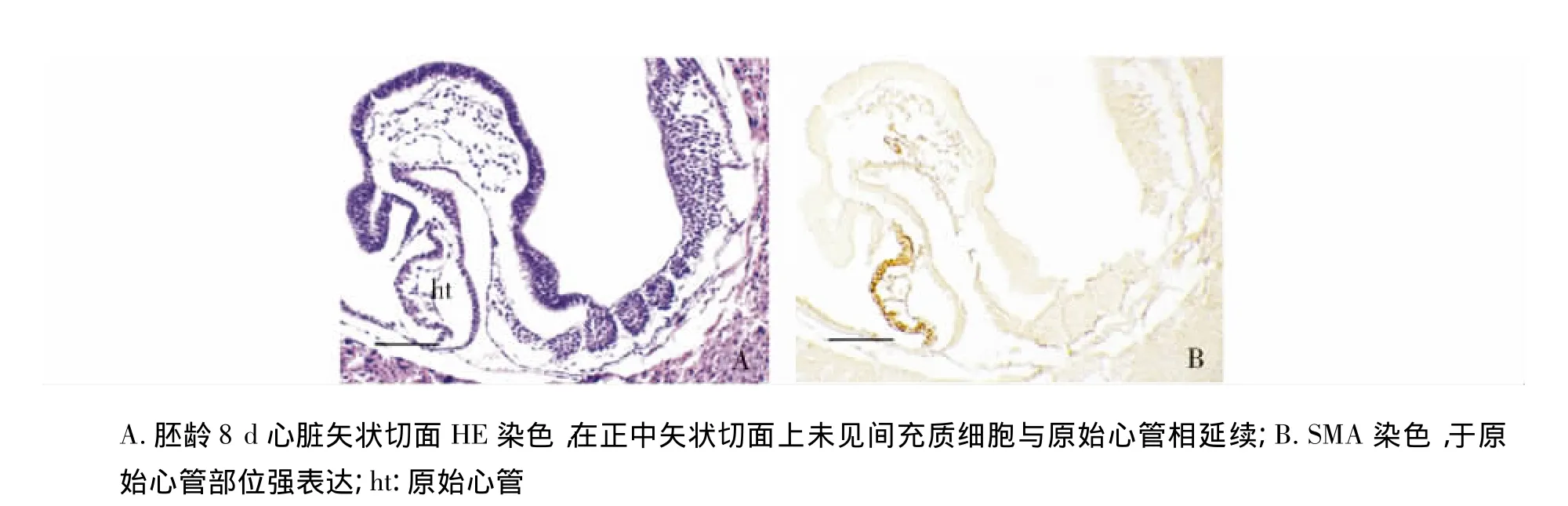
图2 胚龄8d心脏矢状切面 (bar=250 μm)Figure 2 Sagittal sections of the mouse embryonic heart at ED8 (bar=250 μm)
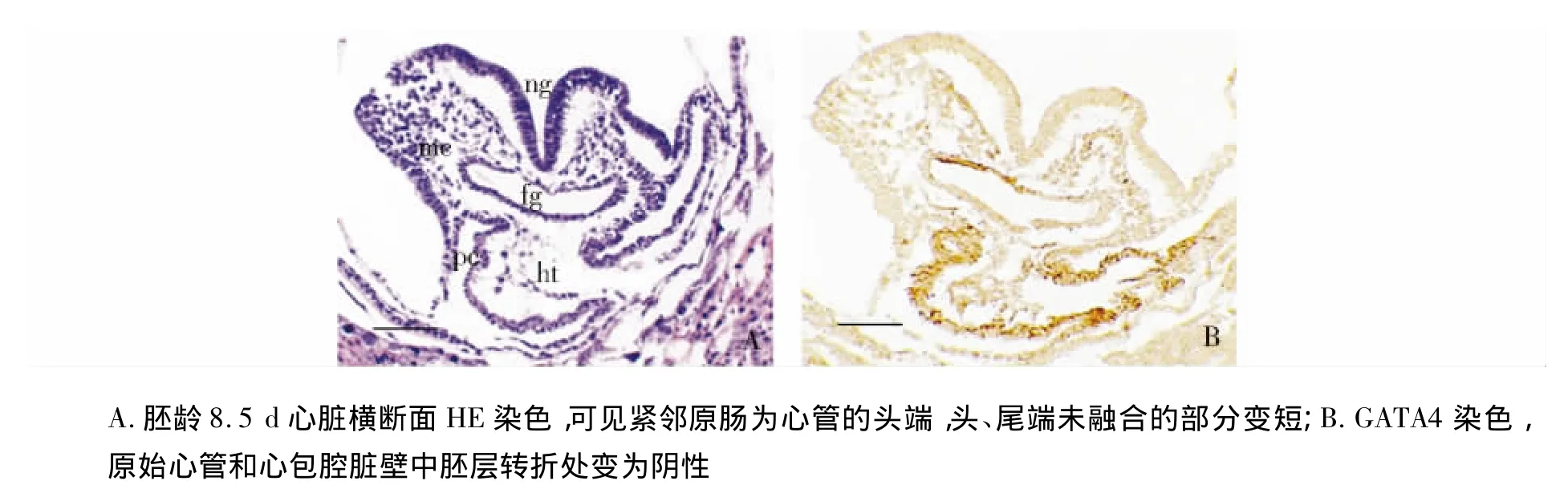
图3 胚龄8.5 d心脏横断面 (bar=250 μm)Figure 3 Transversal sections of the mouse embryonic hearts at ED8.5 (bar=250 μm)

图4 胚龄9 d心脏冠状切面 (bar=250 μm)Figure 4 Coronal sections of the mouse embryonic hearts at ED9 (bar=250 μm)
3 讨论
心脏的发育经历了复杂的形态发生和结构重建过程,并受到多种转录因子及信号系统的调节[5-8]。心脏发育早期,原始生心中胚层形成后,随着胚盘侧褶的形成两侧生心中胚层在胚胎腹侧中线融合,形成了原始心管。原始心管背侧,神经沟和原肠之间以及原肠周围的间充质细胞为头端的胚胎中胚层间充质细胞。本实验研究发现心包腔脏壁中胚层细胞和心管中胚层细胞都与此区域的间充质细胞相延续,提示两者来源相同,即都为头端胚胎中胚层间充质细胞迁移分化形成。本实验通过对8 d前小鼠胚胎原始心管研究发现,心肌早期分化标志蛋白转录因子GATA4、α-SMA于生心板或心管的部位强表达,而心包腔脏壁中胚层部位呈阴性,说明虽然两者来源相同,但在胚胎发育过程中,心包腔脏壁中胚层和原始心管受到了不同的调控机制和信号转导,向不同的方向分化。胚胎中胚层间充质细胞可迁移并分化成多种细胞[9-10]。我们推测,位于人体头端神经沟和原肠之间的间充质细胞向腹侧迁移至心管和心包腔脏壁中胚层后,再分化成两种不同的细胞,同时失去迁移能力。心包部位细胞最后分化形成上皮组织而心管部位的细胞分化形成心肌组织。Watt等[1]的实验是关于GATA4基因敲除后出现心脏畸形的研究,研究的是异常形态,而我们观察了GATA4蛋白在正常原始心管发生过程中的时空表达特点,为阐明GATA4基因敲除后出现的心脏畸形机制提供组织学依据。我们从胚胎心脏矢状切面上观察到生心板或原始心管中间部分不与胚胎中胚层间充质细胞相延续,提示心脏发育早期间充质从两侧向心管迁移。
另外,我们发现四个时期的胚胎都可见到多种切面并且切面是随机的。前期切片方向固定即始终为从子宫的一侧断端切至另一侧断端。这说明早期胚胎在子宫内的体位是不固定的,体位的转动无规律。剥离出的胚胎可随意选择切面,小胚龄胚胎从子宫中剥离并保证胚胎的完整性较困难,需连同子宫一起固定,不能保证切面的随意选择。比如心脏横断面更能看清心脏结构及与周围结构关系,要得到更多的横断面就得尝试多种切面,同剥离出的胚胎只做一种切面得不到预期结果。
[1]Watt AJ,Battle MA,Li JX,et al.GATA4 is essential for formation of the proepicardium and regulates cardiogenesis[J].Science,2004,101(34):12573-12578.
[2]Pikkarainen S,Tokola H,Kerkel R,et al.GATA transcription factors in the developing and adult heart[J].Cardiovasc Res,2004,63:196-207.
[3]Sepulveda JL,Belaguli N,Nigam V,et al.GATA-4 and Nkx-2.5 coactivate Nkx-2 DNA binding targets:role for regulating early cardiac gene expression[J].Mol Cell Biol,1998,18(6):3405-3415.
[4]Sugi Y,Lough J.Onset of expression and regional deposition of alpha-smooth and sarcomeric actin during avian heart development[J].Dev Dyn,1992,193:116-124.
[5]Satou Y,Satoh N.Gene regulatory networks for the development and evolution of the chordate heart[J].Genes Dev,2006,20:2634-2638.
[6]Stennard FA,Harvey RP.T-box transcription factors and their roles in regulatory hierarchies in the developing heart[J].Development,2005,132:4897-4910.
[7]Black BL.Transcriptional pathways in second heart field development[J].Semin Cell Dev Biol,2007,18(1):67-76.
[8]Sachinidis A,Fleischmann BK,Kolossov E,et al.Cardiac specific differentiation of mouse embryonic stem cells[J].Cardiovasc Res,2003,58:278-291.
[9]Theveneau E,Mayor R.Neural crest delamination and migration:from epithelium-to-mesenchyme transition to collective cell migration[J].Dev Biol,2012,366(1):34-54.
[10]Malinda KM,Ettensohn CA Primary mesenchyme cell migration in the sea urchin embryo:distribution of directional cues[J].Dev Biol,1994,164(2):562-578.

