人Notch-1基因RNA干扰慢病毒载体的构建及鉴定
张庆庆 张森林 朱迎兰 董震 曹罡 陈伟
1.南方医科大学南京临床医学院口腔科;2.南京军区南京总医院口腔科,南京 210002
涎腺腺样囊性癌(salivary adenoid cystic carcinoma,SACC)是涎腺常见的恶性肿瘤,国内统计其占涎腺肿瘤的9.9%[1],国外统计其占涎腺肿瘤的7.5%[2]。SACC的恶性程度高,主要表现为侵袭性强,局部易复发;易远处转移,以肺转移多见,转移率高达40%;有典型嗜神经性,早期即可沿神经侵袭和转移,导致面瘫、麻木、疼痛等神经受损症状,给临床治疗带来很大的困难,预后差[2]。本课题前期研究已成功构建了SACC嗜神经侵袭基因表达谱,Notch-1即为其中重要差异表达基因之一[3]。
Notch信号途径是一个进化上保守的信号转导通路,在调节细胞的分化、增殖与凋亡中起重要作用。Notch信号途径的异常调控可引起组织的发育异常,并最终导致肿瘤等多种疾病的发生[4]。研究[5]表明,Notch家族基因Notch-1、Notch-2、Notch-4与SACC的发生、发展、转移有关,但其与SACC嗜神经侵袭行为间的关系尚未见报道。本研究的目的是构建人Notch-1基因的RNA干扰(RNA interference,RNAi)慢病毒载体,并对其进行鉴定,寻找最佳RNAi慢病毒载体,为探讨Notch-1在SACC中的功能与分子机制奠定基础。
1 材料和方法
1.1 主要材料
慢病毒载体pLenOR-THM(上海英为信生物科技有限公司),配有3个包装质粒pRsv-REV、pMDlgpRRE、pMD2G。Taq DNA聚合酶、限制性内切酶BamHⅠ、EcoRⅠ、KpnⅠ(Takara公司,日本),T4 DNA连接酶(NEB北京有限公司),AxyPrep质粒小量制备试剂盒(Axygen公司,美国),Nucleo-Bond Xtra Midi Plus质粒纯化试剂盒(Macherey-Nagel公司,德国),高效感受态细胞制备试剂盒(上海生物工程有限公司),大肠杆菌菌株DH5α、RPMI-1640和DMEM培养基、LipofectaminTM2000、胰蛋白酶、Trizol(Invitrogen公司,美国),M-MLV逆转录酶(Fermentas公司,加拿大),SYBR Master Mixture(Toyobo公司,日本),胎牛血清(PAA公司,美国)。兔抗人Notch-1、GAPDH抗体(Abcam公司,英国),HRP标记的山羊抗兔多抗、增强型化学发光检测试剂盒(Pierce公司,美国)。包装细胞293T细胞株、ACC-M细胞株购自中科院上海细胞所,寡核苷酸及引物均由上海生物工程有限公司合成。
1.2 靶向Notch-1基因的寡核苷酸设计
针对人Notch-1基因序列(GenBank:NM_004-557.3),按照RNAi序列设计原则[6-7],设计RNAi靶点序列(shRNA1~3),同时设计一段阴性对照序列(NC),经BLAST分析表明其均不与人任何其他cDNA序列同源。再根据以上4段序列分别设计合成4对寡核苷酸序列,每对包含一条正义链(sense)和一条反义链(antisense)(表1)。4对寡核苷酸序列退火后均可形成在5’端含BamHⅠ酶切位点,3’端含EcoRⅠ酶切位点,中间含21个碱基发夹环的小片段DNA双链。

表1 针对人Notch-1基因序列设计的寡核苷酸对Tab 1 Oligonucleotide sequences of Notch-1 specific shRNAs
1.3 慢病毒载体pLenOR-THM-Notch-1的构建、扩增及鉴定
将pLenOR-THM载体用限制性内切酶BamHⅠ和EcoRⅠ行双酶切,将酶切产物用低熔点琼脂糖胶回收并和上述寡核苷酸退火后的产物混合,然后经T4 DNA连接酶连接过夜,从而将Notch-1基因序列插入慢病毒载体pLenOR-THM,构建pLenOR-THMNotch-1重组载体。连接后的重组质粒转化感受态DH5α细菌,经含氨苄青霉素培养基筛选阳性克隆后,挑取单菌落扩大培养。按分子克隆实验指南用碱裂解法手工抽提质粒。由于靶RNA干扰序列插入位点是BamHⅠ和EcoRⅠ之间,酶切出的片段较小,不易于分辨,故设计重组载体中的KpnⅠ和EcoRⅠ位点,增大酶切出的片段长度,行双酶切初步鉴定。使用Axygen试剂盒抽提质粒并通过DNA测序(南京金斯瑞生物科技公司)进一步鉴定。
1.4 包装产生siRNA的病毒颗粒及测定病毒滴度
重组质粒载体pLenOR-THM-Notch1、包装质粒pRsv-REV、pMDlg-pRRE、pMD2G分别进行去内毒素中量质粒抽提,并进行浓度测定,同时设置空载体pLenOR-THM为对照。用脂质体LipofectaminTM2000包裹慢病毒四质粒系统(pLenOR-THM-Notch4、pRsv-REV、pMDlg-pRRE、pMD2G)共转染293T细胞进行病毒包装。48~72 h后大量病毒产生,收取含病毒的培养液,并通过0.45 μm滤器过滤,4 ℃、12 000 g 离心20 min后弃上清,沉淀,即为Notch-1基因RNAi慢病毒载体,分装后冻存于-80 ℃待用。将纯化过的病毒倍比稀释后(1、0.1、0.01 μL)感染293T细胞,48 h后在荧光显微镜下观察荧光。取0.1 μL病毒感染293T细胞,流式细胞仪检测阳性细胞比例,测定病毒滴度(TU·mL-1),即每毫升病毒原液含有具有感染能力的病毒颗粒的个数。以复感染系数(multiplicity ofinfection,MOI)为1时感染293T细胞,感染72 h后荧光显微镜下观察绿色荧光。在100倍光镜下,随机选择不重叠的10个视野,手工计数发绿色荧光细胞占总细胞的比例,计算感染效率。
1.5 定量逆转录聚合酶链反应(polymerase chain reac-tion,PCR)检测Notch-1 mRNA的表达
慢病毒转染48 h后,从6孔板中每组各收集细胞1×106个,采用Trizol一步法抽提总RNA,用逆转录试剂盒进行逆转录反应,然后用ABI-7900型荧光定量PCR仪进行PCR扩增。Real-Time PCR引物:Notch-1正义链为5’-AGTACTGTACCGAGGATGTGGACG-3’; 反义链为5’-GAAGGAGGCCACACGGTCAT-3’;GAPDH正义链为5’-GGAGTCCACTGGCGTCTTC-3’;反义链为5’-GCTGATGATCTTGAGGCTGTTG-3’。反应体系为20 μL。反应参数:95 ℃预变性2 min,95 ℃变性15 s,58 ℃复性20 s,72 ℃延伸20 s,45个循环。ACC-M为阴性对照,空载体Notch-1 mRNA为空白对照。采用2-ΔΔCt法计算基因表达的相对比值。
1.6 Western blot检测Notch-1蛋白表达
慢病毒转染96 h后,6孔板中各组以预冷的PBS液洗3次,加入100 μL预冷的含蛋白酶抑制剂的蛋白抽提试剂,刮匙收集样本,4 ℃下10 000 g离心2 min,取上清,以BCA法测定提取蛋白浓度。每个样本取50 μg蛋白加入等体积2×SDS上样缓冲液,使用煮沸变性后预制的7.5% SDS-PAGE电泳分离,100 V×1 h湿法转移至硝酸纤维素膜。转载标本蛋白的硝酸纤维素膜浸入含5%脱脂奶粉的TTBS(20 mmol·L-1Tris-HCL,pH 7.4,150 mmol·L-1NaCl,0.1% Tween-20),室温封闭1 h,加入一抗(兔抗人Notch-1、GAPDH抗体,1︰1 000) ,4 ℃振荡孵育过夜,TTBS洗涤15 min×4次后,加入HRP标记的山羊抗兔二抗(1︰5 000),室温孵育1 h,充分洗涤后,电化学发光(electro-chemiluminescence,ECL)法检测标本膜上的信号,记录结果。
1.7 统计学分析
采用SPSS 17.0软件进行统计学处理。所有的细胞实验均重复3次,定量实验结果以均数±标准差来表示,组间两两单因素方差分析(one-way)比较采用ANOVA检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 慢病毒载体pLenOR-THM-Notch-1的鉴定
重组载体经KpnⅠ及EcoRⅠ双酶切后,阳性克隆条带大小为395 bp,阴性克隆条带大小为330 bp(图1)。鉴定结果与预期相符,说明目的片段已正确插入pLenOR-THM慢病毒载体。
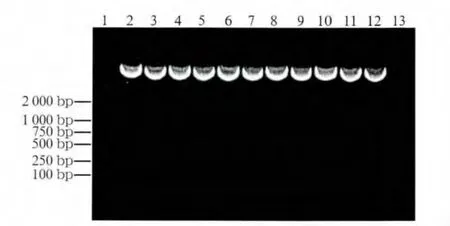
图1 重组载体经Kpn Ⅰ及EcoR Ⅰ双酶切鉴定结果Fig 1 Validation results of recombinant vector by Kpn Ⅰ and EcoRⅠdouble-digestion
DNA测序结果显示,构建的3个慢病毒载体均含有所设计的目的片段,其序列与设计的靶向Notch-1寡核苷酸序列完全一致,进一步证实目的片段已正确插入pLenOR-THM慢病毒载体,重组慢病毒载体pLenOR-THM-Notch-1构建成功(图2)。
2.2 慢病毒包装与病毒滴度测定
慢病毒载体四质粒共转染293T细胞48 h后,荧光显微镜下可观察到293T细胞发出大量绿色荧光。不同数量慢病毒感染293T细胞48 h后,其发出的绿色荧光强度不同(图3)。慢病毒pLenOR-THM-Notch1浓缩后的病毒滴度约为5.8×108TU·mL-1。以MOI为1时感染293T细胞,感染72 h后荧光显微镜下可观察到绿色荧光,感染效率达到90%以上。
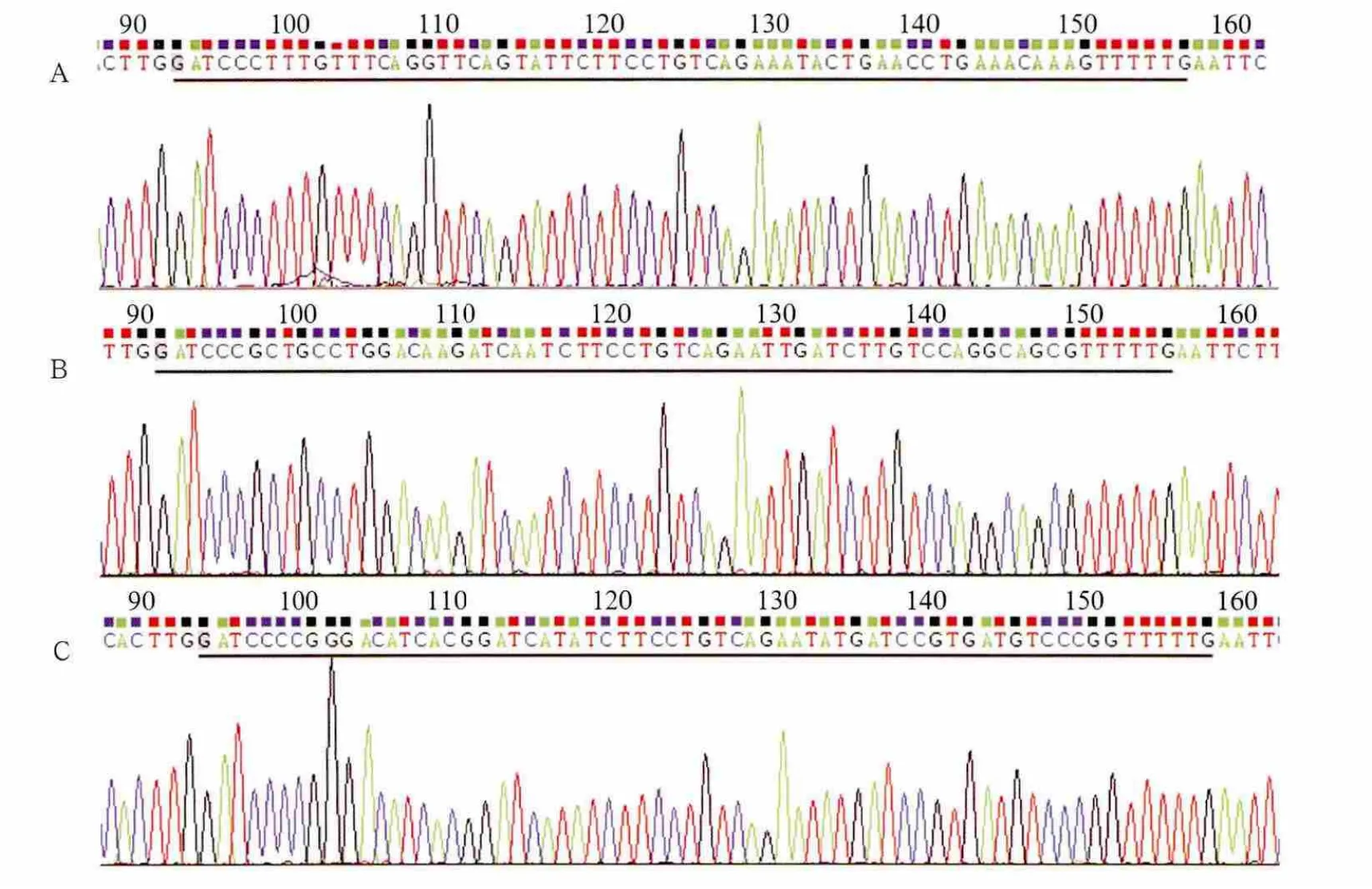
图2 重组载体pLenOR-THM-Notch-1测序图谱Fig 2 The sequencing atlas of recombinant vector pLenOR-THM-Notch-1
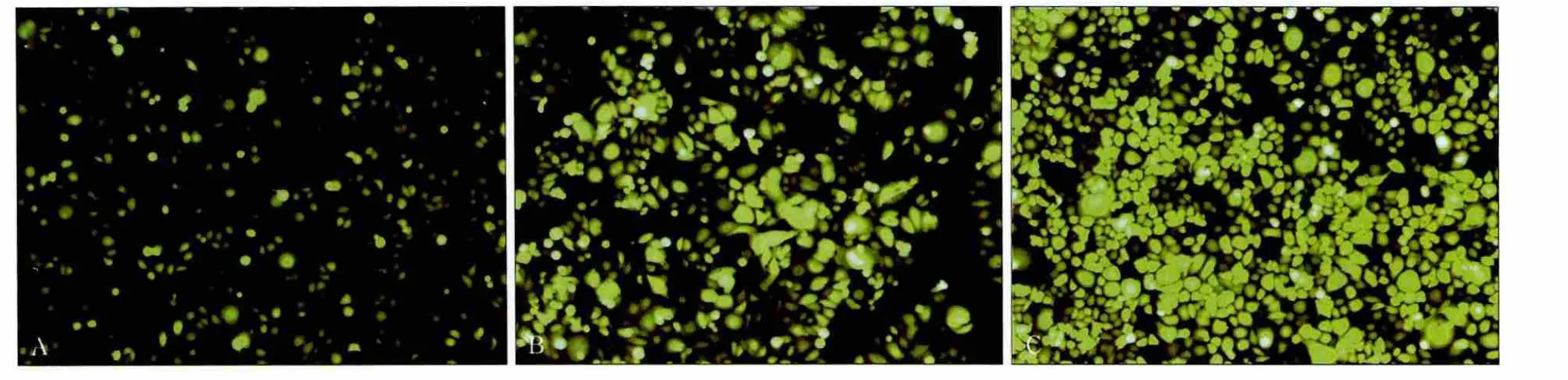
图3 不同数量慢病毒感染293T细胞 荧光显微镜 × 100Fig 3 293T cells infected by different quantity of purified lentivirus fluorescence microscope×100
2.3 PCR检测Notch-1 mRNA的表达
PCR检测结果(图4)表明,阳性对照组的Notch-1 mRNA表达水平与阴性对照组无统计学差异,pLenORNotch-1-shRNA1、2、3组的Notch-1 mRNA表达均低于对照组,其中pLenOR-Notch-1-shRNA1、3组降低最明显。
2.4 Western blot检测Notch-1蛋白的表达
Western blot检测结果(图5)表明,pLenORNotch-1-shRNA1、3组与阴性对照组及阳性对照组相比,Notch-1蛋白表达明显受到抑制,其中pLenORNotch-1-shRNA3组受抑制程度最高;pLenOR-Notch-1-shRNA2组与对照组相比,Notch-1蛋白表达未受抑制。
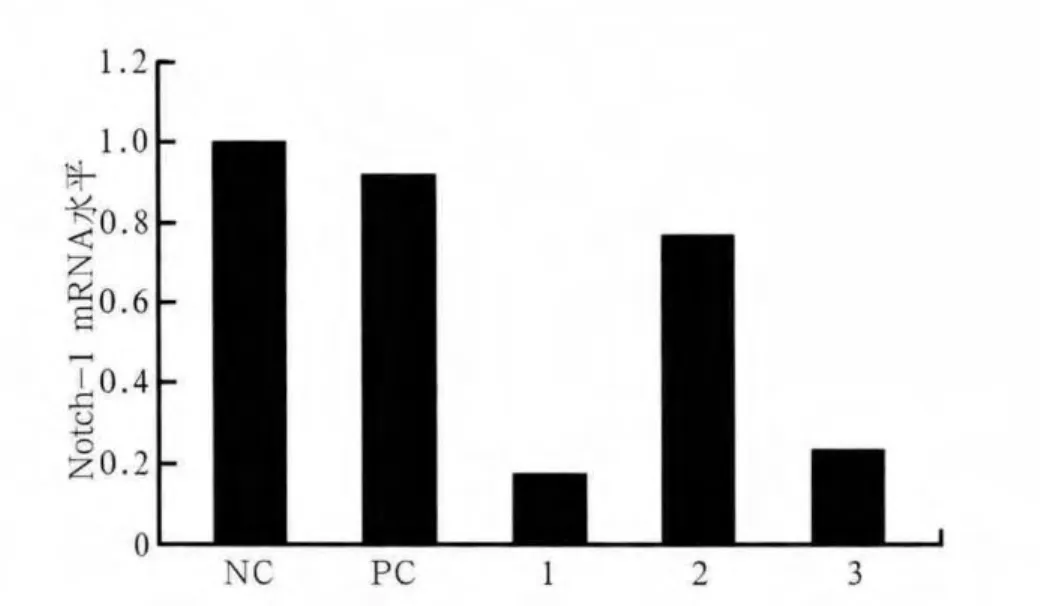
图4 PCR检测各组Notch-1 mRNA水平Fig 4 Notch-1 mRNA levels of each group analyzed by PCR
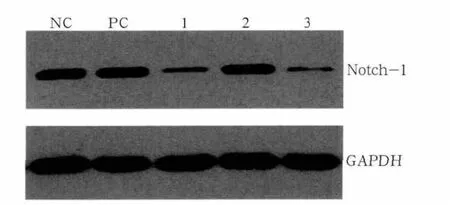
图5 Western blot检测各组Notch-1蛋白表达水平Fig 5 Notch-1 protein levels of each group analyzed by Western blot
3 讨论
Notch家族基因于1919年在果蝇体内发现,该基因的部分功能缺失会在果蝇翅膀的边缘造成缺口(notch),Notch基因由此而得名。1991年,Notch-1在人类的T淋巴母细胞白血病中首先被鉴定出来,表明了Notch信号通路和肿瘤相关[8]。人类的很多肿瘤(如头颈部肿瘤、子宫内膜癌、肾癌、肺癌、乳腺癌、前列腺癌、恶性黑色素瘤等)、血液系统疾病(如霍奇金淋巴瘤、B淋巴细胞白血病等)及一些其他病变(如根尖囊肿)中均发现Notch基因及其配体的异常表达[9-13]。研究[14]表明,通过降低Notch基因的表达,可以抑制人鼻咽癌细胞系的体外增殖能力。Notch-1和Notch-4被认为是乳腺癌的预测因素及潜在的基因治疗靶点[15-16]。组织芯片研究表明,Notch-1在胃癌、胰腺癌中的表达与肿瘤的分化程度、浸润深度等明显相关,这可能是因为Notch-1可促进核转录因子-κB的表达,而后者上调了基质金属蛋白酶-9及血管内皮生长因子导致的浸润[17-18]。研究[19-20]表明,Notch基因的过表达与口腔鳞状细胞癌相关,Notch基因可以作为头颈部鳞状细胞癌癌前病变诊断的候选基因和治疗的新靶基因。
Notch信号通路与SACC的关系尚不明确。学者[5]用限制片段差异显示PCR技术构建了ACC-M和ACC-2细胞株的差异基因表达谱,认为Notch家族基因Notch-1、2、4与SACC的发生、发展、转移有关。本课题前期研究中,结合激光俘获显微切割和人类全基因组芯片技术,首次成功构建出SACC嗜神经侵袭相关基因表达谱,并经过聚类分析和基因功能分析发现,Notch基因在嗜神经侵袭组中特异性高表达[3],这与另外两项SACC基因表达谱的研究结果[21-22]相符合。
RNAi的本质是由发夹样结构的小干扰RNA(small interference RNA,siRNA)介导的与之同源的mRNA特异性降解,进而抑制相应基因表达的过程[23]。通过适当的技术生产特异性的siRNA并使其有效地作用于靶基因的mRNA,就能达到使该基因“沉默”的目的。生成siRNA的方法有化学合成法、体外转录合成法、质粒载体介导的细胞内表达法和病毒载体介导的细胞内表达法等。其中,慢病毒载体是在人类免疫缺陷病毒1基础上改造而成的病毒载体系统,能高效地将目的基因导入动物和人的原代细胞或细胞系,其介导的基因表达作用持续且稳定,目的基因能整合到宿主细胞基因组中,并随细胞基因组的分裂而分裂[24-25]。
本实验成功地构建了Notch-1基因RNAi慢病毒载体pLenOR-THM-Notch-1,并通过双酶切及DNA测序加以鉴定;通过病毒包装、收集和浓缩,得到高滴度慢病毒颗粒,经测定浓缩后的病毒滴度约为5.8×108TU·mL-1;以MOI为1时感染293T细胞后,感染效率达90%以上。结合QRT-PCR和Western blot检测结果,pLenOR-Notch-1-shRNA3对Notch-1基因在mRNA及蛋白水平的抑制作用最为明显。慢病毒载体pLenOR-THM-Notch-1的成功构建为探讨Notch-1基因在SACC中的生物学功能奠定了实验基础。
[1]温玉明. 口腔颌面部肿瘤学[M]. 北京: 人民卫生出版社,2004:502-505.
[2]Fordice J, Kershaw C, El-Naggar A, et al. Adenoid cystic carcinoma of the head and neck: predictors of morbidity and mortality[J]. Arch Otolaryngol Head Neck Surg, 1999,125(2):149-152.
[3]Chen W, Zhang HL, Shao XJ, et al. Gene expression profile of salivary adenoid cystic carcinoma associated with perineural invasion[J]. Tohoku J Exp Med, 2007, 212(3):319-334.
[4]Miele L, Golde T, Osborne B, et al. Notch signaling in cancer[J]. Curr Mol Med, 2006, 6(8):905-918.
[5]卢友光, 杨春桃, 丁林灿, 等. 涎腺腺样囊性癌转移细胞株的Notch基因表达[J]. 福建医科大学学报, 2008, 42(1):6-8.
[6]Tuschl T. Expanding small RNA interference[J]. Nat Biotechnol, 2002, 20(5):446-448.
[7]Reynolds A, Leake D, Boese Q, et al. Rational siRNA design for RNA interference[J]. Nat Biotechnol, 2004, 22(3):326-330.
[8]Ellisen LW, Bird J, West DC, et al. TAN-1, the human homolog of the Drosophila notch gene, is broken by chromosomal translocations in T lymphoblastic neoplasms[J]. Cell,1991, 66(4):649-661.
[9]Nickoloff BJ, Osborne BA, Miele L, et al. Notch signaling as a therapeutic target in cancer: a new approach to the development of cell fate modifying agents[J]. Oncogene, 2003,22(42):6598-6608.
[10]Götte M, Greve B, Kelsch R, et al. The adult stem cell marker Musashi-1 modulates endometrial carcinoma cell cycle progression and apoptosis via Notch-1 and p21WAF1/CIP1[J]. Int J Cancer, 2011, 129(8):2042-2049.
[11]Meliou E, Kerezoudis N, Tosios K, et al. Immunohistochemical expression of Notch signaling in the lining epithelium of periapical cysts[J]. J Endod, 2011, 37(2):176-180.
[12]Meliou E, Kerezoudis N, Tosios K, et al. Notch 1 receptor,Delta 1 ligand and HES 1 transcription factor are expressed in the lining epithelium of periapical cysts (preliminary study)[J]. Open Dent J, 2010, 4:153-158.
[13]Santagata S, Demichelis F, Riva A, et al. JAGGED1 expression is associated with prostate cancer metastasis and recurrence[J]. Cancer Res, 2004, 64(19):6854-6857.
[14]Chen SM, Liu JP, Zhou JX, et al. Suppression of the notch signaling pathway by γ-secretase inhibitor GSI inhibits human nasopharyngeal carcinoma cell proliferation[J]. Cancer Lett, 2011, 306(1):76-84.
[15]Yao K, Rizzo P, Rajan P, et al. Notch-1 and notch-4 receptors as prognostic markers in breast cancer[J]. Int J Surg Pathol, 2011, 19(5):607-613.
[16]Clementz AG, Rogowski A, Pandya K, et al. NOTCH-1 and NOTCH-4 are novel gene targets of PEA3 in breast cancer:novel therapeutic implications[J]. Breast Cancer Res, 2011,13(3):R63.
[17]李大卫, 吴晴, 彭志, 等. 组织芯片研究Notch1与NF-κB在胃癌中的表达和意义[J]. 肿瘤, 2007, 27(6):458-461.
[18]Wang Z, Banerjee S, Li Y, et al. Down-regulation of notch-1 inhibits invasion by inactivation of nuclear factor-kappaB,vascular endothelial growth factor, and matrix metalloproteinase-9 in pancreatic cancer cells[J]. Cancer Res, 2006,66(5):2778-2784.
[19]Snijders AM, Schmidt BL, Fridlyand J, et al. Rare amplicons implicate frequent deregulation of cell fate specification pathways in oral squamous cell carcinoma[J]. Oncogene,2005, 24(26):4232-4242.
[20]Leethanakul C, Patel V, Gillespie J, et al. Distinct pattern of expression of differentiation and growth-related genes in squamous cell carcinomas of the head and neck revealed by the use of laser capture microdissection and cDNA arrays[J]. Oncogene, 2000, 19(28):3220-3224.
[21]Frierson HF Jr, El-Naggar AK, Welsh JB, et al. Large scale molecular analysis identifies genes with altered expression in salivary adenoid cystic carcinoma[J]. Am J Pathol, 2002,161(4):1315-1323.
[22]Patel KJ, Pambuccian SE, Ondrey FG, et al. Genes associated with early development, apoptosis and cell cycle regulation define a gene expression profile of adenoid cystic carcinoma[J]. Oral Oncol, 2006, 42(10):994-1004.
[23]Fire A, Xu S, Montgomery MK, et al. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans[J]. Nature, 1998, 391(6669):806-811.
[24]Blömer U, Naldini L, Kafri T, et al. Highly efficient and sustained gene transfer in adult neurons with a lentivirus vector[J]. J Virol, 1997, 71(9):6641-6649.
[25]Buchschacher GL Jr, Wong-Staal F. Development of lentiviral vectors for gene therapy for human diseases[J]. Blood,2000, 95(8):2499-2504.

