产内切菊粉酶的海洋放线菌菌株的筛选与鉴定
宫 颖,于基成,刘 秋
(大连民族学院生命科学学院,辽宁大连116600)
菊粉又称菊糖,是由D-呋喃果糖分子经β-2,1糖苷键脱水聚合而成的线性直链多糖[1-2]。菊粉酶是一种催化水解菊粉中β-2,1果糖糖苷键的水解酶,可根据对底物作用方式的不同分为外切菊粉酶和内切菊粉酶[3],外切菊粉酶水解菊粉用于生产高果糖浆,内切菊粉酶水解菊粉则用于生产低聚果糖[4-5],研究表明菊粉酶的生产为微生物菌株发酵获得[6]。目前,关于产菊粉酶微生物菌株报道较多,主要集中于曲霉属和酵母菌属[7-8],也有少部分的细菌和极少的放线菌[9]。报道的各种微生物菌株的菊粉酶产量不一,酶活力一般在14.6~20.15U/mL,大多表现为外切菊粉酶活性[10]。因此获得高效产内切菊粉酶微生物菌株具有潜在和重要的工业化应用意义。本研究目的则是从特殊生境—鸭绿江滨海湿地样品中筛选获得产内切菊粉酶菌株,以期获得产高活性内切菊粉酶湿地放线菌菌株,为进一步开展产内切菊粉酶海洋微生物菌株研究奠定基础。
1 材料与方法
1.1 试剂与仪器
菊粉 鞍山生物技术有限公司,纯度>95%;3,5-二硝基水杨酸(DNS) 国药集团化学试剂有限公司,化学纯;L-天门冬酰胺 北京奥博星生物技术责任有限公司;琼脂 日本进口分装;酵母提取物 北京希凯创新科技有限公司;甘油 天津市瑞金特化学品有限公司;乙酸、乙酸钠、K2HPO4·3H2O、KNO3、MgSO4·7H2O、FeSO4·7H2O、MgCl2·7H2O、ZnSO4·7H2O 均为天津市科密欧化学试剂有限公司,所有分析用试剂均为分析纯;海水 取自黄海。
UV-2600紫外可见分光光度计 日本岛津公司;S-4800扫描电子显微镜 日本日电;HYG-3多功能摇床 金坛市杰瑞尔电器有限公司;DNP-9082电热恒温培养箱 上海精宏实验设备有限公司;H-1850R离心机 湖南湘仪实验室仪器开发有限公司等。
1.2 实验方法
1.2.1 培养基 初筛培养基ISP5(g/L):酵母提取物5g,L- 天门冬酰胺 1g,甘油 10mL,K2HPO4·3H2O 0.01g,KNO31g,FeSO4·7H2O 0.01g,MgCl2·7H2O 0.01g,ZnSO4·7H2O 0.01g,琼脂 20g,pH7.2,海水500mL,去离子水500mL,121℃高压灭菌20min。
选择培养基(g/L):菊粉 20g,KNO31g,K2HPO4·3H2O 0.5g,MgSO4·7H2O 0.5g,FeSO4·7H2O 0.01g,琼脂 20g,pH7.2,海水 500mL,去离子水 500mL,112℃高压灭菌20min。
发酵培养基(g/L):菊粉 20g,KNO31g,K2HPO4·3H2O 0.5g,MgSO4·7H2O 0.5g,FeSO4·7H2O 0.01g,海水500mL,去离子水500mL,112℃高压灭菌20min。
1.2.2 菌株的筛选 取新鲜海泥样品5.0g置于45mL无菌水中充分混匀,梯度稀释到10-4后涂布到ISP5培养基上,28℃培养5~7d。用接种环挑取典型单菌落在以菊粉为唯一碳源的选择培养基上分区划线,28℃培养。
1.2.3 孢子菌悬液的制备 将菌种划线于平板上,28℃培养3~5d,用无菌小铲子将孢子轻轻刮下,置于无菌水中稀释至孢子悬液浓度为10-6cfu/mL,然后以4%接种量接入发酵培养基摇瓶培养3d,采用DNS法测定其酶活性。
1.3 DNS法测定菊粉酶的活力
根据苟亚峰等人[11]和 Trivedi等人[12]报道方法并适当改良。发酵液于4℃,8000×g离心20min。取上清液1.0mL,加入4.0mL 2%菊粉溶液(0.2mol/L,pH5.0醋酸缓冲溶液配制)中,50℃反应30min。取反应液1.0mL加入1.5mL DNS混合后沸水浴5min,立即取出流水冷却至室温,加蒸馏水定容至25.0mL,混匀后静置30min,于540nm处测定其吸光度值。取3次平行实验平均值,根据果糖标准曲线计算样品中还原糖含量。
菊粉酶酶活力定义为1min转化生成1μmol还原糖所需的酶量为一个菊粉酶酶活力单位,表示为I值;同理,以4mL 2%蔗糖溶液(0.2mol/L,pH5.0醋酸缓冲溶液配制)替代菊粉溶液进行测定,以1min水解1μmol蔗糖所需的酶量为一个蔗糖酶酶活力单位,以S值表示。
由于许多微生物有菊粉酶活性的同时也伴随着有蔗糖酶活性,通常用I/S比来描述其催化活力,因此,用I/S比值来描述酶的特征;I/S>10时表现为内切菊粉酶活性,I/S<10时表现为外切菊粉酶活性[13-14]。
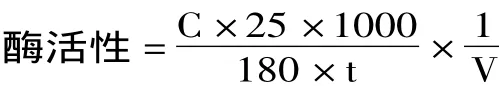
式中,C:还原糖含量(mg/mL);t:反应时间(min);V:反应酶液体积(mL)。
1.4 果糖标准曲线的制备
依照曹泽虹等[15]报道的方法绘制果糖标准曲线。分别取果糖标准溶液 0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6mL于25.0mL刻度试管中,以蒸馏水补足至2.0mL,再分别加入DNS溶液1.5mL,充分混匀后沸水5min,迅速流水冷却并静置回复至室温,蒸馏水定容25.0mL。于540nm处测其吸光值,以果糖含量为横坐标,以各果糖浓度对应的吸光度(Abs)为纵坐标,绘制果糖标准曲线。
1.5 菌株鉴定
1.5.1 培养形态观察 将纯化的菌株接种于固体培养基平板上28℃培养2~7d观察菌落生长特征。
1.5.2 菌丝形态观察 将菌株接种于固体培养基上,将硅片(3mm×10mm,121℃高压灭菌30min)45°插入平板划线处,28℃培养5d。将硅片取出后置于25%戊二醛溶液中,于4℃冰箱中过夜固定,然后分别用40%、70%、90%和100%的乙醇脱水4次后,用醋酸正戊酯置换乙醇。镀金处理后于电子显微镜下观察。
1.5.3 构建系统进化树 采用徐平等[16]人报道的微波法快速提取放线菌基因组DNA。设计引物进行PCR扩增,对PCR产物纯化及测序,用MEGA5.0软件进行拼接,提交到EzBioCloud网站上搜索相近菌株序列,采用MEGA5.0软件中的CLUSTAL-W进行比对,构建系统进化树,确定菌株的分类地位。
2 结果与讨论
2.1 果糖标准曲线
图1为果糖标准曲线,通过线性回归分析,得到回归方程 y=0.2058x-0.0038,其相关系数 R2=0.9996。
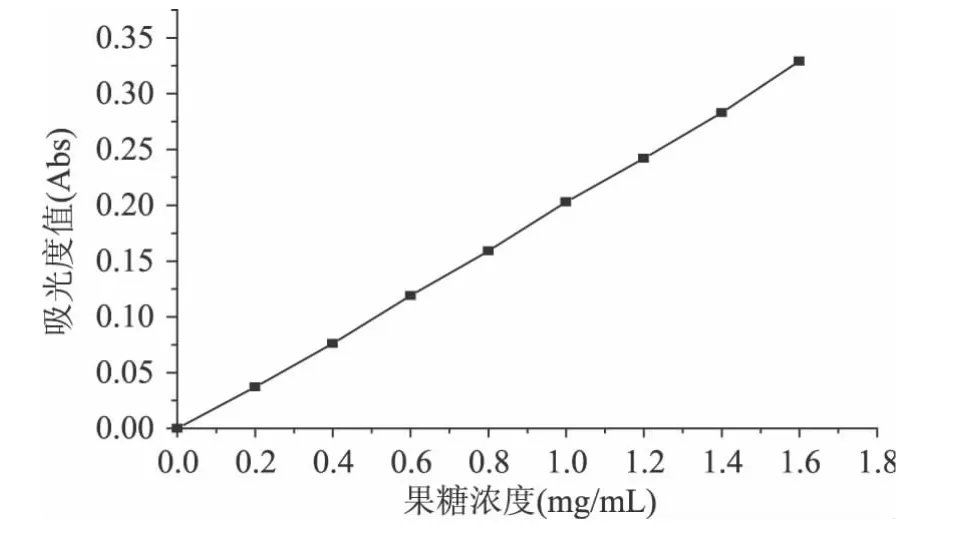
图1 果糖标准曲线Fig.1 Standard curve of fructose
2.2 产内切菊粉酶菌株的筛选
以ISP5作为初筛培养基,经复筛实验获得产菊粉酶菌株14株,产酶活力及其酶活特征见表1。其中菊粉酶活力为3.46~28.52U/mL,有11株菌I/S<10,表现为外切菊粉酶活性,菌株S511酶活力(7.74U/mL)最高。而菌株S502、S503和S505,I/S值均大于10,表现为内切菊粉酶活性,菊粉酶活力分别为14.13、18.24、28.52U/mL。与已报道的来源于土壤样品中产菊粉酶的放线菌属菌株 Streptomyces sp.CP01(1.6U/mL)[17],Streptomyces sp.ALKC4(0.524U/mL)[13],Streptomyces sp.GNDU 1(0.552U/mL)[18]产酶活力相比,该 3 株海洋放线菌具有较高内切菊粉酶活力。

表1 产菊粉酶活力及酶特征(n=3)Table 1 Inulinase activity and the enzyme characteristics(n=3)
2.3 产内切菊粉酶菌株形态观察
菌株S502、S503和S505培养形态分别如图2所示,菌丝和孢子形态分别如图3所示。表2详细描述了待鉴定菌株S502、S503和S505于28℃培养3d后的菌落形态特征,并在扫描电镜下观察其培养5d的菌丝与孢子形态特征。

表2 产内切菊粉酶菌株培养形态、菌丝和孢子形态Table 2 Culture morphology,mycelia and spore characters of the strain producing endoinulinase
2.4 系统进化树分析
筛选获得的产内切菊粉酶菌株S502、S503和S505,通过16S rRNA序列分析,利用MEGA5.0软件建树(图4、图5和图6),确定了其菌株分类地位。菌株 S502、S503、S505与 Streptomyces malachitofuscus NBRC 13059T (AB184282)、Micromonospora echinosporaATCC 15837T(U58532)、Streptomyces carpaticus NBRC 15390T(AB184641)相似度分别为99.227%、99.146%和99.859%。综合菌株形态特征,最终将菌株S502、S503和S505鉴定为孔雀石褐链霉菌 Streptomycesmalachitofuscus、棘 孢小 单 孢 菌Micromonospora echinospora和锂链霉菌Streptomyces carpaticus。
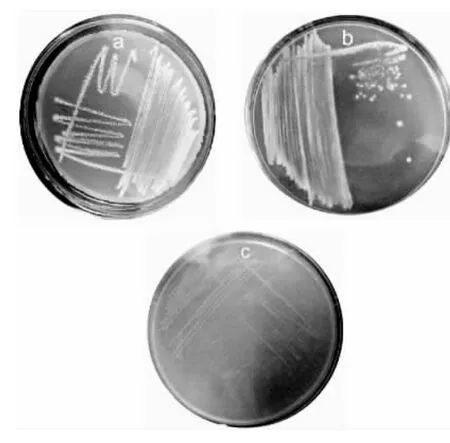
图2 菌株培养形态Fig.2 The colony morphology of strain

图3 菌株S502、S503和S505的菌丝和孢子形态Fig.3 The morphological of mycelia and spore of strain S502,S503 and S505
3 结论与讨论

图4 菌株S502系统进化树Fig.4 Phylogenetic tree of strain S502 based on 16S rRNA sequence

图5 菌株S503系统进化树Fig.5 Phylogenetic tree of strain S503 based on 16S rRNA sequence

图6 菌株S505系统进化树Fig.6 Phylogenetic tree of strain S505 based on 16S rRNA sequence
本研究从鸭绿江滨海湿地海泥样品中初筛获得14株产菊粉酶菌株,复筛获得3株(S502、S503和S505)产内切菊粉酶放线菌菌株,其酶活力分别为14.13、18.24、28.52U/mL,且其 I/S 值分别为 19.67、29.00、15.38。经形态观察和16S rRNA测序及构建系统进化树分析,确定其分类地位分别为孔雀石褐链霉菌 Streptomyces malachitofuscus、棘孢小单孢菌Micromonospora echinospora和锂链霉菌Streptomyces carpaticus。目前报道产菊粉酶的放线菌仅有链霉菌属,但大多表现为外切菊粉酶活性且产酶活力较低,本文所筛选的放线菌不仅产酶活力高,而且种类不一,丰富了我国产内切菊粉酶菌株的种类。此外,这3株菌为海洋放线菌,培养基中添加了一半的海水,全球有71%的海洋区域,如果将来能作为工业酶制剂的生产原料,那么大规模的工业发酵消耗的就是大量的海水,从而节约了淡水资源,这为进一步研究3株放线菌产内切菊粉酶特性和商品绿色化生产及应用奠定了基础。
[1]Wang G Y,Chi Z,Song B,et al.High level lipid production by a novel inulinase-producing yeast Pichia guilliermondii Pcla22[J].Bioresou Technol,2012,124(2):77-82.
[2]Dilipkumar M,Rajamohan N,Rajasimman M.Nulinase production in a packed bed reactor by solid state fermentation[J].Carbohydr Polym,2013,96(1):196-199.
[3]魏微,刘兆普,王琳,等.青霉菌B01产菊粉酶特性的研究及菊粉酶系分析[J].食品科学,2009,30(5):179-183.
[4]Sharma A D,Gill P K.Purification and characterization of heat-stable exo-inulinase from Streptomyces sp.[J].J Food Eng,2007,79(4):1172-1178.
[5]Neagu Bonciu C,Constantin O,Bahrim G.Increase in extracellular inulinase production for a new Rhizoctonia ssp.strain by using buckwheat(Fagopyrum esculentum)flour as a single carbon source[J].Appl Microbiol,2012,55(3):195-201.
[6]黄玉玲,王桂峰,隆小华,等.产菊粉酶菌株的筛选及产酶条件优化[J].食品工业科技,2012,21(33):160-163.
[7]Chen H Q,Chen X M,Chen T X,et al.Optimization of solidstate medium for the production of inulinase by Aspergillus ficuum JNSP5-06 using response surface methodology[J].Carbohydr Polym,2011,86(1):249-254.
[8]Mazutti M,Bender J P,Treichel H,et al.Optimization of inulinase production by solid-state fermentation using sugarcane bagasse as substrate[J].Enzyme Microb Technol,2006,39(1):56-59.
[9]Kobayashi T,Uchimura K,Deguchi S,et al.Cloning and Sequencing of Inulinase and β-Fructofuranosidase Genes of a Deep-Sea Microbulbifer Species and Properties of Recombinant Enzymes[J].Appl Environ Microbiol,2012,78(7):2493-2495.[10]王静,金征宇.微生物菊粉酶的研究进展[J].生物技术,2002,12(2):42-45.
[11]苟亚峰,王丹,孙丹,等.一株产内切菊粉酶菌株培养条件的响应面优化[J].食品工业科技,2013,19(34):135-140.
[12]Trivedi S,Divech J,Shah A.Optimization of inulinase production by a newly isolated Aspergillus tubingensis CR16 using low cost substrates[J].Carbohydr Polym,2012,90(1):483-490.
[13]Sharma A D,Kainth S,Gill P K.Inulinase production using garlic(Allium sativum)powder as a potential substrate in Streptomyces sp.[J].J Food Eng,2006,77(3):486-491.
[14]Wang J,Jin Z,Jiang B,et al.Production and separation of exo-and endoinulinase from Aspergillus ficuum[J].Process Biochemistry,2003,39(1):5-11.
[15]李环,陆佳平,王登进.DNS法测定山楂片中还原糖含量的研究[J].食品工业科技,2013,18(34):75-77.
[16]徐平,李文均,徐丽华,等.微波法快速提取放线菌基因组 DNA[J].微生物学通报,2003,30(4):82-84.
[17]Laowklom N,Chantanaphan R,Pinphanichakarn P.Production,Purification and Characterization of Inulinase from a Newly Isolated Streptomyces sp.CP01[J].Nat Resour,2012,3(3):137-144.
[18]Gill P K,Sharma A D,Harchand,P K,et al.Effect of media supplements and culture conditions on inulinase production by an actinomycete strain[J].Bioresou Technol,2003,87(3):359-362.

