几种保鲜处理对贮藏期间‘红阳’猕猴桃抗氧化生理特性变化的影响
何靖柳,刘 继,黄 彭,秦 文,李素清,沈丽雯
(四川农业大学食品学院,四川雅安625014)
‘红阳’猕猴桃 (Actinidia chinensis Planch.var.rufopulpa Liang et Ferguson)是四川省苍溪县选育出的世界首个红肉型新品种,被列为“国家级品种保护资源”[1]。此类果实突出的特点是果肉细嫩多汁、清香鲜美,横截面呈红、黄、绿相间的图案,绕胎座有放射状红色条纹,极为美观,深受消费者喜爱。很多营养专家一致认为人们日常吃的果蔬能有效的降低某些疾病的发病率,并且发现发挥作用的物质主要是一些抗氧化活性物质及抗氧化酶类;它们通过抑制氧化连锁反应的激活来清除自由基,延迟或抑制油脂及其它成分的氧化[2-3]。研究证明,‘红阳’猕猴桃果实中含大量的抗氧化物质及相应的酶类,包括 VC、总酚、花色苷、SOD、POD、CAT 等;果实在贮藏过程中抗氧化活性逐渐降低,贮藏条件及时间对其抗氧化性的影响很大[4]。
近年来,猕猴桃保鲜主要集中于研究其果实单一的贮藏保鲜条件及贮藏过程中果实的保鲜效果和品质的变化,而对果实复合保鲜处理的条件及贮藏期间果实抗氧化性变化的研究较少[1,5-6]。猕猴桃经一定浓度的1-MCP处理后置于室温下贮藏,能有效抑制果实品质及细胞抗氧化还原水平的变化[7];一定浓度臭氧处理冷藏中的猕猴桃鲜果能使果实长期保持良好的品质及生理活性状态[8];气调贮藏能较好的抑制果实品质的衰变[9];一定的高温处理能使果实内酶失活,抑制抗氧化物质的分解,从而提高其抗氧化活性[10]。
本实验以‘红阳’猕猴桃为原料,研究不同保鲜处理对采后果实抗氧化水平的影响,探讨其贮藏过程中氧化还原调控的机制,从而确定较佳的保鲜条件使果实在贮藏期间维持良好的抗氧化活性。
1 材料与方法
1.1 材料与设备
1.1.1 实验材料 ‘红阳’猕猴桃:采自雅安市中里镇中里村种植专业合作社果园。
1.1.2 实验仪器设备 CPYJ-1700型气调设备 天津市森罗科技发展有限公司;BS210S型电子天平 塞多利斯北京天平有限公司;OZ-3G型臭氧发生器 BNP OZONE TECHNOLOGY CO.LTD;可见分光光度计、紫外分光光度计 上海尤尼柯仪器有限公司;冷冻高速离心机 美国Thermo公司;DHG-9245A型电热恒温鼓风干燥箱 上海一恒科技有限公司;低温冷藏柜 天津市森罗科技发展有限责任公司;HWS24型电热恒温水浴锅 上海一恒科技有限公司等。
1.2 实验方法
1.2.1 处理和方法 选择大小均匀、成熟度(7~8成)基本一致、外表光滑、无机械伤、无病虫害的‘红阳’猕猴桃果实作为实验材料,采后迅速运至四川农业大学食品学院园艺产品采后生理实验室低温冷库,8℃预冷30h后于(4±1)℃贮藏备用。
采用以下4种方式(A、B、C、D)对鲜果进行处理,A处理:将安喜布(规格为25cm×20cm,1-MCP有效质量浓度为0.9mg/L)放在装有猕猴桃的20L密闭贮藏箱中。B处理:用200mg/m3的臭氧处理果实0.5h,处理后打开箱口排除臭氧,每隔7d通一次臭氧。C处理:将猕猴桃果实贮藏于气调实验箱中,其内气体体积比为O25%+CO25%+N290%。D处理:将果实置于40℃恒温水浴锅中浸泡30min,自然晾干。CK:预冷后不作任何处理。将上述各处理组和对照组果实装入贮藏箱中置于(4±1)℃、相对湿度90%~95%的冷藏库内。以上每处理重复三次。贮藏期间所有指标均每隔20d测一次,相关指标有:VC、总酚、花色苷、DPPH·清除率、SOD、POD、CAT。
1.2.2 测定项目
1.2.2.1 VC含量的测定 参照 2,6- 二氯靛酚滴定法[11]。
1.2.2.2 总酚含量的测定 参照 Foiln-Ciocalte比色法[12]。
1.2.2.3 花色苷含量的测定 参照紫外分光光度法[13]。
1.2.2.4 清除DPPH·自由基的测定 参照紫外分光光度法[14]。
1.2.2.5 SOD 活 性 的 测 定 参 照 氮 蓝 四 唑(NBT)法[15]。
1.2.2.6 POD 活性的测定 参照愈创木酚比色法[16]。
1.2.2.7 CAT 活性的测定 参照紫外吸收法[17]。
1.2.3 数据处理 所有测定均重复3次,取其平均值,运用Excel 2007和SPSS19.0软件对数据进行处理分析,并用邓肯氏多重比较法(Duncan’s multiple range test)进行差异显著性检验,p<0.05为显著水平,p<0.01 为极显著水平。
2 结果与分析
2.1 不同处理对果实中抗氧化物质的影响
2.1.1 不同处理对果实VC含量的影响 VC又称抗坏血酸,与组织细胞抗氧化酶系统协调参与多种活性氧的清除,含量越高表明其抗氧化性和抗逆性越强[7]。观察图1可知,猕猴桃是一类VC含量特别高的果实,但很不稳定,在贮藏过程中易受到果实自身代谢作用及周围环境的影响,从而造成大量损失;因此,如何防止VC分解,使果实自始至终保持较高的VC含量就显得十分重要[18]。经各种处理后,VC均呈下降趋势,且经历两个阶段,从贮藏初期到第80d处于速降期,接着进入缓慢下降期;对照组CK果实中VC含量从初始的126.6mg/100g FW 贮藏至120d仅剩39.7mg/100g FW,而 B组贮藏至 120d时还有45.9mg/100g FW,是各种处理中 VC含量最高的一组,与CK组相比差异性极显著(p<0.01),其次是C组,VC含量为44.1mg/100g FW,与CK组比较其差异性也极显著(p<0.01),接着是 A 处理,含 41.8mg/100g FW,与CK组比较其差异性也显著(p<0.05),最后是 D组,低于对照,仅38.2mg/100g FW(见图1)。贮藏过程中,果实VC含量B组>C组>A组>D组,出现此种现象的原因可能是,臭氧能更有效地抑制果实细胞中VC的氧化进程,很好地保持细胞的抗氧化能力,因此B种处理后VC含量的下降最缓慢;猕猴桃经一定浓度的气调处理,也能较好地抑制果实内部组织与环境进行气体交换,延缓细胞VC的氧化,从而使C处理组中VC含量的下降也比较缓慢;1-MCP处理后,在整个贮藏期,果实中VC含量稍微比对照组高一点,但差异不显著,说明1-MCP对果实VC影响不大;VC是热敏性物质,高温会促使其分解,所以样品经热处理后,在贮藏前期,处理组的VC含量立即比CK组低,但在贮藏中后期,可能由于高温处理使果实中的氧化酶失活,抑制VC的氧化分解,从而该处理组 VC含量的下降速度比 CK缓慢[1,5,19-20]。

图1 4种处理对‘红阳’猕猴桃果实VC含量的影响Fig.1 Effects of four treatments on VCcontent of‘Red Sun’kiwifruit
2.1.2 不同处理对果肉总酚含量的影响 酚类物质是芳香烃中苯环上的氢原子被羟基取代所生成的化合物,该羟基上的氢原子不稳定,很容易被细胞内的自由基取代,形成苯氧自由基,因此,酚类物质具有良好的抗氧化活性[21]。图2可知,所有处理组的总酚含量均呈先升后降的趋势;其中,D组和对照组果实在贮藏至第60d达到峰值,而A组、B组、C组均在第80d才出现峰值,且大小依次为:B组>A组>C组;贮至第60d,B、A、C、D处理果实中总酚含量分别比对照组低 2.8% 、6.0% 、10.4% 、15.3%;贮至第 80d,B组果实中总酚含量最高,超过CK组,达355.8mg/100g,是 A 组的 1.06 倍(p > 0.05)、C 组的 1.12 倍(p <0.05)、D 组的 1.37 倍(p < 0.05)、CK 组的 1.45倍(p<0.05);80d以后,不同处理组的果实中总酚含量均缓慢下降,而 B组总酚含量稳居首位,贮到120d,含量为295.7mg/100g,接着依次是:A 组、C 组、D组、CK组。结果表明:与对照相比,各处理均能不同程度抑制果实中总酚含量的变化,同时,B处理后总酚含量变化最缓慢,接着依次是A、C、D处理;此结果可能与各处理对果实中相关酶活性的影响有关,一定浓度的A、B、C处理抑制了合成酚类物质酶活性的变化,从而延缓其峰值的出现,降低贮藏后期酚类物质含量的减少,其中,B处理抑制效果最明显,其次是A、C处理,而D处理对酶活性影响不大,使其峰值出现时间与对照相同[12]。

图2 4种处理对‘红阳’猕猴桃果肉总酚含量的影响Fig.2 Effects of four treatments on phenols content in‘Red Sun’kiwifruit
2.1.3 不同处理对果肉中花色苷含量的影响 ‘红阳’猕猴桃果实在成熟时果肉呈红色,这是由果肉中的花色苷决定的[22-24]。果实在不适宜的贮藏条件下,果肉组织中的花色苷容易降解,从而降低其抗氧化能力,因此,在贮藏保鲜过程中,防止花色苷的分解是非常重要的。
如图3所示,所有猕猴桃果实在整个贮藏过程中,其花色苷含量均减少;且B处理的下降趋势最缓慢,其次是A处理,接着是C、D处理,下降最急促的是CK组;贮藏至120d时,B组的花色苷含量高达13.6nmol/g FW,是 A 处理的1.17 倍(p <0.01),是 C 处理的1.32 倍(p <0.01),是 D 处理的1.64 倍(p <0.01),是 CK 处理的 2.19 倍(p<0.01),其两两之间的差异性均极显著,表明B处理对于保持果实中花色苷含量效果最好,接着依次是:A>C>D。所有组果实贮藏前60d花色苷含量的下降速率均强于60~120d(见图3);出现此种结果的原因可能与果实酸度有密切的联系,研究证明:花色苷为水溶性色素,在酸性条件下较稳定,且花色苷的含量与果实的酸度呈正相关;果实的可滴定酸含量在贮藏前60d下降较急促,后60d趋于缓慢[25],因此,果实中花色苷含量也出现类似的变化趋势。

图3 4种处理对‘红阳’猕猴桃果实花色苷含量的影响Fig.3 Effects of four treatments on anthocyanin content in‘Red Sun’kiwifruit
2.2 猕猴桃果肉总抗氧化能力的测定
DPPH·是以氮为中心的自由基,可以稳定存在于有机溶液中,其甲醇溶液呈深紫色,于517nm处有一个特征吸收峰,当遇到自由基清除剂时,自由基上的孤对电子被配对,使其在517nm处的吸收消失或减弱[12]。因此,通过测定吸光度可以反映猕猴桃中抗氧化物质对羟基自由基清除的能力。
图4是果实在贮藏过程中抗氧化物质与DPPH·清除率之间的关系图,由图可知,猕猴桃果肉对DPPH·均有一定的清除能力,且在贮藏期间,其清除率整体呈先升后降的趋势;贮至60d以前,对照组果实中抗氧化物质对DPPH·的清除能力居首位,其清除能力强弱顺序依次为:CK>B>A>C>D;贮至80d以后,对照组果实对DPPH·的清除能力较其他处理组最低,而B组最高;贮至120d,B处理组清除能力仍高达69.5%,比 A 组高 5.6%(p <0.05),比 C 组高7.9%(p < 0.05),比 D 组高 19.8%(p < 0.01),比CK 组高22.7%(p <0.01),出现此种现象可能与果实中抗氧化物质的含量相关。
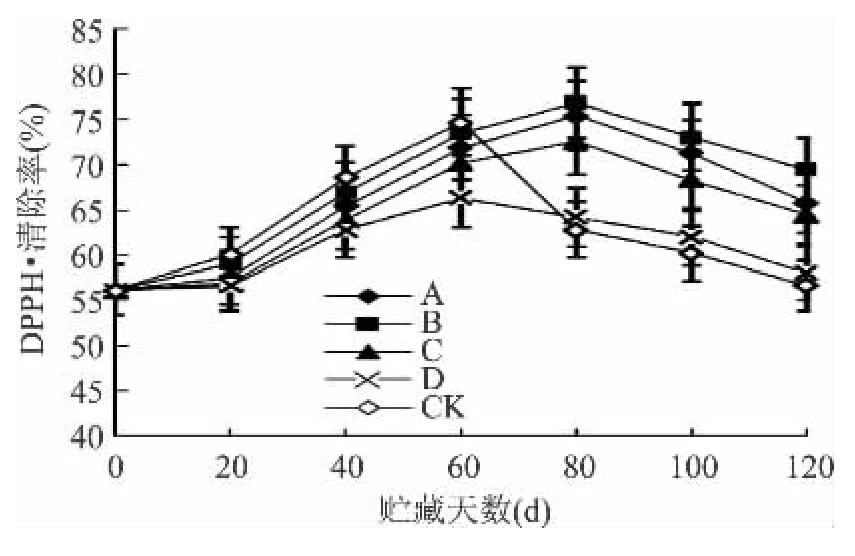
图4 猕猴桃贮藏过程中抗氧化能力的变化Fig.4 Changes of antioxidant activity from kiwifruits during postharvest period
2.3 猕猴桃果肉中抗氧化物质与DPPH·清除率之间的相关性
以下通过SPSS19.0软件对果肉中抗氧化物质与DPPH·清除率进行相关性分析,见表1。
由表1可知,猕猴桃果肉中总酚(r=0.994)、花色苷(r=0.949)和抗氧化能力(DPPH·清除率)之间呈显著性正相关,且极显著(p<0.01),而 VC(r=0.667)与DPPH·清除率没有显著的相关性。出现以上结果的原因可能是,DPPH·清除率反映的是对羟自由基的清除效果,而VC的抗氧化能力主要是通过对细胞中的氧自由基进行清除来体现的;因此,果肉中的总酚及花色苷对其羟自由基的清除率贡献很大。
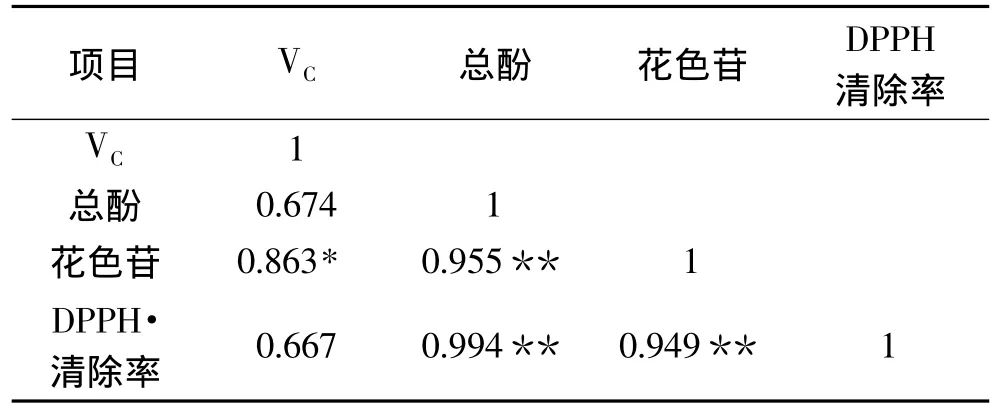
表1 猕猴桃抗氧化物质与DPPH·清除率之间的相关性Table 1 Correlation between antioxidant compounds and elimination of DPPH·
2.4 不同处理对果实抗氧化酶活性的影响
2.4.1 不同处理对果实SOD活性的影响 研究证明,植物在正常代谢及各种环境胁迫下均存在活性氧和自由基的产生和消除,而新鲜的猕猴桃细胞内这些物质的积累会引起果实组织结构和功能的破坏[26]。为防止其伤害,植物体需要启动一系列抗氧化酶系统清除这些物质;其中,SOD是活性氧清除系统中第一个发挥作用的抗氧化酶;该酶具有维持活性氧代谢平衡和保护细胞膜结构的功能[4]。图5可知,所有果实的SOD活性均在贮藏前期逐渐增加,达到峰值后下降;同时,除了CK及D处理组在第40d出现峰值,其它处理都在贮藏60d才出现活性高峰;不同处理组SOD活性出现的峰值高低有所差异,B>A>C>D,对照组CK的峰值最小,仅为342.0U/g FW,B组是 CK 组的 1.20 倍(p < 0.05),A 组是 CK 组的 1.13倍(p< 0.05),C 组是 CK 组的 1.10 倍(p < 0.05),D组是 CK 组的1.05倍(p<0.05)。果实贮藏120d时,处理组B的SOD活性仍可达149.0U/g,其活性极显著高于其他组(p<0.01)。结果表明,臭氧处理能使果实SOD活性始终保持较高的水平,其次是1-MCP处理,接着依次是气调和热激处理。
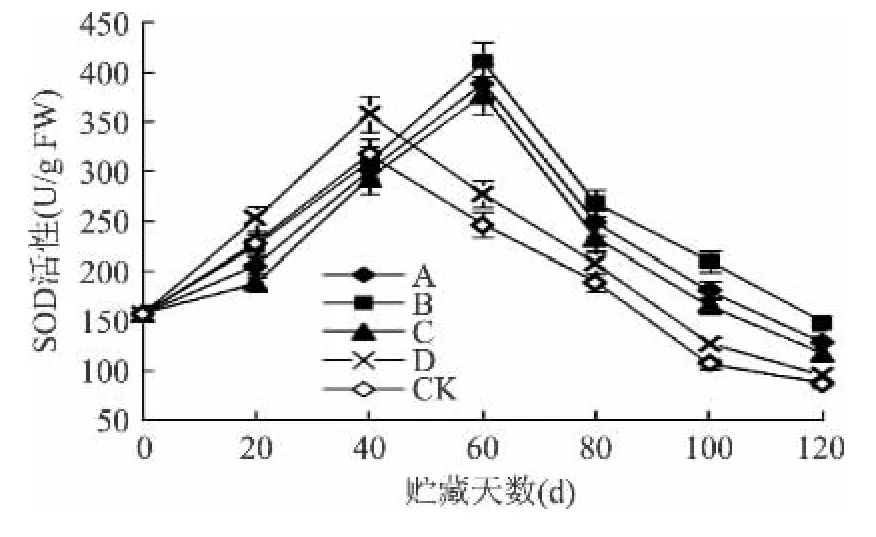
图5 4种处理对‘红阳’猕猴桃果实SOD活性的影响Fig.5 Effects of four treatments on SOD activity of‘Red Sun’kiwifruit
2.4.2 不同处理对果实POD活性的影响 POD作为活性氧清除剂,广泛存在于植物体内不同组织中,它与呼吸作用、光合作用、生长素的氧化、体内代谢状况以及对外界环境的适应性等都有关系,在植物生长发育过程中它的活性不断地发生着变化[27]。图6是‘红阳’猕猴桃在贮藏期间POD活性的变化情况,由图可知,所有组的POD活性均先上升后下降,峰值都高于对照组,且B>A>C>D;同时,果实在贮藏后期仍能保持较高的POD活性;对照组CK的峰值仅为166.0U/(mg FW·min),其值比 B 组低 44.6%(p <0.01),B 组贮到120d,POD 活性仍为98U/(mgFW·min);比 A 组低 33.1%(p < 0.01),比 C 组低 18.1%(p <0.01),比 D 组低 8.4%(p < 0.01);经 B、A 和 C 组处理后,果实的POD活性被延迟20d出现峰值,而处理组D峰值出现的时间和对照组一致,未受任何影响。大量数据表明,臭氧、1-MCP和气调处理均能明显抑制猕猴桃果实POD活性,使POD活性高峰出现时间推迟,从而延缓果实的成熟和衰老。
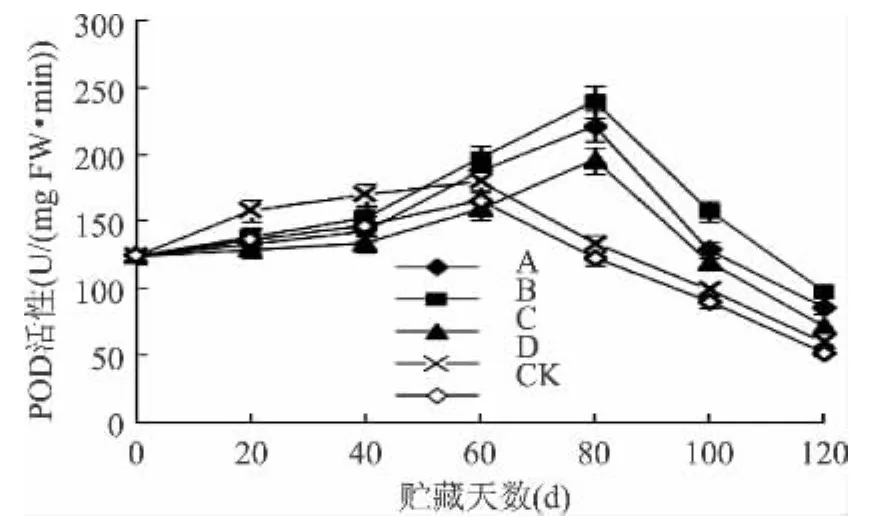
图6 4种处理对‘红阳’猕猴桃果实POD活性的影响Fig.6 Effects of four treatments on POD activity of‘Red Sun’kiwifruit
2.4.3 不同处理对果实CAT活性的影响 CAT是植物体内重要的又一抗氧化酶,可以清除植物体内的活性氧和自由基,从而对植物起到保护作用。图7可知,所有组果实在贮藏过程中,CAT活性整体呈先上升后下降的趋势;D和CK处理组,CAT活性在贮藏至第40d便达到峰值,而A、B、C处理在第60d才出现活性高峰,且峰值高低顺序依次为:B>A>C>D>CK;CK组的CAT活性峰值仅为11.9 U/(g FW·min),比 B 处理低 43.1%(p < 0.01),比 A 低 36.0%(p <0.01),比 C 低 27.9%(p < 0.01),比 D 处理低 7.0%。上述结果表明:所有处理对提高CAT活性均有一定的效果;其中D处理虽然不能延缓CAT活性高峰的出现,但能显著提高其峰值,对果实也有一定的保护作用;B、A、C处理都能较好地延缓CAT活性高峰的来临,且不同程度增加其峰值大小,B组贮到120d,CAT活性仍为 9.8U(gFW·min)。因此,臭氧、1-MCP、气调、热激处理后置于低温下贮藏的猕猴桃,可不同程度提高其果实细胞内CAT的活性,以增强活性氧清除能力、提高其各种抗逆境胁迫能力、减少活性氧积累对细胞膜的损伤,从而有效地延缓了果实的后熟衰老。

图7 4种处理对‘红阳’猕猴桃果实CAT活性的影响Fig.7 Effects of four treatments on CAT activity of‘Red Sun’kiwifruit
3 结论与讨论
本研究结果表明,果实分别经1-MCP、臭氧、气调及热激处理后置于低温下贮藏,均可有效地抑制猕猴桃非酶类抗氧化物质的分解及抗氧化酶活性的下降,从而维持其良好的抗氧化能力;比较各种处理,发现果实在臭氧条件下处理后保鲜效果最佳。猕猴桃鲜果用200mg/m3的臭氧处理0.5h后于(4±1)℃、相对湿度90%~95% 的条件下贮藏,可有效抑制VC的降解,贮藏至第120d,其含量高达45.9mg/100g;推迟果实总酚含量峰值的出现,延缓总酚的减少,贮至120d,其含量仍有295.7mg/100g;延缓了果肉中花色苷含量的消退,使其一直保持较高的值,贮至终期,仍含13.6nmol/g FW;显著推迟了SOD峰值的出现,并始终保持其较高的活性,POD、CAT与SOD表现出平行性,三者均随抗逆性降低而降低,该现象与郭叶[28]对‘徐香’猕猴桃保鲜过程中 SOD、POD、CAT 活性变化的研究结论一致,贮藏至120d,SOD、POD、CAT 分别为 149.0U/g FW、98.0U/(mg FW·min)、9.8U/(g FW·min)。
通过对非酶类抗氧化物质及DPPH·清除率相关性进行分析,发现总酚及花色苷对果肉中羟自由基的清除贡献较大,而VC主要是对氧自由基进行清除来实现其抗氧化能力[29]。猕猴桃果实经几种保鲜处理后,SOD、POD、CAT均呈先增后减的趋势,且出峰时间及峰值的大小存在不同程度的差异,对比各种处理,发现臭氧处理效果最优,其次是1-MCP,接着是气调和热激。出现此种结果的原因可能是:臭氧通过细胞膜进入细胞内部,增加细胞内氧气的浓度,从而激发果实内活性氧清除系统中酶的产生,大大提高SOD、POD、CAT活性,增强了果实的抗逆性;1-MCP也主要通过刺激果实内部活性氧清除系统中酶的产生,从而维持较高的SOD、POD、CAT的活性,能更好地清除细胞内活性氧,减少活性氧对膜的损伤,达到延缓果实衰老、延长贮藏期的目的;5%O2+5%CO2气体比例条件是植物生长的非正常环境,当猕猴桃鲜果在此条件下贮藏时,会诱导果实产生抵御逆境的活性物质,使SOD、POD、CAT活性显著高于对照组,降低有害物质的积累,使果实得到很好的保鲜;高温胁迫初期,SOD、POD、CAT活性显著升高(见图5~图7),可能是由于高温逆境促使果实提高自身抗氧化酶活性,从而减少或清除活性氧,维持细胞的正常生理功能,这是植物的保护性应激反应,但这种抗氧化酶的防御能力是有限的,随着高温胁迫时间的延长,逐渐超过植物所能承受的极限,从而使酶的活性中心被破坏,酶活性下降,导致猕猴桃果实内活性氧大量积累,造成高温伤害[1,5-6,21]。
综上所述,在臭氧处理低温贮藏条件下,‘红阳’猕猴桃抗氧化性明显优于其他处理组及对照,该种处理在果蔬保鲜方面具有一定的先进性,本文研究结果为建立基于‘红阳’猕猴桃抗氧化体系的臭氧保鲜技术提供一定的参考,进一步阐明臭氧贮藏技术是一项值得推广应用且具有广阔发展前景的保鲜技术,同时,应加强臭氧处理对果实中SOD、POD、CAT等活性氧代谢酶调节机制的研究工作。
[1]王瑞玲.红阳猕猴桃采后病害生理及臭氧保鲜技术研究[D].雅安:四川农业大学,2010.
[2]Leong S Y,Oey I.Effects of processing on anthocyanins,carotenoids and vitamin C in summer fruits and vegetables[J].Food Chem,2012,133(4):1577-1587.
[3]Peschel W,Sánchez-Rabaneda F,Diekmann W,et al.An industrial approach in the search of natural antioxidants from vegetable and fruit wastes[J].Food Chem,2006,97(1):137-150.
[4]郭润姿,白阳,郭文岚,等.减压贮藏对番茄果实抗氧化物质和抗氧化酶的影响[J].食品工业科技,2013,34(8):338-341,368.
[5]杨丹.1-MCP对红阳猕猴桃果实采后品质、后熟及酚类抗氧化活性的影响[D].重庆:西南大学,2011.
[6]PiotrL,TomaszK,PawelJ.Changesin postharvest physicochemical and sensory characteristics of hardy kiwifruit(Actinidia arguta and its hybrid)after cold storage under normal versus controlled atmosphere[J].Postharvest Biol Technol,2014,88:21-33.
[7]千春录,陶蓓佩,陈方霞,等.1-MCP对猕猴桃果实品质和细胞氧化还原水平的影响[J].保鲜与加工,2012(2):9-13.
[8]曹彬彬,董明,赵晓佳,等.不同浓度臭氧对皖翠猕猴桃冷藏过程中品质和生理的影响[J].保鲜与加工,2012,12(2):5-8,13.
[9]袁云香.猕猴桃的储藏与保鲜技术[J].北方园艺,2011(6):168-170.
[10]田维娜,曾凯芳.热处理对果蔬采后贮藏特性的影响[J].食品工业科技,2007(12):190-192.
[11]黎继烈,彭湘莲,钟海雁,等.臭氧保鲜处理对金橘采后生理的影响[J].中国食品学报,2007(3):112-115.
[12]王华,曹婧,翟丽娟,等.猕猴桃果肉提取物抗氧化活性研究[J].华北农学报,2013(2):144-149.
[13]熊庆娥.植物生理学实验教程[M].成都:四川科学技术出版社,2003:146.
[14]Cetkovic G S,Canadanovic-Brunet J,Dilas M.Ultrasonicassisted extraction flavonoids and ability to scavenge 1,1-diphenyl 2-picrylhydrazyl(DPPH)radicals from medlar(a Miller)leaves and fruits[J].J Serbian Chem.Society,2012,77(10):1381-1389.
[15]武维华.植物生理学[M].北京:科学出版社,2003:506.
[16]萧浪涛,王三根.植物生理学实验技术[M].北京:中国农业出版社,2005:262.
[17]王晶英,敖红,张杰,等.植物生理生化实验技术与原理[M].哈尔滨:东北林业大学出版社,2003:82-83,135-138,200.
[18]Hancock R D,Viola R.Biosynthesis and catabolism of L-Asoorbic acid in plants[J].Crit Rev Plant Sci,2005,24(3):167-188.
[19]Lallu N,Burdon J,Billing D.Effect of Carbon Dioxide Removal Systems on Volatile Profiles and Quality of‘Hayward’Kiwifruit Stored in Controlled Atmosphere Rooms[J].Hort Technol,2005,15(2):253-260.
[20]刘延娟,董明,王强,等.热处理对‘皖翠’猕猴桃贮藏生理及品质的影响[J].安徽农业科学,2010(16):8636-8638.
[21]马杰,胡文忠,毕阳,等.鲜切果蔬活性氧产生和抗氧化体系代谢的研究进展[J].食品科学,2013(7):316-320.
[22]陈守江,姜松.果蔬贮藏过程中内源总抗氧化活性的变化[J].食品科学,2004(6):172-175.
[23]杨刚.红阳猕猴桃果实色素变化规律和影响因素的研究[D].重庆:四川农业大学,2011.
[24]Comeskey D J,Montefiori M,Edwards P J,et al.Isolation and structural identification of the anthocyanin components of red kiwifruit[J].J Agric Food Chem,2009,57(5):2035-2039.
[25]何靖柳,刘继,秦文,等.贮藏处理后红阳猕猴桃的品质变化[J].食品工业科技,2014(8):318-322.
[26]杨青珍,饶景萍,王玉萍.‘徐香’猕猴桃采收后逐步降温处理对果实冷害、品质和活性氧代谢的影响[J].园艺学报,2013(4):651-662.
[27]王毅,陈蕤坤,朱勋路,等.不同热激处理对菊花抗氧化相关酶活性的影响[J].北方园艺,2010(9):98-101.
[28]郭叶.‘徐香’猕猴桃贮藏期间生理品质研究[D].杭州:浙江农林大学,2013.
[29]沈勇根,蔡志鹏,江慎华,等.丁香非挥发性成分抗氧化活性[J].农业机械学报,2012(10):131-137.

