Nutlin-3对人A375黑素瘤细胞生物学行为的影响及可能机制
丁小杰 魏大鹏 陈菊萍
Nutlin-3对人A375黑素瘤细胞生物学行为的影响及可能机制
丁小杰 魏大鹏 陈菊萍
目的观察顺式咪唑啉衍生物nutlin-3对人A375黑素瘤细胞生物学行为的影响,研究其机制。方法将A375细胞分为实验组和对照组,实验组细胞接受2.5、5、10 μmol/L nutlin-3处理,对照组细胞采用二甲基亚砜处理。分别于作用24、48、72 h后,噻唑蓝(MTT)法检测细胞增殖情况;Western印迹检测p53蛋白表达的改变;流式细胞仪检测细胞周期分布以及细胞凋亡;Transwell法检测迁移性变化。采用重复测量的方差分析进行统计学检验。结果2.5、5、10 μmol/L nutlin-3处理A375细胞24、48、72 h后,MTT法显示不同时间点间的增殖抑制率差异有统计学意义(F=67.43,P<0.01),不同浓度间的抑制率差异有统计学意义(F=135.58,P<0.01),浓度越高抑制率越高;时间和浓度之间有交互作用(F=26.95,P<0.01)。Western印迹、流式细胞仪、Transwell法检测显示,不同时间点之间A375细胞的p53表达、G2期细胞百分率、凋亡率、迁移抑制率差异均有统计学意义(F值分别为1255.00、831.38、809.45、1100.00,均P<0.01),除p53外,时间越长各项指标值越高;不同浓度间各项指标值差异均有统计学意义(F值分别为9196.00、267.99、723.83、1667.00,均P<0.01),浓度越高各项指标值越高;时间与浓度之间交互作用有统计学意义(F值分别为826.79、21.602、44.48、313.09,均P<0.01)。结论Nutlin-3可能通过p53蛋白积累途径抑制人A375细胞的增殖和迁移,促进细胞周期停滞和细胞凋亡。
nutlin-3;黑色素瘤,实验性;细胞周期;细胞凋亡;细胞运动
抑癌基因p53在保护遗传稳定性中起关键的作用。由紫外线引起的p53突变在黑素瘤中很罕见,只是其表达处于低水平,这是因为双微体基因-2(double minute 2,啮齿类为MDM2,人类为HDM2)编码的产物与p53蛋白结合[1],促进p53蛋白降解。Nutlin-3是众多MDM2抑制剂中的一类,Vassilev等[2]发现,在野生型p53肿瘤细胞中,nutlin-3重建p53通路,诱导细胞周期停滞,促进细胞凋亡。本实验使用MDM2抑制剂nutlin-3作为诱导p53积累的药理学工具,初步探讨其对人A375细胞生物学行为的影响。
材料和方法
一、材料
永生化人黑素瘤细胞株A375细胞系产自中国科学院上海细胞生物学研究所,nutlin-3产自美国Sigma公司。二甲基亚砜(DMSO)产自生工生物工程(上海)股份有限公司,p53抗体(一抗)产自美国CST公司,辣根过氧化物酶标记的二抗产自生工生物工程(上海)股份有限公司,2,2-联喹啉-4,4-二甲酸二钠(BCA)试剂盒产自南京凯基生物有限公司,硝酸纤维素膜(NC膜)产自美国Millipore公司,噻唑蓝(MTT)产自美国Sigma公司,碘化丙锭(PI)细胞周期检测试剂盒(KGA512)和膜联蛋白V(Annexin V)-异硫氰酸荧光素(FITC)凋亡检测试剂盒产自南京凯基生物科技有限公司,细胞外基质(ECM)产自美国Sigma公司。12孔板Transwell小室产自美国Corning公司,倒置相差显微镜(CKX41-32PH)产自日本Olympus公司,ZS-3型酶联免疫检测仪产自北京市新风机电技术公司,流式细胞仪产自美国Beckman公司。
二、方法
1.细胞培养:A375细胞于37℃、5%CO2条件下培养于含10%(v/v)胎牛血清的1640培养基中。传代计数以105个/ml的密度均匀接种于培养皿和6孔板中继续培养,将生长良好处于对数生长期的细胞用于实验。
2.试剂配制:Nutlin-3用DMSO配制成2.5、5、10 μmol/L 浓度。
3.实验分组及处理:将A375细胞分为实验组和对照组,实验组细胞接受不同浓度nutlin-3(2.5、5、10 μmol/L)处理,对照组细胞采用DMSO处理。
4.MTT法检测nutlin-3对A375细胞增殖的影响:分组处理后A375细胞在37℃、5%CO2培养箱中分别培养 24、48、72 h 后,每孔加入 5 g/L MTT 10 μl,再孵育 4 h。 去上清,加入 DMSO 200 μl/孔,在 ZS-3酶标仪上测定每孔吸光度(A)。肿瘤细胞增殖抑制率=(1-实验组A值/对照组A值)×100%。
5.Western印迹检测p53蛋白的表达:不同浓度 nutlin-3(2.5、5、10 μmol/L)作用 A375 细胞 24、48、72 h后,分别用0.25%胰蛋白酶消化,14 000×g4℃离心5 min,PBS洗3次,加入适当体积的细胞裂解液。样品在10%聚丙烯酰胺凝胶上电泳,结束后将蛋白转移至NC膜上,用含5%脱脂奶粉的磷酸盐缓冲液(PBS)封闭1 h,加入一抗(p53抗体),4℃过夜,PBS洗3次,加入辣根过氧化物酶标记的二抗,室温1 h,X线胶片显影,扫描,Image J软件分析图片条带,得出蛋白条带峰面积值。
6.碘化丙锭(PI)染色流式细胞仪检测A375细胞周期分布:分别于药物作用24、48、72 h后,吸出上清培养液,胰酶消化,收集细胞,1 000 r/min(离心半径12 cm)离心5 min,PBS洗2次,70%冰乙醇过夜。离心,弃上清,PBS洗2次,移至流式管中,加入100 μl RNaseA 37 ℃水浴 30 min;再加入 400 μl PI染色混匀,4℃避光30 min,流式细胞仪上样,在488 nm激发波长下测定细胞DNA的含量,并用Multicyde分析软件进行分析,得出处于G0/G1、S和G2/M各期的细胞比例。
7.Annexin V-FITC染色流式细胞仪检测A375细胞凋亡:分别于药物作用24、48、72 h后,吸出上清培养液,胰酶消化,收集细胞,制备成单细胞悬液,重悬于500 μl结合缓冲液,加入5μl Annexin VFITC,混匀后,加入5 μl PI,室温避光反应5~15 min,上机检测。
8.Transwell法检测A375细胞的侵袭迁移:调节A375细胞密度为4×105个/ml,用含1%牛血清白蛋白(BSA)的无血清RPMI 1640重悬细胞,加入Transwell上室中,实验组加入不同浓度nutlin-3(2.5、5、10 μmol/L),对照组加入相同体积 DMSO,Transwell下室加入含10%小牛血清的RPMI 1640,分别培养24、48、72 h后加 2%多聚甲醛固定细胞5 min,结晶紫溶液染色20 min,用PBS洗Transwell小室3次,倒置相差显微镜(400倍)下观察和拍照,加入脱色液,于ZS-3型板式酶标仪570 nm波长处检测A值。迁移抑制率 =(1-实验组A值/对照组A值)×100%。
三、统计学分析
采用SPSS11.0软件处理数据,进行重复测量的方差分析,P<0.05为差异有统计学意义。
结 果
一、Nutlin-3对A375细胞增殖的影响
不同浓度 nutlin-3(2.5、5、10 μmol/L)能够抑制A375细胞的增殖,如图1所示,2.5、5、10 μmol/L nutlin-3 作用 24 h后,增殖抑制率(n=3)分别为(7.106±2.709)%、(13.417 ± 2.383)% 、(18.078 ±3.062)%;48 h的抑制率分别为(23.560±1.554)%、(39.786 ± 7.076)%、(53.548 ±3.600)%;72 h的抑制率分别为(21.971±6.586)%、(48.317 ± 10.421)%、(71.856 ±2.188)%。不同时间点之间的增殖抑制率差别有统计学意义(F=67.43,P<0.01),48 h时抑制率最大,与24 h抑制率差别有统计学意义,而与72 h的抑制率差别无统计学意义;不同浓度间的抑制率差别有统计学意义(F=135.58,P<0.01),浓度越高抑制率越高;时间和浓度之间有交互作用(F=26.95,P<0.01)。
二、Nutlin-3对A375细胞p53蛋白表达的影响
不同浓度 nutlin-3(2.5、5、10 μmol/L)处理 A375细胞后,细胞内p53被激活,表达增多。如表1所示,不同时间点p53表达差异有统计学意义(F=1255.00,P<0.01),不同时间表达不同;不同浓度间的p53表达差异有统计学意义(F=9196,P<0.01),浓度越高,p53表达越高。时间与浓度之间交互作用有统计学意义(F=826.79,P<0.01)。见图2。
三、Nutlin-3对A375细胞周期分布的影响
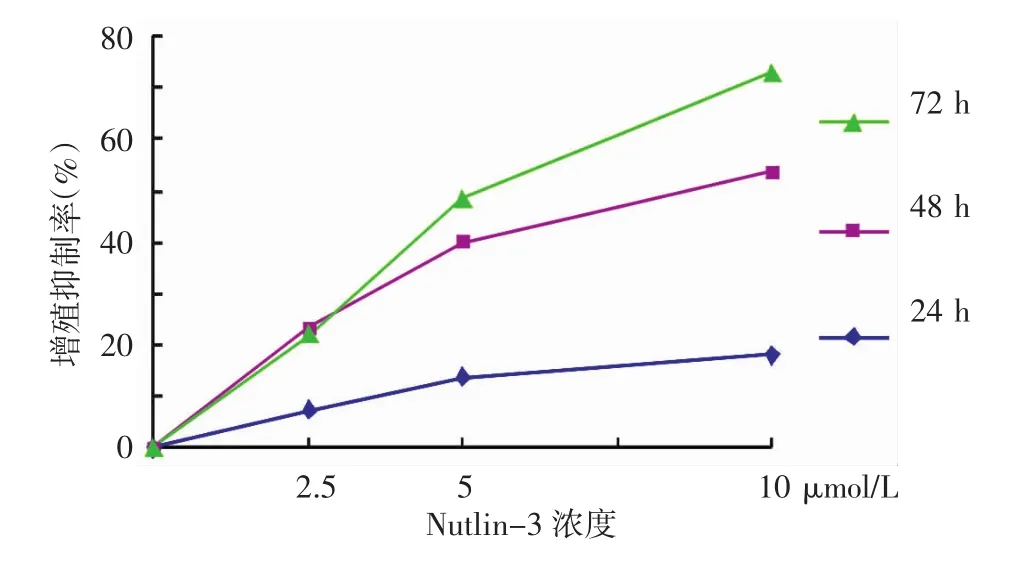
图1 Nutlin-3对A375细胞增殖的抑制率
Nutlin-3作用于 A375 细胞 24、48、72 h 后,与对照组比较,不同浓度 nutlin-3(2.5、5、10 μmol/L)对A375细胞的细胞周期具有阻滞作用。如表1所示,不同时间点A375细胞G2期分布差异有统计学意义(F=831.38,P<0.01),时间越长G2期细胞比例越高。不同浓度间A375细胞G2期分布差异有统计学意义(F=267.99,P<0.01),浓度越高A375细胞G2期比例越高。时间与浓度之间交互作用有统计学意义(F=21.60,P<0.01)。图3为nutlin-3作用48 h后人A375黑素瘤细胞周期G2期的分布。
表1 Nutlin-3对A375细胞p53表达、G2期比例及A375细胞凋亡的影响(±s)

表1 Nutlin-3对A375细胞p53表达、G2期比例及A375细胞凋亡的影响(±s)
注:n=3。 a:用二甲基亚砜处理A375细胞
组别 p53 G2期(%) 凋亡(%)对照组a 24 h 1 979.000±111.517 9.310±7.550 2.267±0.153 48 h 3 058.333±52.786 15.667±0.586 4.967±0.153 72 h 4 321.333±72.748 20.167±0.874 8.833±0.208 2.5 μmol/L nutlin-3 24 h 5 685.333±193.480 11.800±0.624 5.000±3.000 48 h 8 053.000±131.936 22.133±0.503 8.233±0.153 72 h 4 729.667±42.147 26.333±0.737 14.567±0.551 5 μmol/L nutlin-3 24 h 8 178.667±441.151 15.367±1.137 7.867±0.252 48 h 13 285.000±132.510 27.633±3.444 12.367±0.306 72 h 11 656.670±188.235 36.567±0.611 19.300±0.529 10 μmol/L nutlin-3 24 h 19 381.000±307.161 22.767±0.569 10.067±0.208 48 h 19 470.330±179.350 38.400±0.700 18.267±0.289 72 h 27 183.000±133.974 40.767±0.513 29.567±2.203
四、Nutlin-3对A375细胞凋亡的影响
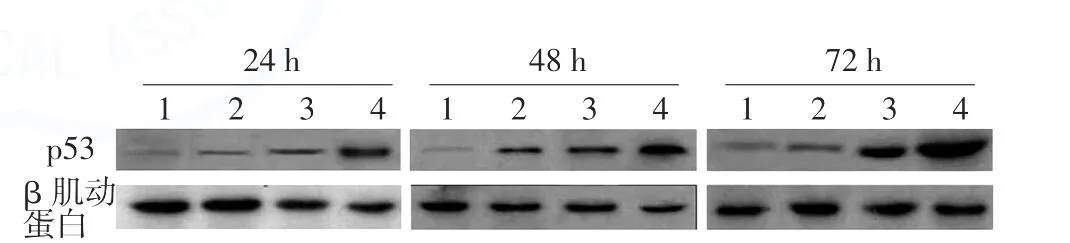
图2 Nutlin-3对人A375黑素瘤细胞p53蛋白表达的影响1:DMSO;2:2.5 μmol/L;3:5 μmol/L;4:10 μmol/L
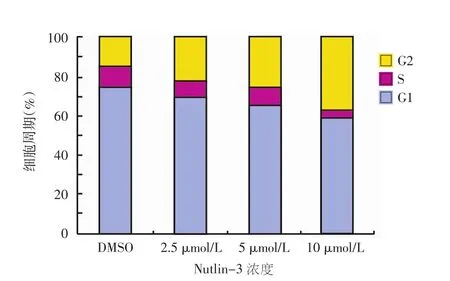
图3 Nutlin-3作用48 h,人A375黑素瘤细胞G2期的分布
Nutlin-3作用于 A375细胞 24、48、72 h后,与对照组比较,不同浓度 nutlin-3(2.5、5、10 μmol/L)增加A375细胞的凋亡比率。如表1所示,不同时间点A375细胞凋亡率差异有统计学意义(F=809.45,P<0.01),时间越长A375细胞凋亡率越高;不同浓度间的A375细胞凋亡率差异有统计学意义(F=723.83,P<0.01),浓度越高A375细胞凋亡率越高。时间与浓度之间交互作用有统计学意义(F=44.48,P<0.01)。图4为nutlin-3作用72 h后人A375黑素瘤细胞凋亡比率。
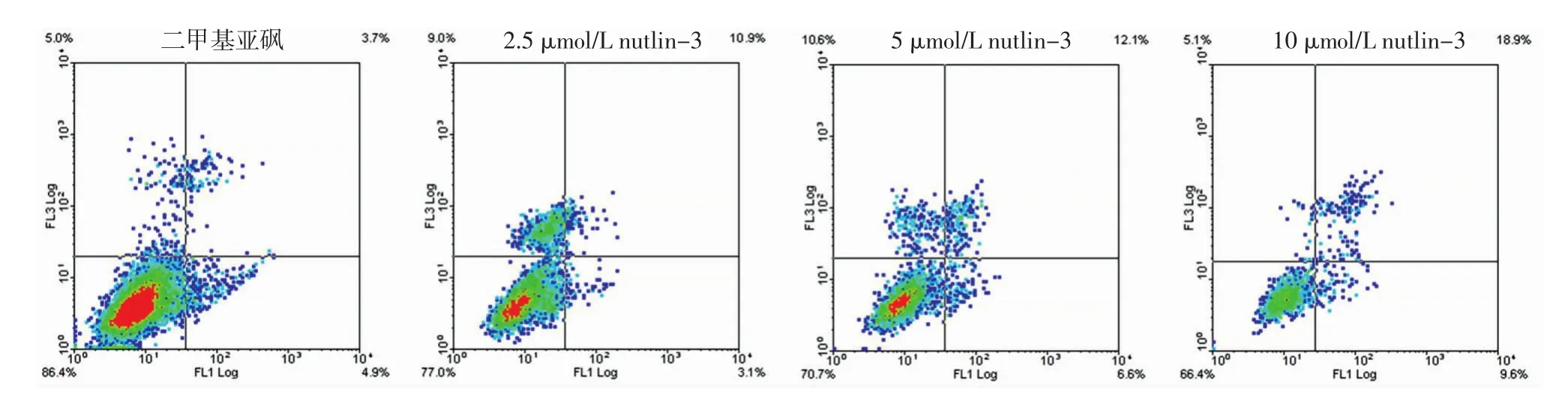
图4 Nutlin-3作用72 h,人A375黑素瘤细胞凋亡比率
五、Nutlin-3对A375细胞迁移的影响
如图 5 所示,2.5、5、10 μmol/L nutlin-3 作用 24 h后,迁移抑制率(n=3)分别为(10.501±2.902)%、(11.422±7.893)%、(22.557±1.497)%;48 h的抑制率分别为(20.940±2.613)%、(36.177±5.062)%、(42.704±1.453)%;72 h的抑制率分别为(36.457± 2.600)%、(38.886± 6.116)%、(48.434±0.655)%。不同时间点之间A375迁移抑制率差异有统计学意义(F=1 100.00,P<0.01),时间越长迁移抑制率越高;不同浓度间迁移抑制率差异有统计学意义(F=1 667.00,P<0.01),浓度越高迁移抑制率越高。时间与浓度之间交互作用有统计学意义(F=313.09,P<0.01)。Nutlin-3能够显著地抑制A375细胞的迁移。
讨 论
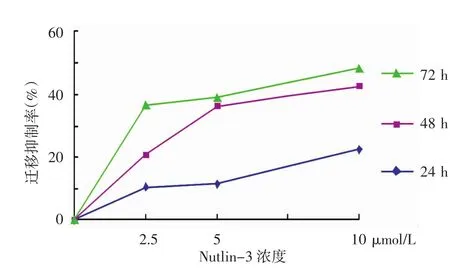
图5 Nutlin-3对A375细胞迁移的抑制率
抑癌基因p53在黑素瘤的发生中起到了重要的作用,在黑素瘤早期p53极少发生突变,随着其进展,该基因突变率越来越高[3]。在黑素瘤中p53表达处于低水平,这是因为双微体基因编码的产物与p53蛋白结合,MDM2是p53基因诱导产生的,并形成了自动负调节循环,将p53转运出细胞核,并通过泛素化促进p53的降解[4]。对p53和MDM2复合物的晶体结构的研究揭示,小分子抑制剂可以与MDM2竞争性结合p53位点,以此达到升高p53的目的。
Nutlin-3是众多MDM2抑制剂中的一类,能特异性与p53分子中3个疏水性氨基酸Leu26、Trp23、Phe19结合,而该位点就是与 MDM2的Try100相互作用的直接接触点,具有高效的亲和性、专一性以及细胞可渗透性。Nutlin-3与p53结合后,抑制MDM2与p53的结合,使p53积聚,从而引起一系列p53介导的抗肿瘤作用:细胞周期停滞和细胞凋亡。近来,Vassilev等[2]发现,在野生型p53的HCT116结肠癌细胞、RKO结肠癌细胞和SJSA-1骨肉瘤细胞中,nutlin-3在体内外均能抑制MDM2-p53结合,促进p53通路重建,从而激活p21,使肿瘤的细胞周期停滞,激活bax基因促进肿瘤细胞凋亡并抑制肿瘤生长。在其他一些表达野生型p53的肿瘤细胞(如视网膜母细胞瘤[5]、神经纤维瘤[6]、横纹肌细胞癌[7]等)中nutlin-3也表现出同样的作用。Nutlin-3可以诱导瘤细胞和正常细胞的细胞周期停滞,但却只引起肿瘤细胞的凋亡[8-9]。在与其他化疗药物联合作用于肺癌细胞时,nutlin-3可以通过激活p53引起细胞周期停滞,从而减轻紫杉醇对正常细胞的毒性作用[10]。有研究[11]发现,nutlin-3可以减少表达野生型p53人HT1080鼻咽癌细胞、人U2OS骨肉瘤细胞、人SAOS成骨肉瘤细胞和人A549肺癌细胞的肌动蛋白纤维和黏着斑的大小和数量,引起细胞骨架重构,抑制细胞的迁徙和侵袭能力。
本实验首先采用MTT法检测不同浓度nutlin-3作用不同时间对A375细胞增殖抑制率,发现nutlin-3对A375细胞的增殖抑制作用具有浓度依赖性和时间依赖性。进一步用PI染色流式细胞仪检测nutlin-3对细胞周期分布的影响,结果显示,nutlin-3通过p53的积累,使A375细胞G2期比例增多,引起细胞周期停滞。正常情况下对于不能修复的DNA损伤,p53将启动激活一系列下游转录信号,促进细胞凋亡。因此,我们进一步检测nutlin-3对A375细胞凋亡的影响,结果显示,nutlin-3促进A375细胞凋亡。构建Transwell小室是为了进一步验证nutlin-3对A375细胞侵袭性的影响,结果显示,nutlin-3能抑制A375细胞的侵袭迁移。
基于上述实验研究,我们发现,nutlin-3通过积累p53蛋白,引起A375细胞周期G2期停滞,促进细胞凋亡,从而抑制A375细胞的增殖,并抑制A375细胞的侵袭迁移能力。在A375细胞荷瘤鼠动物模型中nutlin-3是否具有相同的抗肿瘤效应?Nutlin-3诱导的细胞凋亡途径具体是哪条?Nutlin-3治疗肿瘤会不会导致p53的突变或其他p53通路的缺损?除了p53通路,nutlin-3是否还有别的通路?Nutlin-3能否单一或联合使用来治疗p53变异的肿瘤?这些问题都有待于进一步研究。
[1]Brooks CL,Gu W.p53 ubiquitination:Mdm2 and beyond[J].Mol Cell,2006,21(3):307-315.
[2]Vassilev LT,Vu BT,Graves B,et al.In vivoactivation of the p53 pathway by small-molecule antagonists of MDM2[J].Science,2004,303(5659):844-848.
[3]Merlino G,Noonan FP.Modeling gene-environment interactions in malignant melanoma[J].Trends Mol Med,2003,9(3):102-108.
[4]程芳,何润之,张磊,等.UBA3在黑素瘤细胞的表达及其影响黑素瘤细胞生物学行为的研究[J].中华皮肤科杂志,2014,47(2):94-98.
[5]Elison JR,Cobrinik D,Claros N,et al.Small molecule inhibition of HDM2 leads to p53-mediated cell death in retinoblastoma cells[J].Arch Ophthalmol,2006,124(9):1269-1275.
[6]Ribas J,Boix J,Meijer L.(R)-roscovitine(CYC202,Seliciclib)sensitizes SH-SY5Y neuroblastoma cells to nutlin-3-induced apoptosis[J].Exp Cell Res,2006,312(12):2394-2400.
[7]Miyachi M,Kakazu N,Yagyu S,et al.Restoration of p53 pathway by nutlin-3 induces cell cycle arrest and apoptosis in human rhabdomyosarcoma cells[J].Clin Cancer Res,2009,15(12):4077-4084.
[8]McCormack E,Haaland I,Venås G,et al.Synergistic induction of p53 mediated apoptosis by valproic acid and nutlin-3 in acute myeloid leukemia[J].Leukemia,2012,26(5):910-917.
[9]Zheng T,Wang J,Song X,et al.Nutlin-3 cooperates with doxorubicin to induce apoptosis ofhuman hepatocellular carcinoma cells through p53 or p73 signaling pathways[J].J Cancer Res Clin Oncol,2010,136(10):1597-1604.
[10]Tokalov SV,Abramyuk AM,Abolmaali ND.Protection of p53 wild type cells from taxol by genistein in the combined treatment of lung cancer[J].Nutr Cancer,2010,62(6):795-801.
[11]Moran DM,Maki CG.Nutlin-3a induces cytoskeletal rearrangement and inhibits the migration and invasion capacity of p53 wild-type cancer cells[J].Mol Cancer Ther,2010,9(4):895-905.
2014-04-19)
(本文编辑:尚淑贤)
Effect of nutlin-3 on the biological behavior of A375 human melanoma cells and its mechanism
Ding Xiaojie,Wei Dapeng,Chen Juping*.*Department of Dermatology,Second Clinical Medical College of Yangzhou University,Yangzhou 225001,China
Chen Juping,Email:chenjuping@medmail.com.cn
ObjectiveTo estimate the effect of a cis-imidazoline derivative,nutlin-3,on the biological behavior of A375 human melanoma cells,and to investigate its mechanism.MethodsCultured A375 cells were divided into several test groups treated with nutlin-3 at different concentrations(2.5,5,10 μmol/L)for 24,48 and 72 hours,and a control group treated with dimethyl sulfoxide(DMSO)only.Then,methyl thiazolyl tetrazolium(MTT)assay was performed to evaluate cellular proliferative activity,Western blot to measure the expression of p53 protein,flow cytometry to estimate cell cycle phase distribution and apoptosis rate,and Transwell assay to evaluate migratory activity,of A375 cells.Statistical analysis was carried out by repeated-measures analysis of variance(ANOVA).ResultsAfter treatment with nutlin-3 of 2.5,5 and 10 μmol/L for 24,48 and 72 hours,significant differences were observed among different time points at each concentration and among different concentrations at the same time point in proliferation inhibition rate(F=67.43,135.58,respectively,bothP< 0.01) ,p53 protein expression level(F=1255.00,9196.00,respectively,bothP< 0.01),percentage of cells at G2 phase(F=831.38,267.99,respectively,bothP< 0.01),apoptosis rate(F=809.45,723.83,respectively,bothP< 0.01),migration inhibition rate(F=1100.00,1667.00,respectively,bothP< 0.01).The influence of nutlin-3 on cellular proliferative activity increased with the increase in its concentration,and that on percentage of cells at G2 phase,apoptosis rate and migratory activity increased with the increase in its concentration and treatment duration.There was a significant interaction between the treatment duration and concentration of nutlin-3 for p53 protein expression level in(F=826.79,P< 0.01),percentage of cells at G2 phase in(F=21.602,P< 0.01),apoptosis rate in(F=44.48,P< 0.01),migratory activity of(F=313.09,P< 0.01),and cellular proliferative activity of(F=26.95,P<0.01),A375 cells.ConclusionNutlin-3 may inhibit the proliferation and migration of,but promote cell cycle arrest and apoptosis in,A375 cells,through accumulation of p53 protein.
Nutlin-3;Melanoma,experimental;Cell cycle;Apoptosis;Cell movement
10.3760/cma.j.issn.0412-4030.2014.12.011
225001扬州大学第二临床医学院皮肤科[丁小杰(现在南京中医药大学附属第二医院、江苏省第二中医院皮肤科,210017)、陈菊萍];四川大学基础与法医学院免疫教研室(魏大鹏)
陈菊萍,Email:chenjuping@medmail.com.cn

