基于IL-3及G-CSF的玉屏风散调控变应性鼻炎肥大细胞活性的实验研究
张仲林,钟玲,凌保东,袁明勇*
(1.成都医学院,成都 610083;2.四川省高校结构特异性小分子药物重点实验室,成都 610083)
白细胞介素-3(interleukin-3,IL-3)又称多重集落刺激因子(multi-CSF),主要是由活化的T细胞所产生。IL-3生物学活性广泛,具有刺激肥大细胞和浆细胞生长等作用[1]。粒细胞集落刺激因子(granulocyte colony stimulating factor,G-CSF)主要由内毒素、TNF-α和IFN-γ可活化单核细胞和巨噬细胞产生,具有促进巨噬细胞及噬酸性细胞的多种功能,能抑制肥大细胞的增值[2]。本研究锁定IL-3和G-CSF在肥大细胞方面的相反作用,以变应性鼻炎(allergic rhinitis,AR)为研究对象,从实验角度探讨中医经方玉屏风散对AR的双向调节作用及其机制,为中医临床提供实验依据,现报道如下。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 清洁级SD大鼠60只,雌雄各半,体质量(200±10)g,由四川医学科学院动物中心提供(合格证号:SCXK川2008-24),于自然光线、自由饮水摄食条件下,在成都医学院药理动物实验室适应性喂养1w后备用。
1.1.2 实验药物 富马酸酮替芬(国药准字:H20103410,由浙江南洋药业生产;规格:1mg/片);玉屏风散药液由成都医学院中药药剂学国家中医药科研二级实验室制备,生药含量2g/mL。
1.1.3 实验试剂 卵清白蛋白(美国Sigma公司),氢氧化铝干粉 (西安化学试剂厂)。RPMI1640培养基、胎牛血清(均由美国Gibco公司提供),鼠抗β-actin多克隆抗体(美国 Abcam 公司),IL-3、GMSCF试剂盒(美国R&D Systems公司产品)购自武汉博士德生物工程有限公司,羊抗兔IL-3、GM-SCF二抗均由深圳市科润达生物工程有限公司提供。
1.1.4 主要仪器 RM2016切片机(德国Leica有限公司);2PJ-1展片机(天津天利航空机有限公司);101-2A型电热鼓风干燥箱(天津市泰斯特仪器有限公司);BioTek Synergy4酶标仪(香港Gene Company有限公司);PowerPac Basic电泳仪(美国Bio-Rad公司)。
1.2 实验方法
1.2.1 药物配制 用蒸馏水将酮替芬配制成0.46 g/mL的浓度备用,玉屏风散分别配制成1.2g/mL、0.6g/mL及0.3g/mL高、中、低3个剂量组的浓度备用。
1.2.2 造模及给药方法 将卵白蛋白0.3mg辅以氢氧化铝30mg作佐剂,加生理盐水l mL形成混悬致敏液,备用。健康SD大鼠随机分为空白组、模型组、16%酮替芬组、120%、60%及30%的玉屏风散剂量组共6组,每组10只。除空白组外,其余大鼠均腹腔注射,1次/d,连续3d,为基础致敏。后再用0.5%卵白蛋白的生理盐水攻击双鼻腔,每侧5 μL,每日1次,共6次,第7次攻击后观察30min,参照文献[3]拟定评分标准记录并评分,包括喷嚏、搔抓、流涕等过敏症状。从造模第1天开始,除空白组外,各组分别给予生理盐水、16%酮替芬10mL/kg、120%、60%和30%的玉屏风散灌喂大鼠,给药时间为7d至实验结束。
1.2.3 观察方法 1)过敏症状的观察:参照文献拟定的评分标准记录并评分,包括喷嚏、搔抓、流涕等过敏症状;并计算各组总评分值。2)鼻腔灌洗液IL-3及G-SCF含量测定:大鼠于第10次激发后5h以100mg/kg氯胺酮和2mg/kg甲苯噻嗪腹腔注射麻醉。大鼠固定于仰卧头低位,持续低负压抽吸收集鼻腔灌洗液,离心,用RPMI1640培养,percoll梯度分离,制备细胞悬液,用PBS液洗吹,镜下计数,调细胞浓度,按照说明书采用ELISA双抗夹心法检测IL-3及 G-SCF含量。3)鼻黏膜IL-3及 GSCF的表达检测:末次给药后45min,脱颈椎处死大鼠,剖取鼻黏膜,匀浆,3 000r/min离心10min,取上清液-20℃冻存,取出标本并按照说明书采用Westernblot法检测IL-3及 G-SCF含量。4)吉姆萨染色法:切片经脱蜡至蒸馏水,切片在微波炉内解冻8min,蒸馏水迅速浸洗1min;1%冰醋酸水溶液浸洗2min,蒸馏水迅速浸洗;59%乙醇脱水5min,纯乙醇脱水4min;二甲苯透明2次,各5min。中性树胶封片,光镜下观察。
1.3 统计学方法
用SPSS 13.0统计学软件进行数据分析,计量资料采用方差分析,结果以均数±标准差(±s)表示,P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
2 结果
2.1 大鼠过敏症状观察情况
模型组大鼠中出现AR发作症状,不同程度地表现为喷嚏、流涕、搔抓鼻部等表现。玉屏风散治疗后大鼠表现症状的程度较同期模型组明显减弱,约5~10min后症状开始缓解,与模型组比较差异有统计学意义(P<0.05,P<0.01)(见表1)。
表1 末次给药45min后激发大鼠鼻部症状积分情况(±s)
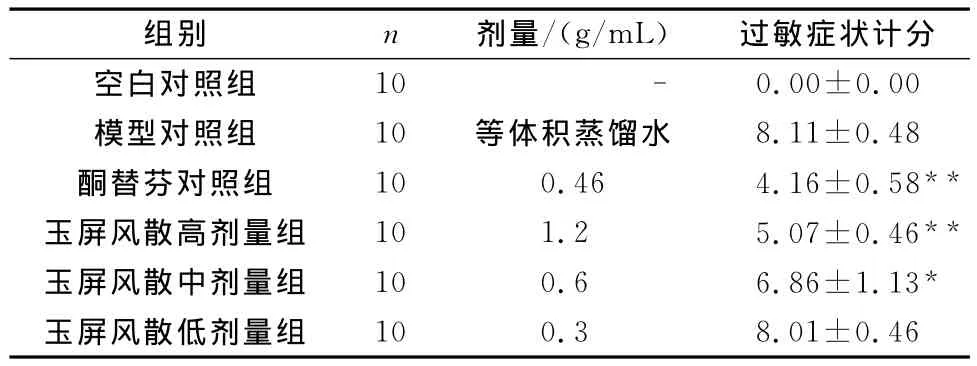
表1 末次给药45min后激发大鼠鼻部症状积分情况(±s)
与模型组比较,*P<0.05,**P<0.01
组别 n 剂量/(g/mL) 过敏症状计分空白对照组10 - 0.00±0.00模型对照组 10 等体积蒸馏水 8.11±0.48酮替芬对照组 10 0.46 4.16±0.58**玉屏风散高剂量组 10 1.2 5.07±0.46**玉屏风散中剂量组 10 0.6 6.86±1.13*玉屏风散低剂量组10 0.3 8.01±0.46
2.2 大鼠鼻腔灌洗液IL-3及G-SCF含量比较
与空白对照组比较,模型组大鼠NLF中IL-3和GM-SCF含量均降低,差异有统计学意义(P<0.01);用玉屏风散治疗后,IL-3和 GM-SCF含量均明显升高,与模型组比较差异有统计学意义(P<0.05,P<0.01)(见表2)。
表2 ELSIA法检测大鼠鼻腔灌洗液IL-3及GM-CSF含量(±s)
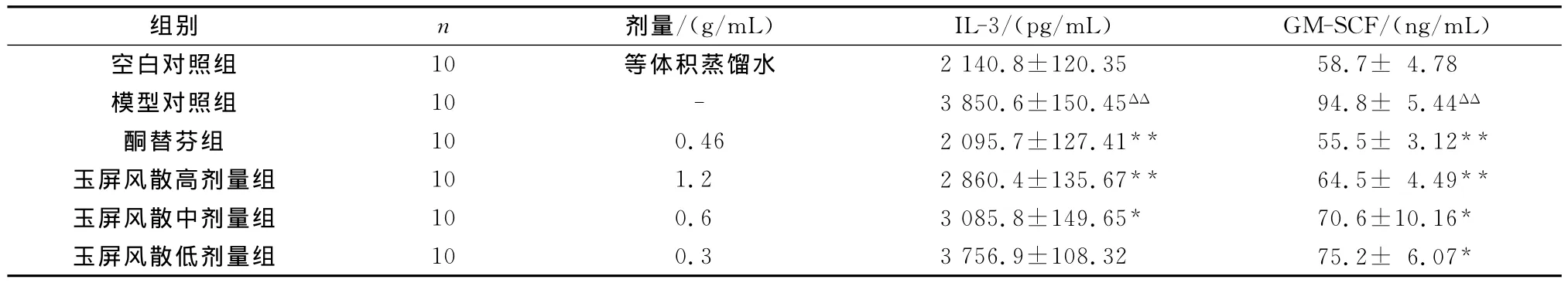
表2 ELSIA法检测大鼠鼻腔灌洗液IL-3及GM-CSF含量(±s)
与模型组比较,*P<0.05,**P<0.01
组别 n 剂量/(g/mL) IL-3/(pg/mL) GM-SCF/(ng/mL)空白对照组 10 等体积蒸馏水2 140.8±120.35 58.7± 4.78模型对照组 10 - 3 850.6±150.45ΔΔ94.8± 5.44ΔΔ酮替芬组 10 0.46 2 095.7±127.41**55.5± 3.12**玉屏风散高剂量组 10 1.2 2 860.4±135.67**64.5± 4.49**玉屏风散中剂量组 10 0.6 3 085.8±149.65*70.6±10.16*玉屏风散低剂量组 10 0.3 3 756.9±108.32 75.2± 6.07*
2.3 大鼠鼻黏膜IL-3及G-SCF的表达情况比较
大鼠鼻黏膜蛋白印迹表达显示:与空白对照组比较,模型组IL-3及GM-SCF表达水平明显降低,且差异有显著统计学意义(P<0.01);经玉屏风散治疗处理后,二者表达量水平明显升高,且差异有统计学意义(P<0.05,P<0.01)(见图1、图2)。

图1 玉屏风散对AR大鼠鼻腔灌洗液IL-3及GCSF表达的影响
2.4 大鼠鼻黏膜吉姆萨染色结果
镜下可见模型组胞浆呈紫蓝色,肥大细胞数量最多,背景淡蓝色,凋亡细胞为深蓝色;而空白组胞浆呈紫蓝色,肥大细胞数量比模型组少;经玉屏风散高剂量组和酮替芬治疗后肥大细胞数目显著减少(见图3:A~D)。
3 讨论

图2 玉屏风散对AR大鼠鼻腔灌洗液IL-3及G-CSF表达的灰度值比较
AR是由IgE介导的Ⅰ型变态反应性疾病,特应性个体在接触致敏原后由IgE介导的介质(主要是组胺)释放,并有多种免疫活性细胞和细胞因子等参与的鼻黏膜慢性炎症反应性疾病。IL-3可促进巨噬细胞分化、增殖以及la抗原表达,从而增强巨噬细胞递呈抗原的能力,可与IL-6、EPO、GM-SCF等多种细胞因子协同作用[4]。忻耀杰等[5]研究证实,在AR中血清IL-3在嗜酸性粒细胞(EOS)的募集及功能活化,促进AR的形成和发展发病机制中起重要作用。李涛等[6]研究表明,AR大鼠鼻黏膜中IL-3mRNA表达水平明显升高,药物干预后显著下降。GM-CSF是对树突状细胞(dendritic cells,DC)调节作用最强的细胞因子,它不仅能促进DC因子分化与增殖、维持其固有的细胞活力,而且对DC因子在体内的分布和对各种抗原提呈功能都有重要作用[7]。成熟 DC能影响辅助 性 T 细胞(Helper T cells,Th),诱导Thl反应,调节Thl/Th2的比例,使Th0向Thl偏移分化,是治疗AR反应的一种途径。体内GM-SCF水平升高能间接地影响Th亚群Th1与Th2的平衡状态,从而有利于AR过敏症状的改善和治疗[8,9]。GM-CSF能够上调肥大细胞PARs表达,而PARs又可引起信号级联反应,从而影响MCs的形态、分泌、活化,从而最终引起MCs的脱颗粒及释放其内预先合成的组胺等炎性介质,导致AR的鼻痒、喷嚏和流涕等一系列过敏症状[10]。
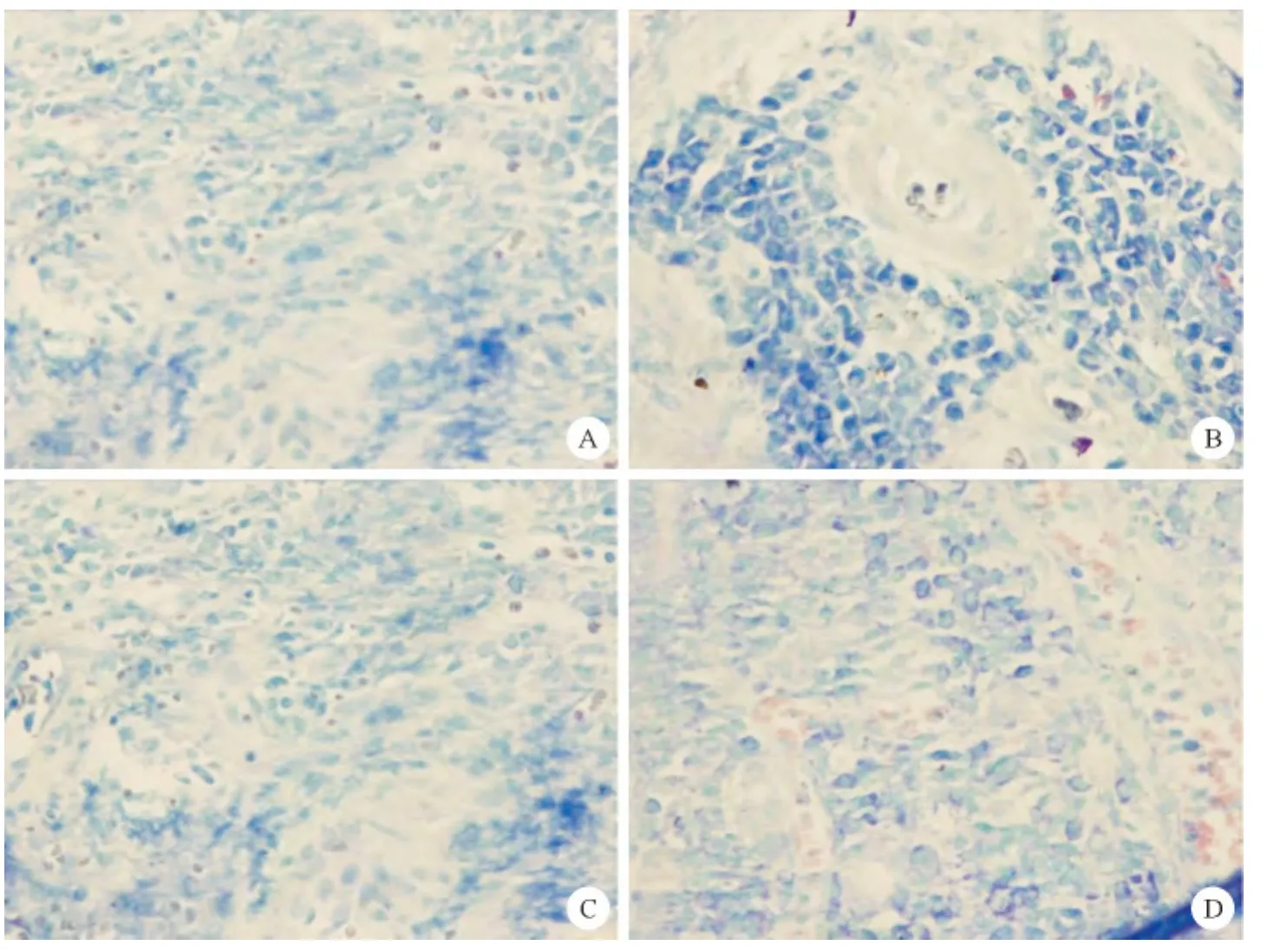
图3 各组鼻黏膜吉姆萨染色结果
本研究证实,造模后模型组大鼠过敏症状计分显著升高,用玉屏风散治疗后其喷嚏、流涕、搔抓等鼻部过敏症状计分明显降低,且与模型组比较差异有显著统计学意义(P<0.05,P<0.01)。ELSIA法检测显示:造模后模型组大鼠鼻腔灌洗液IL-3及G-SCF含量显著降低,用玉屏风散治疗后其含量均明显升高,且与模型组比较差异有统计学意义(P<0.05,P<0.01)。Western blot法检测显示:造模后模型组大鼠鼻黏膜IL-3及G-SCF蛋白表达量显著降低,用玉屏风散治疗后其含量均明显升高,且与模型组比较差异有统计学意义(P<0.05,P<0.01)。吉姆萨染色显示:与空白组比较,造模后模型组大鼠鼻黏膜中蓝色的肥大细胞数量明显增多,用玉屏风散治疗后其数量显著减少。可见,玉屏风散能有效提高肥大细胞的生长因子IL-3表达而抑制肥大细胞的增值因子G-CSF表达。
综上所述,玉屏风散能通过激活肥大细胞生长因子IL-3、抑制促进肥大细胞增值因子 G-CSF,对肥大细胞进行双向调节,从而稳定肥大细胞活性,抑制其脱颗粒减少炎性介质的释放,从而改善AR的过敏症状,达到治疗AR的目的。玉屏风散双向调节肥大细胞活性的详细分子机制还有待今后进一步深入研究和阐释。
[1]赵秀荣,王庆林,徐大为,等.IL-3应用研究进展[J].承德医学院学报,2004,21(4):332-334.
[2]Fireman P.Cytokines and allergic rhinitis[C].Allergy and Asthma Proceedings:the Official Journal of Regional and State Allergy Societies,1995,17(4):175-178.
[3]赵秀杰,董震,杨占泉,等.超敏反应实验模型的建立[J].中华耳鼻咽喉科杂志,1993,28(1):17-18.
[4]林志斌,李添应,陈冬.白介素细胞因子在变应性鼻炎的作用机理[J].当代医学,2010,16(24):15-16.
[5]忻耀杰,滕磊,张裙裙,等.血清IL-3、IL-5、EOT 在不同体质的变应性鼻炎大鼠模型中的表达及意义[C].第四届中国中西医结合学会变态反应学术大会论文汇编,2009:337-342.
[6]李涛,谢慧,付文洋,等.五龙颗粒对变应性鼻炎模型大鼠鼻黏膜IL-3mRNA 表达的影响研究[J].中国药房,2009,20(15):1127-1129.
[7]薛庆杰,吕厚东,梁卫平,等.GM-SCF与LMP2A融合基因GC2A重组腺病毒载体的构建与鉴定[J].中华肿瘤防治杂志,2013,20(11):830-834.
[8]刘立思,谢俊,刘杰.树突状细胞在变应性鼻炎免疫调控中作用的研究[C].中华医学会第二次全国变态反应学术会议论文汇编,2004:48.
[9]Daro E,Butz E,Smith J,et al.Comparison of the functional properties of murine dendritic cells generated in vivo with Flt3 ligand,GM-CSF and Flt3ligand plus GM-CSF[J].Cytokine,2002,17(3):119-30.
[10]张连霞,何韶衡.GM-CSF对肥大细胞P815蛋白酶激活受体表达的影响[J].临床和实验医学杂志,2008,7(4):31-34.

