低分子量姬松茸多糖抑制Lovo细胞与内皮细胞黏附的作用及机制
张 春 董海影 (宁夏医科大学颅脑疾病重点实验室,宁夏 银川 750004)
在肿瘤的血行转移中,肿瘤细胞与血管内皮黏附是转移的重要环节之一〔1〕,针对这一靶点开展的抗黏附治疗是抗肿瘤转移的研究热点之一〔2,3〕。研究发现,许多具有高度转移能力的肿瘤细胞表面可以过度表达一种唾液酸化LewisX(sLeX)。sLeX与内皮细胞表达的E-选择素结合,促进肿瘤细胞与血管内皮的黏附。姬松茸多糖(PAB)是从姬松茸菌丝体及子实体中提取出来的一种有效成分。本实验以sLeX-E选择素介导的黏附为切入点,观察低分子量姬茸多糖(LMPAB)抗肿瘤转移作用及机制。
1 材料与方法
1.1 药物及试剂 LMPAB由齐齐哈尔医学院医药研究所制备,褐色粉末,易溶于水,平均分子量为480 000。结构分析显示其主体结构为β-(1→3)-D葡聚糖〔4〕。人结肠癌细胞Lovo、人脐静脉内皮细胞(HUVECs)均购自美国ATCC细胞库;Recombinant Human TNF-α 购自 R&D Systems,Inc;鼠抗 IgG+IgM(ab47830)datasheet购自Abcam公司;KM93购自Calbiochem公司;F12K培养基购自Sigma公司,RPMI 1640培养基购自Gibco公司,Rose Bengal购自Sigma公司,胎牛血清(FBS)购自Clark公司,EDTA购自Amresco公司,胰蛋白酶购自Gibco公司,RNA抽提试剂RNAiso和SYBR Ex-ScriptTM RT-PCR试剂盒购自TaKaRa公司;引物由TaKaRa公司设计和合成,其序列如下:GAPDH正义链:5'-GGCACAGTCAAGGCTGAGAATG-3'反义链:5'-ATGGTGGTGAAGACGCCAGTA-3'(143 bp);FUTⅦ:正义链:5'-TCACTGGCATGAATGAGAGC-3';反义链:5'-TGAAACCAACCCTCAAGGTC-3'。
1.2 细胞培养 Lovo细胞用含10%新生牛血清的F12K培养液37℃、5%CO2的常规培养。HUVECs用含10%FBS的RPMI-1640培养液37℃、5%CO2的常规培养。
1.3 黏附能力的测定〔5〕将96孔培养板培养的内皮细胞去除培养液后,每孔加浓度为2.5×105个/ml的 Lovo细200 μl,37℃孵育20 min;去除未黏附的肿瘤细胞,每孔加0.25%Rose Bengal 100 μl,室温放置 5 min;去除染料 Rose Bengal,每孔加95% 乙醇;PBS(1∶1)200 μl,室温放置 30 min;最后测定570 nm光密度值。
1.4 流式细胞术检测Lovo细胞表面sLeX的表达 对数生长期的Lovo细胞以1×106cell/ml接种于60 mm培养皿中培养,待细胞融合至80%时,加入含不同浓度LMPAB的培养基,孵育48 h后,荧光标记,流式细胞仪检测。以阳性表达百分率表示Lovo细胞表面sLeX含量。
1.5 Real-time RT-PCR检测Lovo细胞FUTⅦmRNA表达
1.5.1 提取总RNA 采用RNAiso Reagent提取总RNA,操作按说明书进行,紫外分光光度法及琼脂糖凝胶电泳检测总RNA的含量、纯度和完整性。
1.5.2 逆转录反应 在2700型PCR System扩增仪上进行逆转录反应,SYBRⓇExScriptTMRT-PCR Kit说明书进行cDNA合成,反应参数为:反转录反应42℃ 15 min,反转录酶失活反应95℃ 2 min。
1.5.3 real-time RT-PCR反应 PCR反应采用SYBR Premix ExTaq试剂盒,在ABI7300荧光定量PCR仪上进行PCR反应。反应条件如下:第一步是预变性,95℃预变性10 s,共1个循环。第二步是PCR反应,95℃变性5 s,60℃退火31 s,共40个循环。整个过程中收集荧光,反应结束后,使用Sequence Detection software version 11213软件(Applied Biosystems公司)收集Ct(Threshold cycle)值,由熔解曲线判断PCR反应的特异性,采用2-△△Ct分析 FUTⅦ mRNA表达量。GAPDH和 FUTⅦ的扩增,每样本作2复孔,得到两组平均 Ct值。通过2-△△Ct计算FUTⅦ相对mRNA表达。
1.6 统计学方法 应用SPSS13.0进行统计学处理。数据以s表示。多组间差异的显著性分析用单因素方差分析,进一步组间比较用LSD检验。
2 结果
2.1 LMPAB对Lovo细胞与HUVECs黏附的影响 不同浓度的LMPAB孵育Lovo细胞48 h后,在5~20 μg/ml剂量范围内,LMPAB处理组黏附于HUVECs的Lovo数目与对照组相比减少(P <0.05)。见表1。
2.2 LMPAB对Lovo细胞表面sLeX表达的影响 流式细胞术检测结果显示不同浓度的LMPAB对Lovo细胞表面sLeX表达具有抑制作用。空白对照组的sLeX阳性表达率为(67.98±3.81)%。LMPAB 低剂量组(55.93 ±6.42)%,LMPAB 中剂量组(39.02 ±4.28)%,LMPAB 高剂量组(24.76 ±2.98)%。
2.3 LMPAB对Lovo细胞表达FUTⅦmRNA的影响 见表2。与对照组比较,LMPAB对Lovo细胞表达FUTⅦ mRNA具有抑制作用(P<0.05)。
表1 不同剂量LMPAB抑制Lovo细胞黏附HUVECs的作用( s,n=5)
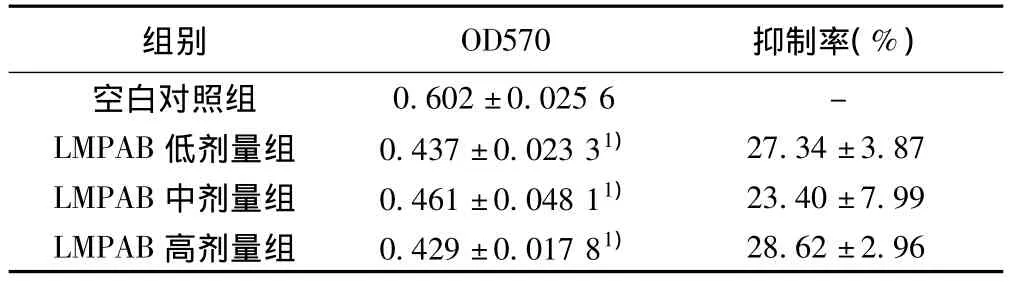
表1 不同剂量LMPAB抑制Lovo细胞黏附HUVECs的作用( s,n=5)
与空白对照组比较:1)P<0.05
组别 OD570 抑制率(%)空白对照组28.62 ±2.96 0.602 ±0.025 6 -LMPAB 低剂量组 0.437 ±0.023 31) 27.34 ±3.87 LMPAB 中剂量组 0.461 ±0.048 11) 23.40 ±7.99 LMPAB 高剂量组 0.429±0.017 81)
表2 LMPAB对Lovo细胞FUTⅦmRNA表达的影响( s,n=5)

表2 LMPAB对Lovo细胞FUTⅦmRNA表达的影响( s,n=5)
与空白对照组比较:1)P<0.05
组别CT(FUTVⅡ)CT(GAPDH)ΔΔCT 2-ΔΔCT 22.55 ±0.16 15.52 ±0.22 0 ±0.32 1.02 ±0.25 LMPAB 低剂量组 23.41 ±0.14 15.41 ±0.13 0.97 ±0.16 0.51 ±0.061)LMPAB 中剂量组 23.51 ±0.15 15.43 ±0.17 1.05 ±0.17 0.48 ±0.061)LMPAB 高剂量组 23.79 ±0.37 15.31 ±0.21 1.45 ±0.33 0.37 ±0.101)空白对照组
3 讨论
肿瘤细胞侵袭和转移是一个极其复杂的多步骤的连续动态过程,其中肿瘤细胞与血管内皮细胞的相互作用是关键环节。肿瘤细胞脱离原发部位进入血液循环,与特定脏器血管内皮细胞的锚定黏附被认为是器官特异性转移关键性的第一步〔6〕。从肿瘤血行转移过程中肿瘤细胞与血管内皮细胞黏附的环节为切入点,针对瘤细胞黏附和迁移穿过内皮细胞这一靶点开展的抗黏附治疗是抗肿瘤转移研究热点之一〔3,7〕。本实验结果显示LMPAB抑制肿瘤细胞与内皮细胞黏附,进而影响肿瘤转移。
sLeX抗原属于肿瘤相关糖类物质,表达在肿瘤组织细胞表面糖酯及糖蛋白上的含有寡聚糖的一组碳水化合物抗原。肿瘤细胞与血管内皮细胞的黏附能力与E-selectin的配体sLeX表达水平有关,sLeX在肿瘤转移过程中发挥重要作用。以往的研究发现sLeX在结肠癌〔8〕、乳腺癌〔9〕等肿瘤高强度表达,并通过与其受体特异性结合在肿瘤转移中起重要作用相一致。本研究发现LMPAB通过下调Lovo细胞表面的sLeX的表达,使Lovo与HUVECs的黏附作用减弱,提示LMPAB可能具有抗肿瘤转移的作用。
研究显示FucT-Ⅶ及其产物sLeX通过对细胞黏附、迁移和侵袭的影响而对肝癌细胞H7721的转移能力起至关重要的作用〔10〕。李文桦等〔11〕发现转染了 α1,3 FucT-Ⅶ后的人结直肠癌Lovo细胞的趋化性迁移能力和侵袭能力有了明显的增强,转染α1,3 FucT-Ⅶ后sLeX表达水平及糖蛋白CD24糖基化水平的明显上升。α1,3 FucT-Ⅶ及其糖基化产物在促进肿瘤转移中的起着重要的作用。α1,3 FucT-Ⅶ基因能改变人结肠癌Lovo细胞的生物学行为,增强细胞趋化性迁移和侵袭等转移表型。FucT-Ⅶ通过自身表达的上调或下调影响肿瘤细胞侵袭、转移能力,表明LMPAB具有下调FUTⅦmRNA的表达的作用,从而抑制肿瘤细胞与内皮细胞的黏附,发挥抗肿瘤转移的作用。
总之,LMPAB在体外抑制肿瘤细胞与内皮细胞的黏附作用可能与降低了Lovo细胞表面的sLeX的表达有关,sLeX表达下调可能通过下调FUTⅦmRNA表达而实现。
1 Gassmann P,Enns A,Haier J.Role of tumor cell adhesion and migration in organ-specific metastasis formation〔J〕.Oncologie,2004;27(6):577-82.
2 Joyce JA.Therapeutic targeting of the tumor microenvironment〔J〕.Cancer Cell,2005;7(6):513-20.
3 Steinman L.Blocking adhesion molecules as therapy for multiple sclerosis:natalizumab〔J〕.Nat Rev Drug Discov,2005;4(6):510-8.
4 刘吉成,孙建宁.低分子量姬松茸多糖提取分离及抗肿瘤活性筛选研究〔J〕.中华中医药杂志,2006;21(5):298-300.
5 Gamble JR,Vadas MA.A new assay for the measurement of the attachment of neutrophils and other cell types to endothelial cells〔J〕.J Immunol Methods,1988;109(2):175.
6 Glinskii OV,Huxley VH,Glinsky GV,et al.Mechanical entrapment is insufficient and intercellular adhesion is essential for metastatic cell arrest in distant organs〔J〕.Neoplasia,2005;7(5):522-7.
7 Joyce JA.Therapeutic targeting of the tumor microenvironment〔J〕.Canc-er Cell,2005;7(6):513-20.
8 Laferrière J,Houle F,Huot J.Adhesion of HT-29 colon carcinoma cells to endothelial cells requires sequential events involving E-selectin and integrin beta 4〔J〕.Clin Exp Metastasis,2004;21(3):257-64.
9 Shaker OG,Ay El Deen MA,Abd El-Rahim MT,et al.Gene expression of E-selectin in tissue and its protein level in serum of breast cancer patients〔J〕.Tumori,2006;92(6):524-30.
10 Qi HL,Zhang Y,Ma J,et al.Insulin/protein kinase B signalling path way upregulates metastasis-related phenotypes and molecules in H7721 human hepatocarcinoma cell line〔J〕.Eur J Biochem,2003;270(18):3795-805.
11 李文桦,罗建民,张 英,等.α1,3 FucT-Ⅶ基因转染对人结肠癌LOVO 细胞的作用〔J〕.复旦学报(医学版),2008;35(4):569-73.

