缺血性脑卒中患者血管性认知功能障碍的影响因素
王 崇 王建明 董瑞国 窦长新 (南通大学附属建湖医院神经内科,江苏 盐城 224700)
血管性认知障碍(VCI)主要由血管因素导致的从轻度认知障碍到痴呆的一类综合征,现为仅次于阿尔茨海默病(AD)导致痴呆的第2位原因〔1〕。在缺血性脑卒中后部分患者以认知、情感、人格和行为的受累为主要表现,该类型的认知障碍往往不能被及时识别,未能及时干预,发展为明显的痴呆,给患者和家庭带来严重负担。由于缺血性脑卒中部分危险因素是可以治疗的,因此控制好危险因素有可能预防、延缓或减轻VCI〔2,3〕。本研究探讨缺血性脑卒中患者VCI的影响因素。
1 对象和方法
1.1 研究对象 2011年7~12月于南通大学附属建湖医院神经内科收治的脑梗死患者,由头部磁共振成像(MRI)证实,所有的入选者均签署知情同意书并能够配合完成研究。根据评分结果分为脑梗死后VCI组和脑梗死非认知功能障碍(NVCI)组。所有患者入院时均经过神经心理评估和头颅影像学检查评定。VCI组:①患者有认知损害,但不符合美国精神障碍诊断和统计手册第4版的痴呆诊断标准。②无其他脑部病变如肿瘤、多发性硬化、脑积水等。排除标准:①患脑梗死前已明确或可疑认知功能障碍;由脑血管病以外的原因导致的认知障碍(如癫痫、帕金森病、抑郁症、精神病、肝肾功能不全、甲状腺功能低下、酗酒或药物滥用等)。NVCI组:无认知功能损害。VCI患者60例,男35例,女25例,年龄(68.4±6.9)岁,受教育年限(8.1±4.2)年。NVCI患者81例,其中男46例,女35例,年龄(67.4±6.5)岁,受教育年限(8.3±3.9)年。
1.2 研究方法 入院时记录一般资料和病史 (性别,年龄,糖尿病病史,高血压史、房颤、吸烟等)、入院时检查纤维蛋白原(FIB),次日空腹化验血糖、甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白(LDL)等。患者均在入院后24 h内,空腹12 h以上抽取静脉血。影像学评估:由我院PACS平台调取,评价脑梗死部位,大小,数量,脑白质疏松程度等指标 。多发性脑梗死定义:多个中、小及腔隙梗死。脑白质疏松程度根据Fazekas等〔4〕描绘的标准划分 (0~3分),Fazekas 0级:没有或一个WMH病变信号斑点;Fazekas 1级:多个病变信号斑点;Fazekas 2级:病灶开始相互融合(桥形成);Fazekas 3:级 融合成大的病灶。0分为无WMI、1分为轻度WML组、2分及以上为中重度WML组。脑萎缩脑萎缩的测量方法参考吴恩惠〔5〕和Saka等〔6〕所用的方法:由2名临床医师分别进行图像的检验。颞叶海马沟回间距、双侧侧裂宽度、第三脑室宽度、哈氏值、脑室指数和侧脑室体部指数,以反映脑萎缩和脑室扩大的程度。认知功能障碍评定:参照文献〔3〕使用蒙特利尔认知评估量表(Mo-CA)和简易精神状态量表(MMSE)。MMSE评分标准:小学文化程度21~26分,中学文化程度23~26分,大学文化程度24~26分定义为无痴呆的认知功能障碍(文盲患者检查合作性差,未选取)。蒙特利尔认知评估量表北京版(MoCA):MOCA评分<26分无痴呆的认知功能障碍,均由神经内科同一位医师经培训后进行评定。
1.3 统计学方法 采用SPSS16.0软件。计数资料比较行χ2检验。计量资料中服从正态分布者采用s表示,两样本均数比较行Independent-Samples t检验,多个样本比较采用One-Way ANOVA检验。定量资料中不满足正态性分布的资料采用中位数和四分位数表示,并采用非参数检验中Mann-Whitney U法。
2 结果
2.1 两组一般资料比较 两组在年龄,性别、教育程度上,吸烟史、高血压史、饮酒史、房颤病史、TC、TG、LDL、Apoa、Apob、FIB、血糖水平差异无统计学差异(P>0.05)。见表1。
2.2 两组患者梗死病灶数目 VCI组病灶4个以上比例明显高于NVCI组(P=0.004)。见表2。
2.3 新发不同梗死部位患者的MMSE,MOCA评分比较 对新发病灶部位的患者MMSE,MOCA进行评分,颞叶、尾状核头部、丘脑、额叶、多发新发梗死灶、脑干,小脑组、基底节余部位、顶枕叶组中额叶组、颞叶组、丘脑组、尾状核头部、多部位梗死组认知功能障碍MMSE,MOCA评分低于其他部位梗死组(P<0.05)。见表3。
2.4 两组患者患者脑白质疏松情况 VCI组病人颅脑MRI显示伴有白质疏松的发生率多于NVCI组,尤其以中重度脑白质疏松为主(P=0.004)。见表4。
2.5 两组患者脑萎缩情况 如表5所示,VCI组哈氏值,第三脑室宽度,颞叶海马沟回间距较NVCI组增大,脑室指数,侧脑室体部指数,前角指数较NVCI组减小(P<0.05)。

表1 两组患者一般临床资料比较〔n(%)〕

表2 两组患者梗死灶数目比较〔n(%)〕
表3 新发不同梗死部位患者MMSE,MOCA评分比较(s)
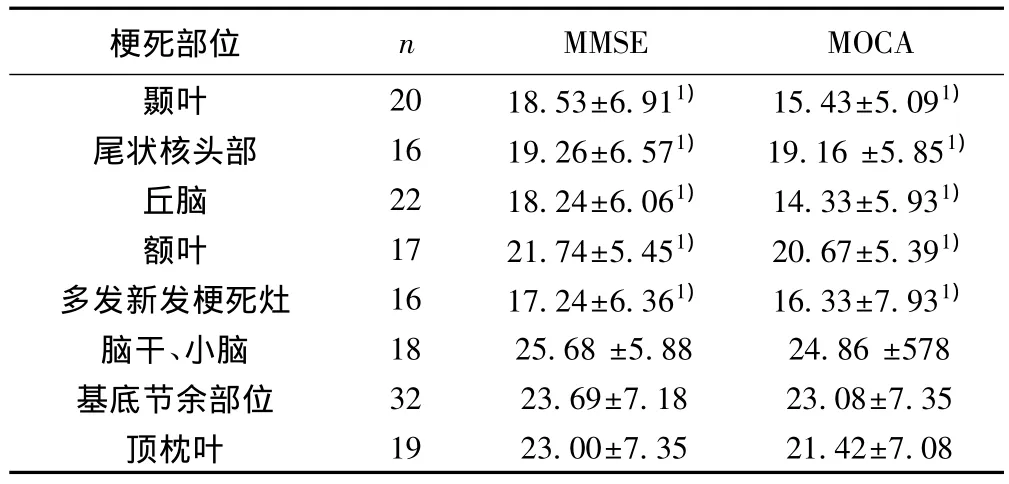
表3 新发不同梗死部位患者MMSE,MOCA评分比较(s)
与脑干、小脑,基底节余部位和顶枕叶组比较:1)P<0.05
梗死部位 n MMSE MOCA颞叶 20 18.53±6.911) 15.43±5.091)尾状核头部 16 19.26±6.571) 19.16 ±5.851)丘脑 22 18.24±6.061) 14.33±5.931)额叶 17 21.74±5.451) 20.67±5.391)多发新发梗死灶 16 17.24±6.361) 16.33±7.931)脑干、小脑 18 25.68 ±5.88 24.86 ±578基底节余部位 32 23.69±7.18 23.08±7.35顶枕叶 19 23.00±7.35 21.42±7.08
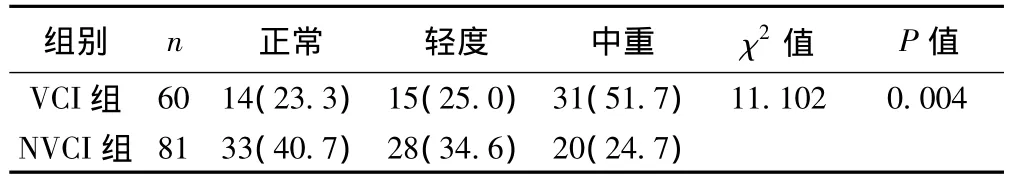
表4 两组患者脑白质疏松比较〔n(%)〕
表5 两组患者脑萎缩情况比较(s)

表5 两组患者脑萎缩情况比较(s)
与NVCI组比较:1)P<0.05
组别VCI组(n=60)NVCI组(n=81)哈氏值(cm)5.2±0.81) 4.45±0.5脑室指数 1.46±0.41) 1.57±0.5侧脑室体部指数 4.0±0.71) 4.6±0.6前角指数 3.5±0.81) 4.0±0.7第三脑室宽度(mm)5.3±1.31) 4.4±1.2颞叶海马沟回间距(cm)3.02±0.551) 2.47±0.43
3 讨论
脑血管病人口统计学危险因素包括年龄,性别、吸烟史、高血压病史、饮酒史、房颤病史,TC,TG,Ldl,Apoa,Apob,FIB,血糖等升高〔7〕。本研究显示在VCI组和NVCI组这些危险因素差别不大。这些危险因素是大血管病的危险因素,在较大程度上增加脑大血管病的风险,但在增加VCI方面未见差异,这可以在一定程度排除普通脑血管危险因素对于认知功能的影响,可能存在其他隐匿性危险因素。
Madureira等〔8〕研究认为,脑梗死的部位比体积更重要,尤其是额叶、顶叶、角回及丘脑等脑部重要部位的梗死灶极易引起认知障碍。梗死部位对于VCI非常重要,然而有研究结果不一致,这主要是因为研究人群的不同和方法的差异〔9〕,以下梗死部位被认为与认知损失有关:双侧半球病变,左侧半球病变,丘脑,大脑前额叶病变。本研究显示VCI组中颞叶组、丘脑组、尾状核头部、多部位梗死组认知功能障碍患者多于其他部位梗死组,说明上述部位的梗死容易引起VCI。其可能原因是额颞叶为语言高级中枢,与语言、认知关系密切,当梗死灶累及这些部位重要皮质或联系纤维,引起的前额叶,皮质下环路受损,从而引起认知功能损害,包括执行功能障碍、信息加工速度减慢、视空间结构受损〔10〕。
本研究结果提示脑梗死患者的梗死灶数目是影响其认知功能的重要因素,可能因为病灶越多,脑结构受累越多,关键部位越容易损害,尤其是与认知相关的脑组织功能损害机会较多,出现认知功能障碍。研究已证实梗死体积和神经功能缺损之间的相关性较差,但体积可能存在累加效应。如在多发梗死,非痴呆的认知功能障碍的梗死体积可低到0.945 ml,痴呆可能发生梗死体积最小可在1~30 ml,皮质病变即使在梗死体积平均8 ml梗死的情况下可引起VCI〔9〕。但由于目前病例研究标准不一致,方法差异较大,梗死体积和神经功能缺损之间的相关性还不能完全证实,梗死体积可能存在累加效应。
脑白质疏松患者是偶发脑卒中和认知功能障碍危险因素,认知功能障碍与脑白质病变相关。脑白质损害(WML)患者早期临床往往不被重视,异质性强,而伴有轻度认知功能障碍(MCI)的患者病情往往发展快,病死率高。Verdelho等〔11〕通过对639例老龄脑白质疏松患者进行的3年随访,有90例患者演变为痴呆,147例患者演变为无痴呆的认知功能障碍,脑白质疏松是发展为痴呆和认知功能障碍的独立危险因素。Kramer和 van Dijk的研究利用动态的成像证实〔12,13〕,散在的点状白质异常与认知功能关系较小,进展较快的点片状白质融合与认知下降发展相关。脑白质损害是主要的脑小血管疾病,是VCI重要原因〔14,15〕。在MRI检查中,标准T2加权图像脑白质的变化显示为高信号强度,从非常轻微的组织变化(点状病变)到明确的缺血性异常(完整的脱髓鞘和轴索损失)甚至片状融合。在奥地利脑卒中预防研究中〔16〕证明脑白质病变的进展,脑萎缩和认知功能的增加量的白质病变有一个复杂的相互作用。脑容量的变化比白质病变体积增加与认知能力下降更是密切。缺血性脑白质病变可能会破坏基底神经节和背外侧的前额叶皮层的纤维连接,这些病变妨碍病人对任务形象化能力和恰当整合和执行。白质病变的进展对老年人的功能状态也是强调脑白质病变体积增加导致步态性能受损和预测在相对较短的一段时间全面功能衰退〔17〕。
本研究海马沟回间距的增宽提示有海马部位的萎缩,脑室指数,侧脑室体部宽度指数减少提示脑室显著扩张,说明急性脑梗死合并有脑萎缩可能发展为VCI。Cavalieri等〔18〕指出脑萎缩,尤其是纵向体积的缩小是血管性认知功能障碍的另一个重要的危险因素。奥地利脑卒中预防组织研究表明〔17〕脑实质体积减少,脑萎缩和认知功能下降中间存在复杂的相互作用。脑白质病变体积增加与认知能力的下降相关,但随着脑容量增加,病灶体积增加与认知能力的下降关联性已不再显著变化,也许说明认知能力的下降,涉及脑实质损失的比例(脑萎缩)比病灶的进展更密切〔18〕。到目前为止,仍然不能确定脑萎缩是否由孤立的血管病变或原发性脑组织退行性病变伴发。据推测,“血管”萎缩可能由于缺血性脑白质损伤引起的慢性功能改建和随后的皮层结构变化萎缩。在特定的大脑区域区域萎缩测量和评估皮层厚度可能有助于更好地确定的是否是脑萎缩引起的VCI。
1 Werring DJ,Gregoire SM,Cipolotti L.Cerebral microbleeds and vascular cognitive impairment〔J〕.J Neurol Sci,2010;299(1-2):131-5.
2 Pasi M,Poggesi A,Salvadori E,et al.Post-stroke dementia and cognitive impairment〔J〕.Front Neurol Neurosci,2012;30:65-9.
3 Hachinski V,Iadecola C,Petersen RC,et al.National Institute of Neurological Disorders and Stroke-Canadian Stroke Network vascular cognitive impairment harmonization standards〔J〕. Stroke,2006;37(9):2220-41.
4 Fazekas F,Chawluk JB,Alavi A,et al.MR signal abnormalities at 1.5 T in Alzheimer's dementia and normal aging〔J〕.AJR Am J Roentgenol,1987;149(2):351-6.
5 吴恩惠.头部 CT诊断学〔M〕.北京:人民卫生出版社,1985:158-9.
6 Saka E,Dogan EA,Topcuoglu MA,et al.Linear measures of temporal lobe atrophy on brain magnetic resonance imaging(MRI)but not visual rating of white matter changes can help discrimination of mild cognitive impairment(MCI)and Alzheimer's disease(AD)〔J〕.Arch Gerontol Geriatr,2007;44(2):141-51.
7 Kivipelto M,Ngandu T,Laatikainen T,et al.Risk score for the prediction of dementia risk in 20 years among middle aged people:a longitudinal,population-based study〔J〕.Lancet Neurol,2006;5(9):735-41.
8 Madureira S,Guerreiro M,Ferro JM.A follow-up study of cognitive impairment due to inferior capsular genu infarction〔J〕.J Neurol,1999;246(9):764-9.
9 Bowler JV.The concept of vascular cognitive impairment〔J〕.J Neurol Sci,2002;203-204:11-5.
10 Delano-Wood L,Abeles N,Sacco JM et al.Regional white matter pathology in mild cognitive impairment:differential influence of lesion type on neuropsychological functioning〔J〕.Stroke,2008;39(3):794-9.
11 Verdelho A,Madureira S,Moleiro C,et al.White matter changes and diabetes predict cognitive decline in the elderly:the LADIS study〔J〕.Neurology,2010;75(2):160-7.
12 Kramer JH,Mungas D,Reed BR,et al.Longitudinal MRI and cognitive change in healthy elderly〔J〕.Neuropsychology,2007;21(4):412-8.
13 van Dijk EJ,Prins ND,Vrooman HA,et al.Progression of cerebral small vessel disease in relation to risk factors and cognitive conse-quences:rotterdam scan study〔J〕.Stroke,2008;39(10):2712-9.
14 Grueter BE,Schulz UG.Age-related cerebral white matter disease(leukoaraiosis):a review〔J〕.Postgrad Med J,2012;88(1036):79-87.
15 Chui H,Skoog I.Advances in vascular cognitive impairment 2005〔J〕.Stroke,2006;37(2):323-5.
16 Schmidt R,Ropele S,Enzinger C,et al.White matter lesion progression,brain atrophy,and cognitive decline:the Austrian stroke prevention study〔J〕.Ann Neurol,2005;58(4):610-6.
17 Inzitari D,Pracucci G,Poggesi A,et al.Changes in white matter as determinant of global functional decline in older independent outpatients:three year follow-up of LADIS(leukoaraiosis and disability)study cohort〔J〕.BMJ,2009;339:b2477.
18 Cavalieri M,Schmidt R.New development in diagnosis of vascular cognitive impairment〔J〕.J Neurol Sci,2010;299(1-2):11-4.

